灾难性抗磷脂综合征患者的临床特征及预后
2019-10-26赵久良李梦涛田新平曾小峰
黄 璨,赵久良,王 迁,李梦涛,田新平,曾小峰
抗磷脂综合征(antiphospholipid syndrome,APS)是以血栓事件、病理妊娠和抗磷脂抗体(antiphospholipid antibody,aPL)持续阳性为特征的一组自身免疫性疾病,是一种常见的易栓症,其血栓事件可累及动脉和静脉系统[1]。灾难性抗磷脂综合征(catastrophic antiphospholipid syndr-ome, CAPS)是最严重的特殊类型,发生于约1%的APS患者[2]。它最早于1992年由Asherson等[3]进行描述,10例aPL阳性患者在几小时至几天的时间内出现血管栓塞和急性多器官功能衰竭,并由于坏死组织释放炎症因子,引起全身炎症反应综合征。目前认为,CAPS主要以微血管内血栓形成为特点,在短期内形成血栓风暴及炎症风暴,累及全身脏器[4]。即便经积极救治,CAPS患者死亡率仍高达37%[5]。
由于CAPS发病率低、病死率高,研究非常困难。国际上对于CAPS的研究依托于2000年欧洲抗磷脂抗体论坛(European Forum on Antiphospholipid Antibodies)成立的国际CAPS队列,也称CAPS Registry[6],截止2014年,该队列已收集了500例CAPS患者[5],但国际上较少有来自中国的CAPS数据。
本研究回顾性分析北京协和医院CAPS患者,收集患者的人口学数据、临床表现、实验室检查、治疗及结局数据,分享诊治经验。
1 研究方法
CAPS的诊断标准于2003年由欧洲CAPS项目小组提出,其中包含4条具体标准:(1)临床表现:累及3个及以上的器官、系统和/或组织(血管栓塞需具有影像学证据,肾脏受累要求肌酐上升>50%、血压>180/100 mmHg和/或尿蛋白>0.5g/24 h);(2)起病:各临床表现同时或于1周内相继出现;(3)病理:至少有1个器官或组织的小血管阻塞的组织病理学依据(要求病理诊断有血管栓塞的证据,偶尔可并发血管炎表现);(4)实验室检查:抗磷脂抗体(LA和/或aCL和/或抗β2GPI)阳性持续6周以上(若发病前未诊断APS,则要求aPL阳性不少于2次、持续时间不短于6周)。确诊的CAPS要求满足上述4点。可能的CAPS包括4种情况:(1)有上述4条表现,但只有2个器官、系统和/或组织受累;(2)有上述4条表现,但患者发病早期即死亡、抗体阳性不足6周;(3)仅满足上述(1)(2)(4);(4)仅满足上述(1)(3)(4),第3个临床事件在使用抗凝药物的情况下在1周后、但1月内出现[3]。
本研究纳入的13例CAPS住院患者中,11例为确诊CAPS,2例为可能CAPS。本研究对患者的人口学数据、临床表现、实验室检查、治疗和结局进行统计与分析,并与国际CAPS队列进行比较。
2 结果
2.1 基本资料
研究共纳入2015年1月至2018年12月北京协和医院诊治的13例CAPS住院患者(表1)。13例患者CAPS发病平均年龄(33.8±13.0)岁;男性8例(62%),女性5例(38%);其中7例(54%)患者APS的首发表现即为CAPS。本研究患者中原发APS 8例,占62%;5例继发APS患者中,3例(23%)继发于系统性红斑狼疮(systemic lupus erythematosus, SLE),2例(15%)继发于其他结缔组织病(connective tissue diseoise, CTD)。本组患者基本资料及诱发因素与国际CAPS Registry的对比见表2。
2.2 诱因
13例患者均有一次CAPS发作。其中7例(54%)患者CAPS的诱发因素是感染,包括5例肺部感染、1例胆系感染和1例泌尿系感染;有3例患者由于停用华法令或INR不达标而诱发CAPS,占23%;有2例女性患者由妊娠诱发CAPS,占15%;另有1例患者在肠系膜上动脉切开取栓术后出现CAPS表现,占8%(表2)。
2.3 临床表现
经典的APS以大、中血管血栓栓塞为主,而CAPS大血管病变少见、以微血管血栓栓塞为主,因广泛的微血栓栓塞事件导致急性多器官功能障碍。Cervera总结CAPS Registry 500例患者的受累系统:肾脏受累占73%,主要为肾功能衰竭,可伴蛋白尿、高血压、血尿;肺脏受累为60%,主要表现为急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS),肺栓塞及弥漫性肺泡出血等;中枢神经系统受累56%,多表现为脑梗塞,也可表现为颅内静脉血栓、脑炎或癫痫;心脏受累为50%,可表现为心梗、心肌炎、心衰、Libman Sacks心内膜炎等;皮肤受累为47%,可有坏疽、溃疡、紫癜、网状青斑等;肝脏受累为39%,可有肝酶升高、黄疸、肝脏肿大、肝衰等;外周血栓占37%,可出现动脉及静脉血栓;胃肠道受累占24%,可出现消化道出血、结肠炎等;脾脏(18%)及肾上腺(10%)均可出现梗死灶。此外,眼部受累可表现为前部缺血性视神经病(anterior ischemic optic neuropathy AION)及视神经炎,胆囊受累可出现胆囊梗死、无石性胆囊炎等。本研究主要对CAPS的受累系统进行统计。本组患者临床累及的系统主要是心脏(11例,85%)、肾脏(11例,85%)、神经系统(8例,62%),其他受累器官包括皮肤(5例)、肺(5例)、眼(4例)、肝脏(3例)、外周血栓(3例)、胃肠道(2例)、胆囊(1例)、脾(1例)和肾上腺(1例)。本组患者临床表现及检验结果与国际CAPS Registry的对比见表3。
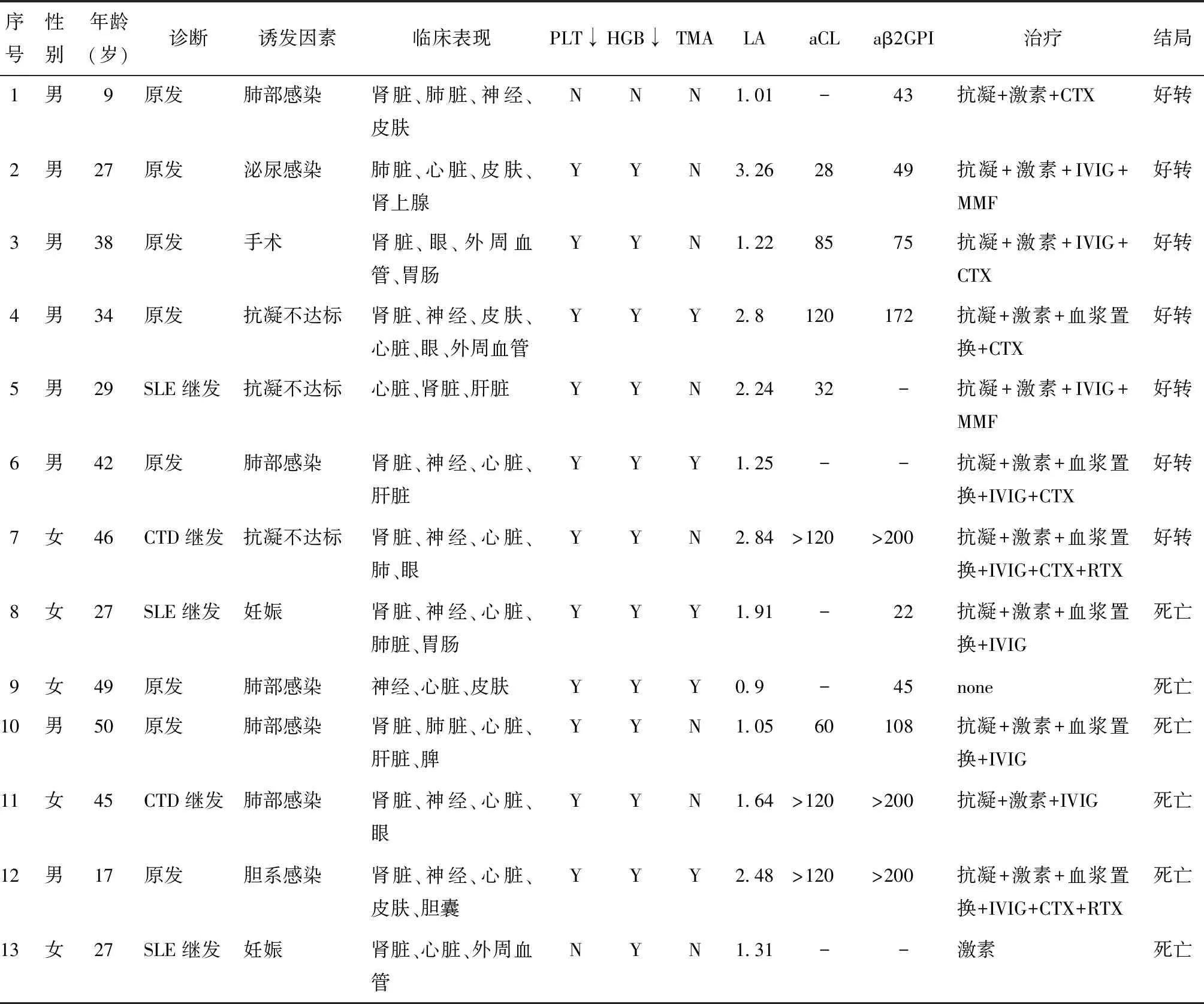
表1 北京协和医院13例CAPS患者的临床资料、治疗及结局Table 1 Clinical manifestations, treatment, and outcome of 13 CAPS patients from PUMCH
PLT:血小板; HGB:血红蛋白; TMA:血栓性微血管病变; LA:狼疮抗凝物; aCL:抗心磷脂抗体; aβ2GPI:抗β2糖蛋白Ⅰ抗体;CTX:环磷酰胺; IVIG:静脉注射人免疫球蛋白; MMF:吗替麦考酚酯;SLE:系统性红斑狼疮; RTX:美罗华; CTD:结缔组织病
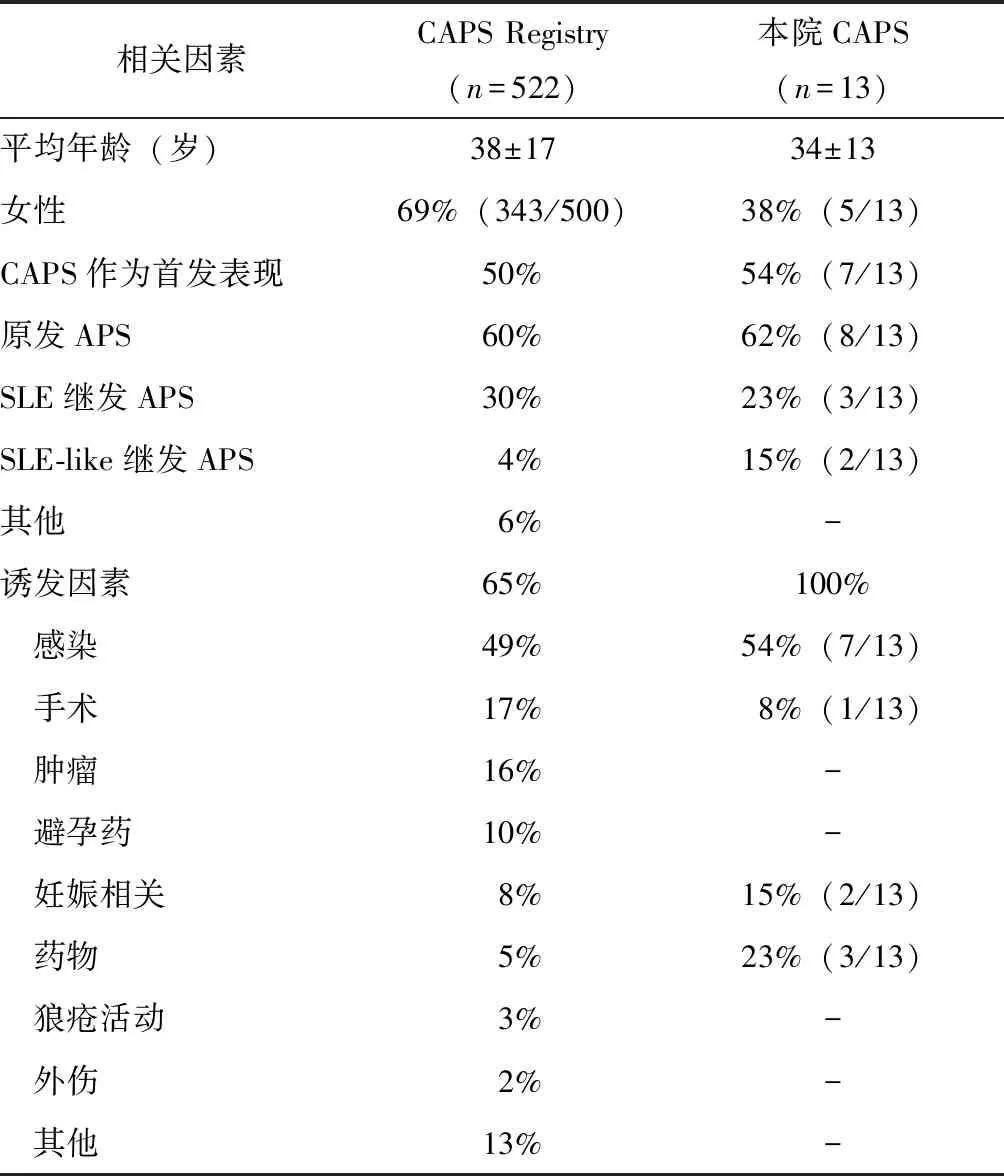
表2 北京协和医院CAPS患者与CAPS Registry基本资料、分类及诱发因素对比Table 2 Comparison of demographic data, classification,and precipitating factors between CAPS patients from PUMCH and CAPS Registry
CAPS:灾难性抗磷脂综合征;APS:抗磷脂综合征;SLE:系统性红斑狼疮
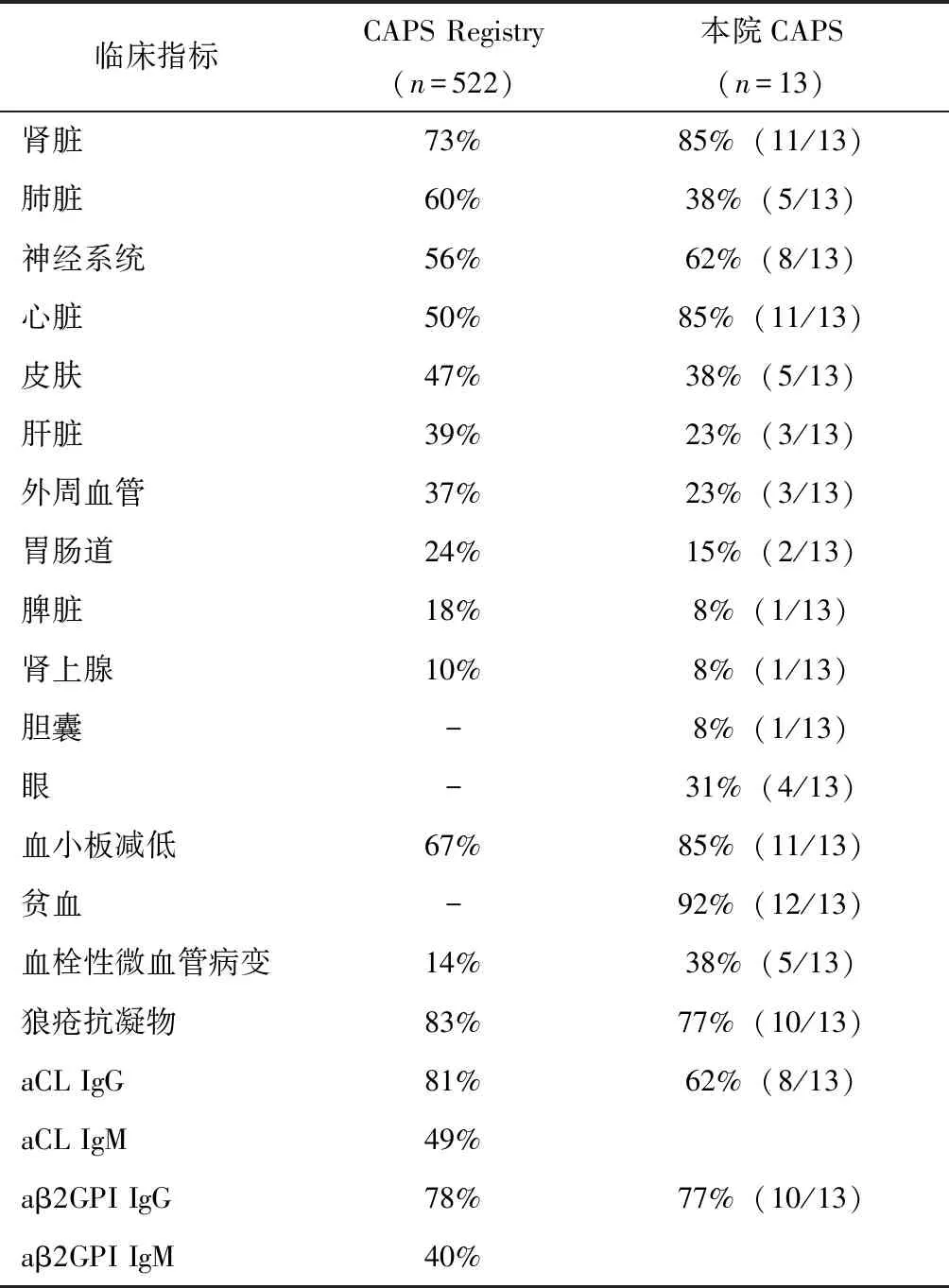
表3 北京协和医院CAPS患者与CAPS Registry临床表现及检验结果对比Table 3 Comparison of organs involvement and laboratory results between CAPS patients from PUMCH and CAPS Registry
CAPS:灾难性抗磷脂综合征;aCL:抗心膦脂抗体;aβ2GPI:抗β2糖蛋白Ⅰ抗体
2.4 实验室检查
贫血见于12例患者(92%),血小板减低见于11例患者(85%),5例患者出现了血栓性微血管病变(thrombotic microangiopathy, TMA; 38%)。抗磷脂抗体谱方面,狼疮抗凝物阳性者10例(77%),抗心磷脂抗体阳性8例(62%),抗β2糖蛋白抗体阳性10例(77%),三者均为阳性者6例(46%)。
2.5 治疗
大部分患者都接受了抗凝(11例,85%)和糖皮质激素治疗(12例,92%),其中抗凝为低分子肝素或华法令,激素剂量为大剂量[1 mg/(kg·d)]或冲击剂量(1 g/d×3 d)。8例(62%)患者使用了丙种球蛋白(intravenous immune globulin,IVIG),6例(46%)进行了血浆置换治疗。共10例(77%)患者采用了“激素+抗凝+血浆置换和/或IVIG”三联疗法,其中5例(38%)同时给予血浆置换和IVIG。免疫抑制剂方面,8例患者接受了环磷酰胺(CTX),2例患者使用了吗替麦考酚酯(MMF)。另有2例难治性APS患者尝试了美罗华治疗。本院CAPS患者及国际CAPS Registry的治疗及结局对比见表4。
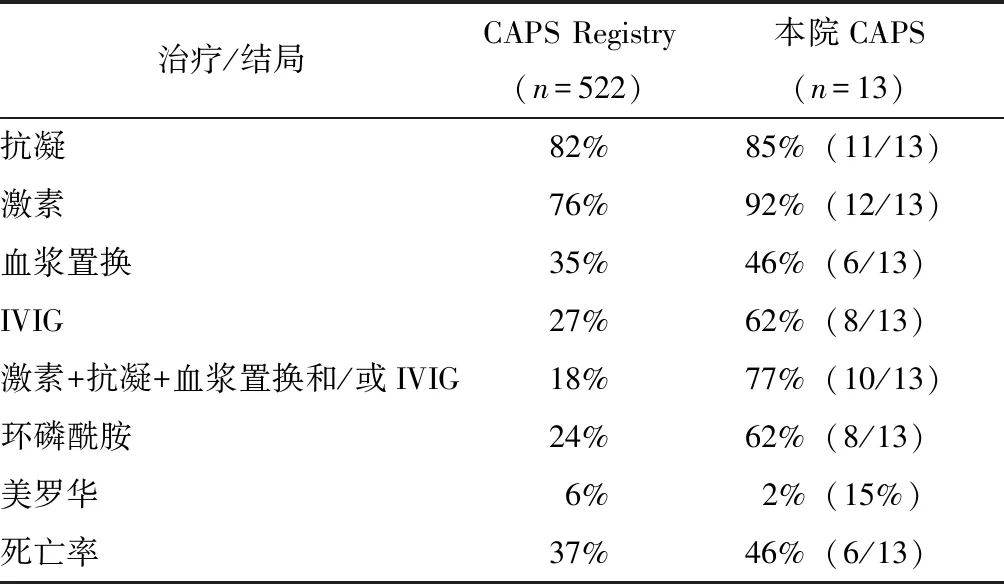
表4 北京协和医院CAPS患者与CAPS Registry治疗及结局对比Table 4 Comparison of treatment and progrosis between CAPS patients from PUMCH and CAPS registry
IVIG:静脉注射人免疫球蛋白
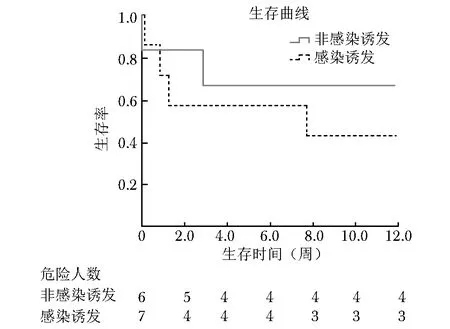
图 1 感染与非感染诱发CAPS活动患者的生存曲线Fig 1 Kaplan-meier survival curve of CAPS patients
2.6 临床结局
6例患者治疗无效死亡,其中4例接受了激素+抗凝+血浆置换和/或IVIG的标准治疗方案,另2例患者CAPS为首发表现,由于病情较重,尚未进行综合强化治疗即死亡。即便治疗已较为规范,这组CAPS患者的病死率仍高达46%,尤其是在感染诱发疾病活动组,病死率更高达57%(4/7)。图1对比了感染诱发组及非感染诱发组,可以看出感染诱发组患者的预后更差。6例死亡患者的生存时间均小于8周;7例存活患者平均随访26.1月,尚无死亡病例。
3 讨论
CAPS常在短期内出现血管栓塞和多器官功能衰竭,因发病急、病情重、死亡率高、抗磷脂抗体阳性,故命名为CAPS。北京协和医院免疫内科2015年至2018年共收治13例CAPS患者,与欧洲CAPS Registry进行对比,可以看出两组患者的基本特征差异不大。均是以年轻患者为主,男女均有。原发APS占60%~70%,继发APS中以SLE为主。CAPS的疾病活动多数存在诱因,超过50%的患者由感染诱发。
CAPS患者的典型临床表现是在短期内出现多脏器功能衰竭,国内外数据并无不同。在CAPS Registry的500例CAPS患者临床表现分析中,常见受累器官为肾脏、肺、神经系统、心脏和皮肤,与本中心CAPS患者的受累脏器分布基本一致。上述受累系统中,临床表现并非由于大血管栓塞事件所致,更多的是由于CAPS的微血栓形成和炎症反应导致器官功能衰竭。
血栓性微血管病变(thrombotic microangiopathy,TMA)除了CAPS,也可见于血栓性血小板减少性紫癜(thrombotic thrombocytopenic purpura,TTP)、溶血尿毒综合征(hemolytic uremic syndrome,HUS)、HELLP综合征(hemolysis,elevated liver enzymes,and low platelet syndrome)等[7],其临床表现相似,且感染可导致抗磷脂抗体一过性、低滴度升高[8],鉴别诊断困难。但抗磷脂抗体的持续、高滴度阳性对于CAPS的诊断十分重要[9],也被认为是CAPS多系统血栓形成的原因。已有研究发现,APS患者3种抗磷脂抗体(狼疮抗凝物、抗β2GPI、抗aCL)均为阳性的患者CAPS发病率更高,并且CAPS患者较APS患者抗体滴度更高[10]。血小板直接参与微血栓形成导致器官功能衰竭,血小板减低往往先于CAPS的临床表现,可能是APS患者进展为CAPS的信号[11]。
对于CAPS的治疗,既需要抑制血栓形成,也需要控制炎症反应[12]。根据第14届抗磷脂抗体国际会议的建议,CAPS的治疗首选“抗凝+激素+血浆置换和/或静脉注射丙种球蛋白”的三联疗法[9],并发SLE或其他自身免疫性疾病的患者可能从四联疗法(即三联疗法联合环磷酰胺)中获益,难治性CAPS患者可考虑使用利妥昔单抗(RTX)[13]或依库珠单抗[14]。但并无指南指导如何进行三联治疗,包括何时进行血浆置换、激素剂量及减量方案、IVIG的剂量及疗程等。有中心经验报道,血浆置换和IVIG应同时给予,如只有条件采用一项,血浆置换优于IVIG[10]。本中心有10例(77%)患者接受了经典三联疗法,治疗相对规范。
CAPS预后极差,国际队列研究病死率为33%,继发于SLE的CAPS患者病死率高达48%[5]。本组患者即便治疗规范,仍有高达46%的病死率,且死亡患者的生存时间均未超过8周。而如能早期控制住病情,患者的远期生存尚佳,存活患者平均随访26月,目前仍无死亡病例,提示早期控制病情,才有可能改善患者预后。
文献报道,继发于SLE或有肾、脾、肺、肾上腺任一脏器受累的患者预后较差[15]。本研究尤其关注患者的CAPS病情活动是否由感染诱发,通过对比两组患者的生存曲线发现,感染诱发组预后更差,死亡率可高达57%。提示应在早期更积极的加强抗感染治疗[16]。
本研究的不足在于队列较小,患者例数少。随着诊治经验的不断积累,希望能够更多的分享来自中国的数据。
综上所述,CAPS患者病情危重、预后极差,国内外并无显著不同。本研究发现,早期控制病情有助于提高远期预后;感染诱发的患者预后更差,需早期积极加强抗感染治疗。
