1株赛鸽新城疫强毒株的致病特性及分子特征分析
2019-10-24李珮瑶高晶萍王存连徐明举张瑞华兰金苹
李珮瑶,高晶萍,田 勇,王存连,徐明举,利 凯,李 军,张瑞华,兰金苹,徐 彤,
(1.河北北方学院 预防兽医学重点实验室,河北 张家口 075000;2.河北北方学院 生命科学研究中心,河北 张家口 075000)
鸽新城疫是由鸽Ⅰ型副黏病毒(Pigeon paramyxovirusⅠ,PPMV-Ⅰ)引起的常流行于鸽群的高度接触性传染病,临床主要表现为鸽群肠炎、下痢、扭头转圈等神经症状[1],因发病症状与鸡新城疫神经型相似,故将其称为鸽新城疫,是危害鸽养殖业的重要疾病之一。鸽新城疫起源于20世纪70年代末的中东地区[2],在世界各地均有发生。我国肉鸽、赛鸽以及观赏的鸽子数量庞大,尤其因赛鸽的放飞、集训等导致其活动范围十分广泛,而且据报道,目前有250余种鸟类可自然或人工感染新城疫病毒(NDV)[3],因此,赛鸽作为自然宿主也可使其他易感动物交叉感染发生新城疫。KOMMERS 等[4]发现,鸽新城疫病毒在白羽来航鸡体内传代后毒力增强,引起2周龄鸡感染后出现明显临床病症并导致死亡。张淑霞等[5]发现,用LaSota油佐剂灭活疫苗免疫的肉种鸽对鸽新城疫病毒SX株人工感染的保护率仅为66.7%。由此可见,鸽在新城疫的传播过程中扮演着不可忽视的病毒携带者的角色,故对鸽新城疫的防控要足够重视。
新城疫病毒基因组按3′到5′端的顺序为NP-P-M-F-HN-L 6个基因片段,其中F蛋白是重要的致病性因子,与新城疫病毒的毒力强弱密切相关,是新城疫病毒分子病毒学重点研究对象[6-7]。本试验从河北送检赛鸽疑似新城疫病料中分离到1株病毒,经鉴定该分离毒株为新城疫病毒,命名为HB株;随后进行致病性试验和毒力测定。同时对其F基因进行扩增测序,将其与GenBank中已发表的流行毒株和我国部分疫苗毒株的F基因进行遗传进化分析和氨基酸同源性比较,旨在确定鸽群中新城疫流行病毒的分子遗传特征及变异情况,为鸽群新城疫疫苗毒株的选择提供借鉴。
1 材料和方法
1.1 材料
1.1.1 病料及供试动物 疑似赛鸽新城疫的病料,由河北某赛鸽养殖场提供;SPF级种蛋购于山东省济南赛斯家禽科技有限公司;1日龄雏鸡由本实验室孵化;6周龄SPF鸡购于北京实验动物中心;30~40日龄、未经任何免疫试验雏鸽购于张家口市某肉鸽养殖场。
1.1.2 主要试剂 新城疫标准诊断抗原和阳性血清、禽流感标准阳性血清(H5、H7和H9)和鸡减蛋综合征阳性血清购于北京中越科技有限公司;RNAiso Plus、RNA PCR Kit(AMV)Ver.3.0购于TaKaRa(大连)有限公司;DEPC、50×TAE购于北京索莱宝科技有限公司;TIANgel Midi Purification Kit购于天根生化科技有限公司;乙醇、氯仿、异丙醇等购于天津光复精细化学研究所有限公司。
1.2 方法
1.2.1 病毒分离鉴定 取病鸽肝脏、脾脏、肺脏、胰腺等器官,常规处理后接种SPF鸡胚,0.2 mL/胚,96 h后收获尿囊液。连续盲传3代后,收获病毒作为待检病毒。将上述待检病毒用血凝(HA)与血凝抑制(HI)试验进行初步判定。
1.2.2 分离病毒致病性试验 取分离病毒进行鸽子人工感染试验,将12只未经免疫的30~40日龄雏鸽随机分为感染组和对照组,每组6只,感染组肌肉注射0.2 mL病毒液,对照组注射0.2 mL生理盐水,观察临床症状,统计发病率和死亡率。将发病死亡的鸽子及时进行病理剖检,取肝脏、脾脏、肺脏、胰腺、小肠等脏器组织,用10%福尔马林固定,经常规石蜡包埋,做病理切片。
1.2.3 分离病毒毒力指标测定 分离病毒毒力测定指标主要有鸡胚平均死亡时间(MDT)、1日龄雏鸡脑内致病指数(ICPI)和6周龄雏鸡静脉接种致病指数(IVPI),具体检测方法和判断标准参照国际兽疫局(OIE)推荐的动物疫病诊断方法和生物制剂要求手册[8]。
1.2.4 分离病毒分子特征分析
1.2.4.1 引物设计 参考GenBank中已发表的新城疫病毒F基因序列,设计1对特异性上下游引物,预计扩增F片段大小为1 897 bp,引物由上海生工生物工程公司合成。引物信息见表1。
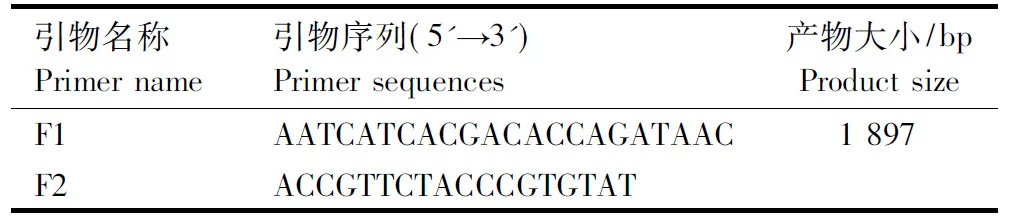
表1 F基因的PCR扩增引物序列Tab.1 PCR amplification primer sequences of F gene
1.2.4.2 RT-PCR 按照RNAiso Plus说明书提取病毒RNA,加入适量DEPC水溶解RNA沉淀,按TaKaRa RNA PCR Kit(AMV) Ver.3.0说明书步骤
进行反转录。反应体系:MgCl24 μL、10×RT Buffer 3 μL、dNTP Mixture 2 μL、RNase Inhibitor 0.5 μL、AMV Reverse Transcriptase XL 1 μL、Oligo dT-Adaptor Primer 1 μL、RNA 10 μL,加水至 30 μL。样品加好混匀后,42 ℃ 45 min,95 ℃ 5 min,5 ℃ 5 min,反应结束后的产物为F基因的模板链,随后进行PCR反应。PCR反应体系:5×PCR Buffer 10 μL、灭菌水27.75 μL、TaKaRa ExTaqHS 0.25 μL、上游引物1 μL、下游引物1 μL、模板链10 μL,总体积50 μL。按如下条件进行PCR反应:94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,进行34个循环,而后72 ℃延伸10 min。反应结束后,取5 μL PCR反应产物进行0.8%琼脂糖凝胶电泳检测。
按照TIANgel Midi Purification Kit说明书进行DNA回收,然后取2 μL PCR反应产物进行0.8%琼脂糖凝胶电泳,检测DNA含量。由上海生工生物工程公司进行测序鉴定。
1.2.4.3F基因序列分析 将测得的F基因序列进行BLAST比对,从GenBank获取已发表的F基因序列(表2),按照文献[9]的方法取F基因47—420位的374个核苷酸对表2中所列基因进行分型,利用DNAStar和MEGA 6.06软件将分离到的HB株与表2中的各个基因型毒株以及传统疫苗毒株LaSota、V4、B1株比较,进行遗传进化树的绘制和氨基酸序列同源性的分析。
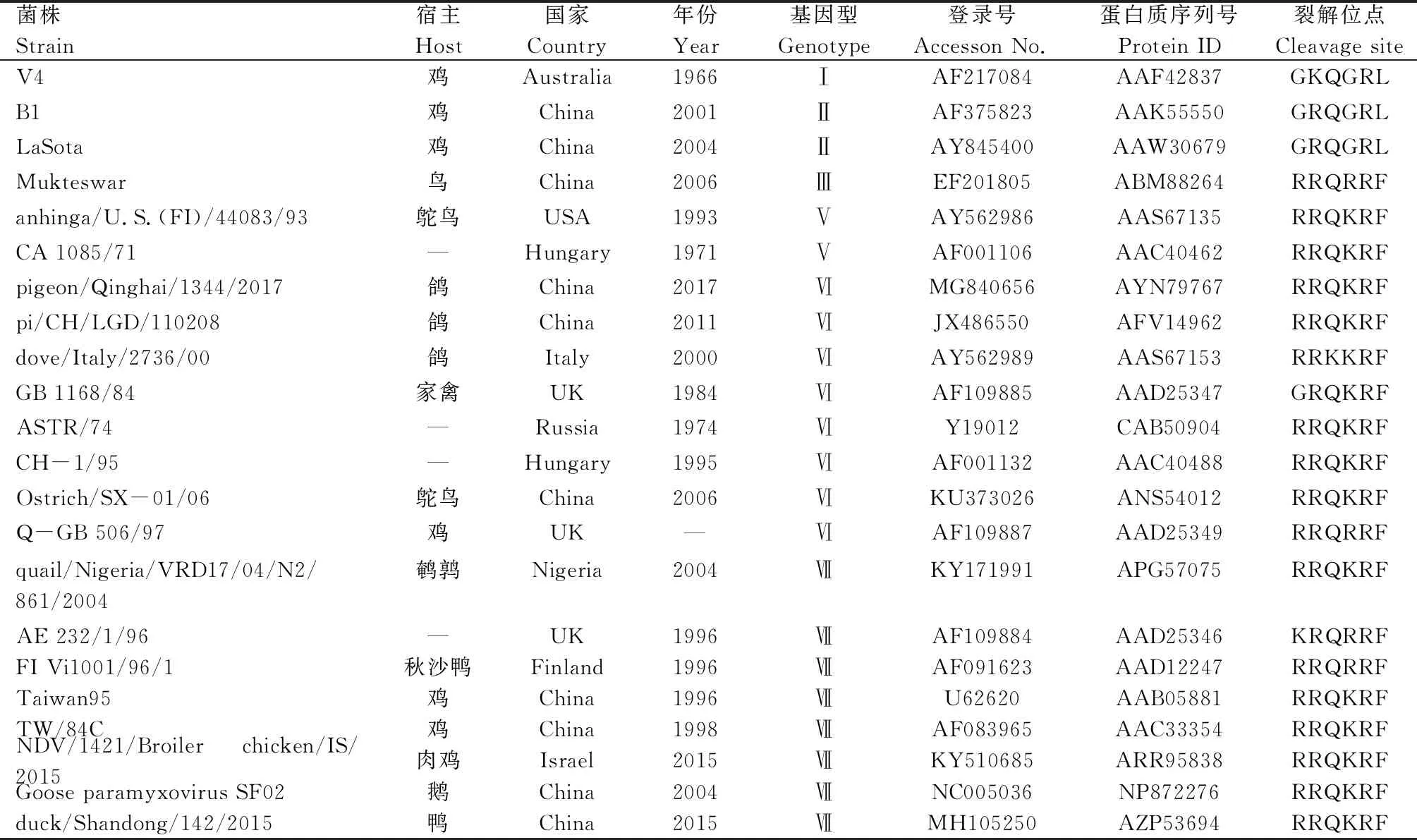
表2 试验用新城疫毒株的相关信息Tab.2 Properties of Newcastle disease virus strains in the study
注:“—”表示GenBank中无此项信息记录。
Notes: “—” means that there is no record of this information in GenBank.
2 结果与分析
2.1 病毒分离鉴定
SPF鸡胚在72 h内全部死亡,并且死亡鸡胚可见全身出血,鸡胚尿囊液HA效价为7 log2,经传代后其效价达9 log2。HI试验结果显示,新城疫标准阳性血清可抑制待检病毒凝集红细胞,而禽流感及鸡综合征标准阳性血清未能抑制待检病毒凝集红细胞,证明分离到的毒株为新城疫病毒,将其命名为HB株。
2.2 分离病毒致病性试验
鸽子在感染后48 h表现出精神沉郁、采食减少,伴有黄绿色下痢,并有肿眼流泪、扭头歪颈、转圈等神经症状;感染后4 d,有1只鸽子死亡;感染后第6天,其余5只鸽子也全部死亡,死亡率为100%。
剖检死亡鸽子可见,颈部皮下组织出血;十二指肠出血、肠壁变薄,直肠和泄殖腔黏膜有大量的出血点;胰腺肿胀、出血;心冠脂肪组织有点状出血;肺出血、肿大;腺胃乳头有出血点,肌胃有条状出血;脾脏肿大,有点状出血;气管环有出血(图1)。

A.胰腺出血;B.颈部皮下出血;C.肌胃出血;D.心冠脂肪组织出血;E.脾脏出血、肿大;F.气管环出血
从图2可看出,感染鸽子肺脏静脉充血,炎性细胞浸润于部分血管外围,肺房壁上皮细胞变性,部分坏死脱落,囊腔内有红细胞及淋巴细胞;脑组织微血管出现明显充血和淤血变化,其小血管出现炎性细胞渗出;脾脏小梁结构不清晰,红白髓界限模糊,组织间有大量红细胞;心肌纤维肿胀、纤维间有大量的红细胞;胰腺组织各级血管扩张充血,部分血管外围有炎性细胞浸润,间质中散在少量红细胞及淋巴细胞;肝脏血管扩张充血,多数肝窦扩张充血,间质增宽,其内散在红细胞和蛋白质渗出物;肾脏组织间有红细胞,血管周围有大量炎性细胞;小肠黏膜下出血明显,小肠绒毛出血、坏死,大量小肠绒毛断裂、脱落。
2.3 分离病毒毒力测定
HB株MDT为52.8 h,ICPI为1.78,IVPI为2.59,根据国际兽医局(OIE)推荐的判定标准,HB株属于强毒株。
2.4 分离病毒分子特征
2.4.1 RT-PCR扩增结果 根据设计的特异性引物,目的片段在1 897 bp左右,如图3所示,扩增出的片段与目的片段大小一致,含有1个大小为1 662 bp的完整开放阅读框,编码553个氨基酸。
2.4.2F基因遗传进化分析 将此次分离到的鸽新城疫强毒株HB株与GenBank中已发表的22株不同种属的新城疫病毒F基因进行比较,根据F基因高变区(47—420位)核苷酸序列绘制遗传进化树,如图4所示。结合进化树与BLAST比对结果可知,分离到的HB株属于Ⅵ型,HB株F基因与pigeon/Qinghai/1344/2017的序列相似性高达98.45%,与基因型为Ⅵ型的pi/CH/LGD/110208、dove/Italy/2736/00、Q-GB 506/97、ASTR/74、CH-1/95、Ostrich/SX-01/06在同一进化分支上;同时可看到HB毒株与国内传统新城疫疫苗毒株LaSota、B1、V4、Mukteswar株遗传距离较远,表明分离到的HB株与目前国内疫苗毒株基因型差异明显。
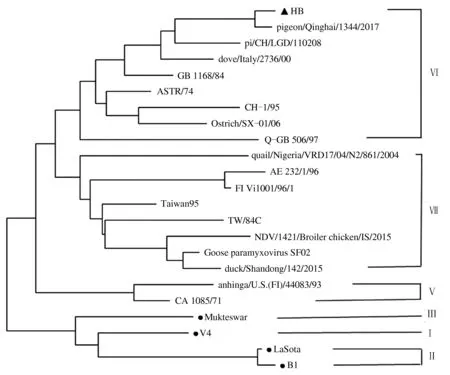
▲表示分离的HB株;●表示常用疫苗株LaSota、V4、B1、Mukteswar
2.4.3 氨基酸序列分析 将测得的HB株F基因核苷酸序列通过DNAStar软件翻译为氨基酸序列,结果发现,HB株F蛋白裂解位点氨基酸序列为112R-R-Q-K-R-F117,符合新城疫强毒株特点。通过DNAStar软件中的MegAlign程序将HB株F蛋白与GenBank已发表的表2中的22株新城疫病毒F蛋白进行氨基酸序列相似性比较,结果如图5所示,氨基酸相似性在83.8%~99.5%,其中HB株与pigeon/Qinghai/1344/2017相似性最高,达99.5%;与TW/84C氨基酸序列相似性最低,为83.8%;与传统疫苗毒株V4、B1、LaSota、Mukteswar株的相似性在88.1%~90.2%,表明分离的HB株与国内传统疫苗毒株有一定差异。

图5 HB株F蛋白氨基酸序列同源性分析Fig.5 Amino acid sequence homology analysis of HB strain F protein
3 结论与讨论
由于赛鸽在放飞过程中与各地野鸟、水禽、野鸽等接触机会多,导致赛鸽感染新城疫病毒的概率大大增加,而且鸽亦可作为病毒携带者传播给其他禽类,譬如鸡、野鸟等,给现代养禽业带来了严重的危害。因此,人们对鸽新城疫的防控意识需要大大加强。
本试验从河北地区赛鸽疑似新城疫病例中分离到1株病毒,经HA和HI试验证实分离毒株为新城疫病毒(命名为HB株)。为了确定HB株的致病力,将分离病毒肌肉接种新城疫抗体阴性雏鸽,感染鸽子出现精神沉郁、食欲废绝、黄绿色下痢以及神经症状,在感染后6 d内全部死亡,死亡率为100%,这与发病鸽的临床表现一致,其剖检变化也与临床发病鸽子病理变化相吻合,即肺脏、肠道、胰腺、腺胃等明显肿胀、出血。
为了确定HB株的毒力特征,根据OIE标准测定其MDT、ICPI和IVPI。强毒型判定标准为MDT 40~60 h、ICPI >1.6和IVPI>2.0[8]。本试验结果显示,HB株MDT为52.8 h、ICPI为1.78和IVPI为2.59,属于强毒株。袁小远等[10]从北京鸽群中分离到新城疫病毒PB9601株,测定毒力特征时发现该毒株的MDT、ICPI和IVPI分别为50.5 h、1.65和2.36,与本试验中HB株毒力指标相似,均符合新城疫强毒株的生物学毒力指标。
王林等[11]从北京免疫鸽群分离到BJP13株,发现该毒株接种鸡胚后72 h内全部死亡,其F蛋白裂解位点112—117位氨基酸序列为RRQKRF,符合强毒株的分子特征。目前认为,鸽新城疫是鸡新城疫病毒跨种感染鸽群适应的结果,具有很强的宿主特异性。研究表明,虽然大多数鸽源新城疫毒株F蛋白具有强毒株氨基酸的特征,但是其在鸡群中复制能力较差,甚至对鸡群没有致病力[12]。因此,F蛋白裂解位点是否可作为评价鸽新城疫病毒致病性的指标还有待进一步研究。
目前,绝大多数鸽新城疫病毒基因型属于基因Ⅵ型[13-14]。本研究中HB株经RT-PCR后进行F基因测序及进化分析,结果显示,该毒株F基因片段为1 897 bp,含有1个大小为1 662 bp的完整开放阅读框,编码553个氨基酸。其核苷酸序列通过DNAStar翻译为氨基酸序列,F蛋白裂解位点氨基酸排列为112R-R-Q-K-R-F117,结合致病性试验和毒力测定证实,本研究中分离的鸽新城疫病毒HB株为强毒株。遗传进化分析结果显示,HB株为Ⅵ型,其与pigeon/Qinghai/1344/2017的序列相似性高达98.45%。此外,与其在同一分支、亲缘关系较近的毒株还有Ⅵ型的pi/CH/LGD/110208、dove/Italy/2736/00、GB 1168/84、Q-GB 506/97、ASTR/74、CH-1/95、Ostrich/SX-01/06等,这与目前报道流行的鸽新城疫病毒属于Ⅵ型一致[15]。但是HB株与传统新城疫疫苗毒株LaSota、B1、V4、Mukteswar株遗传距离较远。以上结果表明,目前在鸽群流行的新城疫病毒株与常规鸡源性新城疫疫苗毒株基因型存在一定差异,这也是导致鸽群中新城疫流行的主要因素。朱杰等[16]在湖南及江苏免疫鸽群中分离出2株新城疫病毒,将其与疫苗毒株LaSota进行交叉中和试验,结果显示,这2株新城疫病毒与LaSota株抗原性差异很大,这可能是鸽群使用LaSota疫苗免疫后发生新城疫病毒感染的重要原因之一[17]。因此,为了有效防控鸽新城疫的发生,研制用于预防鸽群中新城疫病毒感染的基因Ⅵ型新型疫苗成为必然选择。
