琴叶榕根提取物对α-葡萄糖苷酶、α-淀粉酶的抑制作用
2019-10-23丘建媚李菲菲温正辉巫金高庄远杯张声源
丘建媚 李菲菲 温正辉 巫金高 庄远杯 张声源
【摘 要】 目的:研究琴叶榕根2种提取物对α-葡萄糖苷酶和α-淀粉酶活性的抑制作用。方法:采用超声辅助提取法制备琴叶榕根乙醇提取物,回流提取法制备琴叶榕根水提取物。以pNPG (对-硝基苯基- α-D -吡喃葡萄糖苷)和可溶性淀粉为底物分别测定琴叶榕根提取物对 α-葡萄糖苷酶(酵母来源和小鼠小肠来源)和α-淀粉酶活性的影响。结果:琴叶榕根乙醇提取物和水提取物均具有较好的α-葡萄糖苷酶和α-淀粉酶抑制活性,其对酵母菌源α-葡萄糖苷酶的半数抑制浓度(IC50值)分别为:(128.13±3.28)、(1923.45±3.24) μg/mL; 对小鼠小肠源α-葡萄糖苷酶的半数抑制浓度(IC50值)分别为:(531.04±5.72)、(2232.27±5.76) μg/mL;对α -淀粉酶的半数抑制浓度(IC50值)分别为:(714.25±4.37)、(1141.28±1.23) μg/mL。结论:琴叶榕根乙醇提取物抑制α-葡萄糖苷酶活性和α-淀粉酶均强于水提取物,有作为新型α-葡萄糖苷酶抑制剂开发价值。
【关键词】 琴叶榕;α-葡萄糖苷酶;α-淀粉酶
【中图分类号】R285.5 【文献标志码】 A【文章编号】1007-8517(2019)14-0026-04
糖尿病(Diabetes Mellitus,DM)是继肿瘤、心脑血管疾病之后的严重威胁人类健康的第三大疾病,为全球性公共卫生难题[1]。目前,临床治疗糖尿病主要采用化学药物疗法,但其有效率仅有70%,且长期连续服药会出现耐药、胃肠道反应和肝脏损害等不良反应[2-3]。且2型糖尿病由于胰岛素分泌不足及分泌高峰延迟,餐后血糖持续升高,进而引起血管内皮损伤、视网膜病变等并发症[4]。因此,有效控制餐后血糖上升是防治糖尿病及其并发症发生的重要途径之一。 α-葡萄糖苷酶和α-淀粉酶是碳水化合物消化为葡萄糖的关键酶,为降低餐后血糖的有效分子靶标[5],目前临床上广泛使用的α-葡萄糖苷酶抑制剂,如阿卡波糖,存在胃肠道反应[6]。从传统中草药中筛选新型的、安全有效的α-葡萄糖苷酶抑制剂已成为研究热点。
琴叶榕为桑科榕属琴叶榕Ficus pandurata Hance,又称为牛奶树根、牛奶子,主要分布于广东、广西、江西等地[7-8],具有清热、健脾开胃、溢气生津、祛湿化滞等功效,用于祛风、去湿、解毒、通乳等[8]。在梅州地区民间常用琴叶榕的根制作药膳,用于腰背酸痛、糖尿病、风湿病等的辅助治疗,但其药用及食用的科学内涵至今尚未明确,严重制约了琴叶榕根的开发利用[8-9]。实验以α-葡萄糖苷酶和α-淀粉酶为靶标,对琴叶榕根醇提取物和水提取物进行体外降血糖活性的比较研究,为其进一步开发利用提供理论依据。
1 仪器与材料
1.1 试药 药材琴叶榕根于2017年5月采购于广东省梅州市梅江区美苑市场,经笔者丘建媚主管中药师鉴定为桑科榕属琴叶榕(Ficus pandurata Hance)的根部。
1.2 试剂 酵母来源α-葡萄糖苷酶 (α-glucosidase,批号:SLBT8587,美国 Sigma 公司); α-淀粉酶(α-amylase,批号:SLBV0705,美国sigma 公司);4-硝基苯-α-D-吡喃葡萄糖苷 (4-N-trophenyl-α-D-glucopyranoside,pNPG,批号:K26J8B39810 ,上海源叶科技有限公司);3,5二硝基水杨酸(3,5-Dinitrosalicylic acid,批号:20170904,国药集团化学试剂有限公司);阿卡波糖(Acarbose,批号:BJ41706,德国拜耳有限公司);甲醇和乙腈腈(色谱纯,fisher scientific 公司);其他试剂均为国产分析纯。
1.3 仪器 Alliance2695型高效液相色谱仪(沃特世科技(上海)有限公司);UV-1800型紫外-可见分光光度计(日本岛津公司);MING-CHE 24ΜV型纯水仪(法国Merck Millipore公司);N-1100V型旋转蒸发仪(上海爱朗仪器有限公司);PB-21型pH计(赛多利斯科学仪器(北京)有限公司)。
1.4 实验动物 雄性健康昆明种小鼠(由广东省医学实验动物中心提供合格证号:SCXK(粤)2018-0002),体重18~22g。实验前动物适应性喂养1周。
2 方法
2.1 琴叶榕根提取物的制备 琴叶榕根干品1.0kg,粉碎,加入适量超纯水,回流提取2h,提取三次,过滤,合并滤液,减压浓缩后得到琴叶榕根水提取物(73.47g),备用。
琴叶榕根干品1.0kg,粉碎,加入适量的95%乙醇,浸泡12h,超声辅助提取(45℃,200W,60min)三次,过滤,合并滤液,减压浓缩后得到琴叶榕根乙醇提取物(90.42g),备用。
2.2 酶溶液的制备
2.2.1 酵母来源α-葡萄糖苷酶溶液的制备 将含酶冻干粉用磷酸盐缓冲溶液(67mmol/L,pH 6.8)溶解并定容于100mL容量瓶,即得1.0U/mL酶溶液,分装,于-20 ℃冰箱冻存,使用前解冻并用磷酸盐缓冲溶液稀释至0.1U/mL。
2.2.2 小鼠小肠来源α-葡萄糖苷酶溶液的制备 小鼠小肠来源α-葡萄糖苷酶参考文献[10]的方法进行提取,采用颈椎脱位的方法處死小鼠,获得小鼠小肠。分别采用4 ℃预冷的0.9% NaCl溶液和10mmol/L的磷酸钠缓冲液(pH 7.0)清洗肠道脂肪组织,纵向切开,洗净内容物,在滤纸上吸干,用剪刀剪碎后分别放入10mL离心管中,加入4 ℃预冷的磷酸钠缓冲液稀释,置匀浆机匀浆,后于4 ℃下8000r/min离心20 min,吸取上清液于10mL离心管中,即得鼠源α-葡萄糖苷酶,-20 ℃冰箱贮存以备用,使用前解冻并用磷酸盐缓冲溶液稀释至0.1U/mL。
2.2.3 α-淀粉酶溶液的制备 将含酶冻干粉用磷酸盐缓冲溶液(67mmol/L,pH 6.8)溶解并定容于1000mL容量瓶,即得500.0U/mL酶溶液,分装,于-20 ℃冰箱冻存,使用前解冻并用磷酸盐缓冲溶液稀释至3.75U/mL。
2.3 对α-葡萄糖苷酶的抑制活性 琴叶榕提取物对酵母来源和小鼠小肠来源α-葡萄糖苷酶抑制实验的反应体系参考文献[11]方法,并在其基础上进行了改进,具体如下:将67mmol/L pH 6.8 的磷酸盐缓冲溶液250μL、待测样品50μL(4000.0、2000.0、1000.0、500.0、100.0、0.0μg/mL)、0.1U/mL α-葡萄糖苷酶 300μL,振荡混匀,37 ℃恒温孵育 20min,加入4.0mmol/L pNPG 200μL,振荡混匀,37℃恒温反应 30min 后,加入碳酸钠800μL 终止反应,经0.45μm 膜过滤后,采用 HPLC 检测,按公式(1)计算对 α-葡萄糖苷酶的抑制率。阿卡波糖作为阳性对照。
α-葡萄糖苷酶抑制率%=(A0-Ai+Aj)/A0×100%公式(1)
注:A0 为缓冲液+酶液+底物反应后的 pNP 浓度;Ai:样品+酶液+底物反应后的 pNP 浓度;Aj:样品+缓冲液+底物反应后的 pNP 浓度。
2.4 色谱条件 色谱柱:XBridge Peptide BEH C18 柱(5μm,4.6mm×250mm);流动相: 乙腈(A)~0.1%甲酸水溶液(B)梯度洗脱条件:0~8min,20%~30% A;8~13min,30%~80% A;13~15min,80%~20% A;15~25min,20% A。流速:1.0mL/min;进样量:10μL;柱温:35℃;检测波长315nm。
2.5 对α-淀粉酶的抑制活性 参考文献[12],在反应体系中分别加入不同质量浓度的样品溶液0.3mL(4000.0、2000.0、1000.0、500.0、100.0、0.0μg/mL),取0.3mL α-淀粉酶溶液分别与样品混合均匀,置于37℃水浴中预温5min,加入0.3mL在37℃水浴中同时预温5min的1%可溶性淀粉溶液,混匀后反应15min,立即加入0.5mL DNS显色并终止反应,置于沸水中煮沸5min,随后放置于冰水中静置20min,磷酸缓冲溶液定容至5mL,在540nm下测吸光值,按公式(2)求得 α-淀粉酶的抑制活性。实验设阳性对照为阿卡波糖,空白对照为不加样品和酶液,空白组不加样品,背景对照为对应质量浓度的样品及底物溶液(不加酶液和样品以缓冲液补足)。
2.6 数据处理 数据采用Origin 8.5软件进行处理,以平均值加减标准差(x±s)表示。采用SPSS 22.0统计软件对数据进行分析,组间均数比较采用单因素方差分析,P<0.05表示差异有统计学意义。
3 结果
3.1 对α-葡萄糖苷酶的抑制活性 在α-葡萄糖苷酶的作用下,底物pNPG的糖苷键断裂,水解成的亮黄色物质对硝基苯酚(pNP),pNP在315nm有最大吸收,可通过高效液相色谱(HPLC)紫外检测器测定水解生成pNP的量。
3.1.1 精密度试验 在无抑制剂的条件下,按照2.3项,进行活性实验,同一份样品,重复进样6次,根据6次的pNP峰面积,计算得到RSD值为0.42%(n=6),表明HPLC精密度良好。
3.1.2 稳定性试验 在无抑制剂的条件下,按照2.3项,进行活性实验,同一份样品,分别于0、2、6、12、24h进行测定,结果显示pNP峰面积的RSD值为0. 60%,表明pNP在24h内稳定性良好。
3.1.3 重复性试验:在无抑制剂的条件下,按照2.3项,设6个实验组,分别进行活性实验,根据6次的pNP峰面积,计算得到RSD值为0.93%(n=6),表明方法重复性良好。
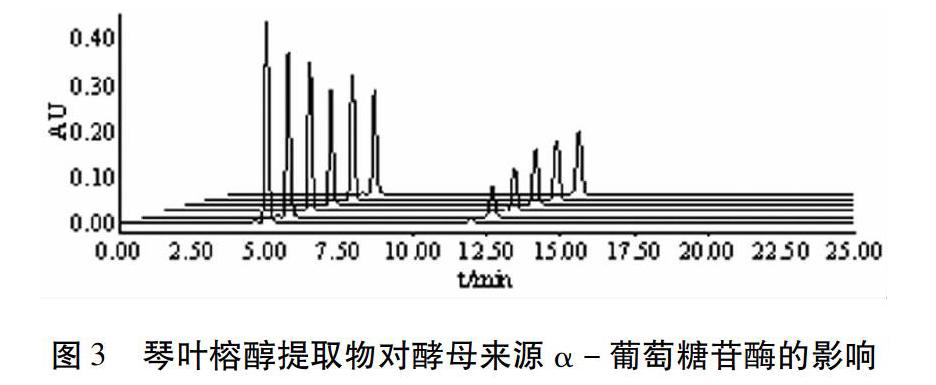
3.1.4 对α-葡萄糖苷酶的抑制率测定 由图1可知,无抑制时的pNPG和pNP色谱峰保留时间分别为4.99min、11.96min。此外,为考察提取物对pNPG和pNP的保留时间、峰型是否有影响,实验设不加酶溶液的实验组,结果见图2。实验结果表明,琴叶榕提取物对pNPG保留时间、峰型不产生影响。此外,在11.96min也未检测到峰,说明琴叶榕提取物在11.96min没有吸收,对pNP含量的检测无影响,同时也表明琴叶榕提取物不会使底物pNPG分解产生pNP,可避免假阳性实验的发生。
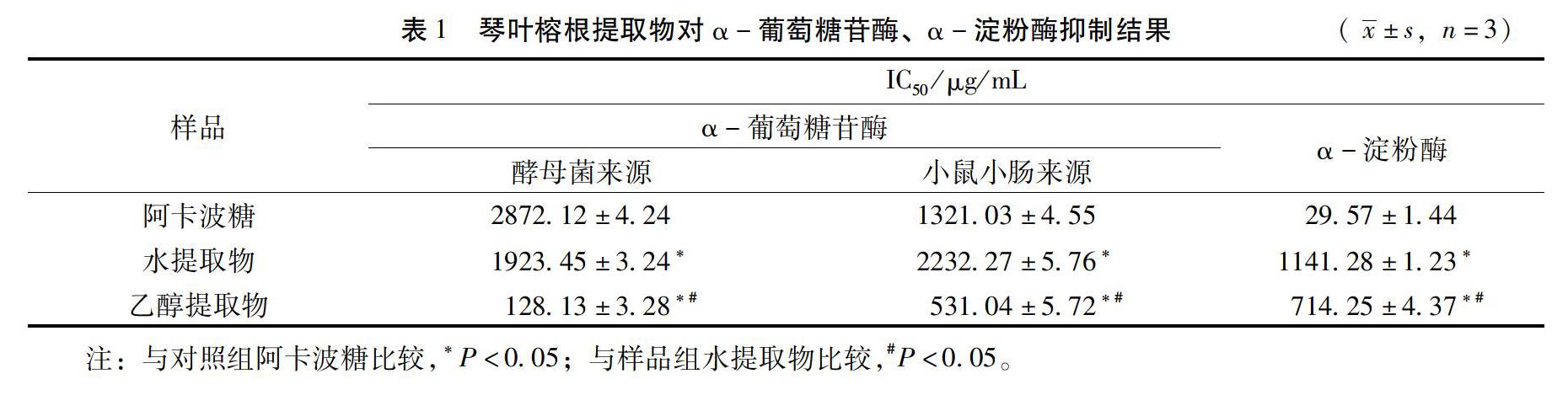
α-葡萄糖苷酶在抑制剂的作用下,随抑制剂质量浓度的增大,其催化pNPG水解生成pNP的量减少,结果见图3(以琴叶榕醇提取物对酵母来源α-葡萄糖苷酶的影响为例,其余相同)。图中pNP(tR=11.96min)峰面积由小到大对应的琴叶榕醇提取物質量浓度依次为4000.0、2000.0、1000.0、500.0、100.0、0.0μg/mL,表明随琴叶榕醇提取物质量浓度的增大,酶抑制效果越强。
琴叶榕根乙醇提取物抑制酵母来源和小鼠小肠来源 α-葡萄糖苷酶的IC50值分别为(128.13±3.28)μg/mL、(531.04±5.72)μg/mL,均显著低于水提取物(见表1),提示琴叶榕根乙醇提取物对 α-葡萄糖苷酶的抑制活性强于水提取物。
3.2 对α-淀粉酶的抑制活性 琴叶榕根乙醇提取物对α-淀粉酶的IC50值为(714.25±4.37)μg/mL,显著低于水提取物(1141.28±1.23)μg/mL(P<0.05),提示琴叶榕根乙醇提取物对α-淀粉酶的抑制活性强于水提取物(见表1)。
4 讨论与结论
琴叶榕在客家地区常作滋补汤料,配以龙骨、鸡肉煲汤,用于祛湿、降糖等。据《江西民间草药验方》、《福建中草药》等客家地区经典著作记载,牛奶树根祛风除湿、清热解毒、活血行气、舒经通络等功效明显[13]。琴叶榕药用和食用价值高,市场经济价值潜力巨大,但其现代药学研究薄弱。实验以琴叶榕根为研究对象,对其醇提取物和水提取物进行降血糖活性评价,并进行活性差异的比较研究,结果表明,琴叶榕根乙醇提取物和水提取物对两种来源α-葡萄糖苷酶、α-淀粉酶均具有显著的抑制活性,其中乙醇提取物抑制活性强于水提取物。结果提示应聚焦于琴叶榕根乙醇提取物,并对其进行系统的化学成分、药理活性研究,明确药效物质基础以及作用机制,推动琴叶榕的进一步开发利用。
参考文献
[1]杨文英.中国糖尿病的流行特点及变化趋势[J]. 中国科学:生命科学, 2018, 48(8): 812-819.
[2]李子艳, 王春丽, 高柳滨. 全球糖尿病治疗药物研发及市场态势[J]. 药学进展, 2018, 42(9): 710-717.
[3]Palanisamy S, Yien E L H, Shi L W, et al. Systematic review of efficacy and safety of newer antidiabetic drugs approved from 2013 to 2017 in controlling HbA1c in diabetes patients [J]. Pharmacy, 2018, 6(3): 57.
[4] He K, Shi J C, Mao X M. Safety and efficacy of acarbose in the treatment of diabetes in Chinesients [J]. Therapeutics and Clinical Risk Management,2014(10):505-511.
[5] 谭哲谞, 许利嘉, 陈四保. 植物来源α-葡萄糖苷酶抑制剂的研究新进展[J]. 中南药学, 2018, 16(7): 982-987.
[6] Wang X L, Jiao F R, Yu M, et al. Constituents with potent α-glucosidase inhibitory attractive from Pueraria lobata (Willd.) ohwi [J]. Bioorganic & Medicinal Chemistry Letters, 2017, 27(9): 1993-1998.
[7] 张秀实, 吴征镒. 中国植物志(第23卷)[M].北京: 科学出版社, 2004.
[8] 彭伟文, 欧阳小健, 戴卫波, 等. 琴叶榕的生药学研究[J]. 中药材, 2018(11): 2291-2294.
[9] 李俊芳, 林浩, 林大都. 琴叶榕根的化学成分初步研究[J]. 广东化工, 2018, 45(15): 51-53.
[10]張丙云, 苏丹, 郭涛, 等. 竹叶椒乙醇提取物对α-葡萄糖苷酶的抑制作用及其机理研究[J]. 食品工业科技, 2015, 36(21): 345-348.
[11] 张声源, 庄远杯, 林大都, 等. 蒲桃枝叶抑制α-葡萄糖苷酶活性部位及其化学成分研究[J]. 天然产物研究与开发, 2018, 30(11): 1950-1956.
[12] 邵元元. 五倍子没食子酸高效制备及其对α-淀粉酶的抑制作用[D]. 长沙:湖南农业大学, 2014.
[13] 彭伟文, 欧阳小健, 戴卫波, 等. 琴叶榕的生药学研究[J]. 中药材, 41(11): 2291-2294.
(收稿日期:2019-04-24 编辑:程鹏飞)
