血清炎性因子及耳蜗组织神经营养因子对老年性耳聋大鼠的影响
2019-10-23翟建光周姗姗
翟建光, 周姗姗
1河南科技大学第二附属医院耳鼻喉头颈外科(河南洛阳 471000); 2新安县人民医院五官科(河南洛阳 471800)
老年性耳聋指随着年龄的增长,听觉器官衰老,发生退变,导致双耳发生神经性听力减退,主要的临床特点是损失高频听力。目前老年性耳聋的分子机制是研究的重点。白细胞介素(interleukin,IL)可以作用于多种细胞,IL-1β、IL-6具有免疫调节作用,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)通过刺激人血管内皮细胞产生凝血活性,影响听力[1]。神经生长因子(nerve growth factor,NGF)对正常神经细胞起营养因子的作用,可以修复和保护损伤的神经细胞, 神经营养因子-3(neurotrophin-3,NT-3)能够支持听觉神经元的存活[2]。钙蛋白酶(Calpain)被激活预示着细胞凋亡和发生变形坏死,与神经退行性病变有紧密的联系[3]。2017年5月至2018年2月,本研究通过对老年性耳聋大鼠血清炎性因子及耳蜗组织神经营养因子的检测,探究其对老年性耳聋大鼠的影响,具体情况如下。
1 材料与方法
1.1 动物 选取150只Wistar大鼠,由佳木斯大学动物研究中心提供,雌雄不限,年龄26~36个月,平均(30.2±2.1)个月,体重200~250 g,平均(223.5±8.1)g。所有大鼠均在干净笼子里养殖,室内温度在(21.5±1.8)℃,相对湿度32%~38%,每天12 h光照,喂饮纯净水。本次研究所做实验均获得我院伦理委员会批准。
1.2 方法
1.2.1 造模及分组 在150只Wistar大鼠中随机选取80只大鼠颈部皮下注射500 mg的5% D-半乳糖,1次/d,持续进行7个周后,采用ABR法检测大鼠听力反应阀值,给予80只大鼠400 mg的10%水合氯醛腹腔注射,用TDT系统测定大鼠麻醉状态下的听力反应阀值,把标准短声作为刺激声,将TDT系统的给声频率调至12.0 Hz,脉冲宽度调至0.1 ms,扫描时程10 ms,重复扫描520次,带通滤波为200~2 500 Hz,监测最稳定的Ⅲ波出现,将Ⅲ波消失时的声压级作为听力反应阀值,以听力反应阀值30位分界线,听力反应阀值高于30的划分为老年耳聋组。对剩余70只大鼠同样采用ABR法检测大鼠听力反应阀值,听力反应阀值低于30的划分为老年正常组。其中老年耳聋组72只,老年正常组48只。
1.2.2 标本采集 将两组大鼠使用3 mL/kg的氯胺酮进行腹腔注射麻醉,固定好后,使用手术刀开胸,并往心脏内灌注4℃的生理盐水,直至溢出液体澄清后停止。将大鼠耳蜗及前庭组织用手术刀切除后,保存至液氮中10 min后,用匀浆器以30 s低速匀浆3 min,冰浴1 min,过程重复至组织完全裂解,然后经过冷凝处理后,用离心机以2 000 r/min的转速分离20 min,取上清液冷冻保存至-70℃的冰箱中。
1.2.3 ELISA法检测血清炎性因子的表达 采用酶联免疫吸附法,严格按照ELISA试剂盒说明书进行操作,在ELISA试剂盒中加入待测样本,使血清和固相抗原充分结合,洗涤去除杂质后加入微孔板酶标仪中,经过酶标抗体反应形成复合物后再加入底物显色,通过比色检测血清中TNF-α、IL-1β、IL-6、血管细胞黏附因子1(vascular cell adhesion molecule-1,sVCAM-1)、血管内皮细胞钙黏蛋白(vascular endothelial cadherin,VE-cadherin)、高迁移率蛋白-1(mobility group protein box 1,HMGB1)的量,进行接下来的指标水平比较。
1.2.4 Western blot法检测NGF、NT-3表达水平 将冻存标本通过细胞浆蛋白抽提试剂盒将其中总蛋白提取。使用SDS-PAGE凝胶来进行电泳,加入浓缩的SDS-PAGE蛋白缓冲液,静置20 min;在100 V的环境中电泳10 min后,把电转膜放置摇床上,封闭在37℃环境中,然后添加10%的牛奶后静置2 h;在一抗中加入TBST稀释,按照1∶ 1 000的比例稀释后加入待测样本,经过孵育后保存至4℃的环境内;第2天用TBST缓冲液清洗,在常温的环境中加入二抗,孵育1 h。再次用TBST缓冲液清洗,最后加入底物溶液进行显色,采用BCA蛋白定量试剂盒,分析灰度值,目的蛋白相对表达量=目的蛋白条带灰度值/内参条带灰度值,达到检测NGF、NT-3表达水平的目的。
1.2.5 化学发光分析法检测钙蛋白酶表达 采用化学发光分析法,将化学发光物质加入至待测标本,按顺序依次与催化剂及氧化剂反应,最终会形成处于激发状态的中间体,当中间体稳定的时候,其会发射出光子,严格按照化学发光分析仪操作步骤,利用发光信号测量仪测量光子数值,检测钙蛋白酶的水平。
1.2.6 RT-PCR法检测钙蛋白酶mRNA的表达 采用荧光定量RT-PCR法,严格按照定量PCR仪的使用说明书进行操作。首先加入2.5 μL的稀释10倍的PCR缓冲液,1.5 μL MgCl2溶液以及0.5 μL上游引物和下游引物,最后通过加水,配置成总体积为25 μL的反应体系。将其放置在94℃环境中1 min,55℃环境中1 min;72℃环境中1 min,为一个循环,重复进行40个循环,在72℃环境中反应延长3 min,最少延长3次。采用2-ΔΔCt方法计算出要检测钙蛋白酶mRNA的表达水平。
1.2.7 大鼠耳蜗基底膜形态观察 对两组大鼠进行全麻处理,采用断头法处死,将大鼠两侧听泡取出,并使用蒸馏水进行冲洗、待用。使用眼科剪将所取大鼠听泡打开,使耳蜗暴露出来,用细针头在蜗尖处做一小口,并使用2 mL 0.5%硝酸银溶液灌注,在使用蒸馏水进行灌注冲洗2次。使用10%中性甲醛固定液自所做小孔处灌注耳蜗,灌注3次之后将其放置于固定液中,并于4℃冰箱内4 h进行固定还原。使用10 W白炽灯在距离10 cm处进行照射,耳蜗组织变为棕褐色即为曝光染色成功。将曝光染色成功的耳蜗蜗轴固定,在解剖显微镜下放大并将基底膜剥离,将剥离后的基底膜平整放置在载玻片上,盖片封固,置于高倍显微镜下观察、摄片。
1.3 统计学方法 采用SPSS 19.0统计软件,计量资料采用均数±标准差描述,两组间比较采用配对t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组大鼠耳蜗基底膜形态学 老年正常组大鼠耳蜗细胞清晰可见、大小均匀且排列紧密,界限较为清晰,且基本无细胞缺失现象;老年耳聋组模型大鼠相比老年正常组大鼠,细胞不清晰且大小不一,排列较为杂乱,存在明显的细胞缺失或脱落现象。见图1。
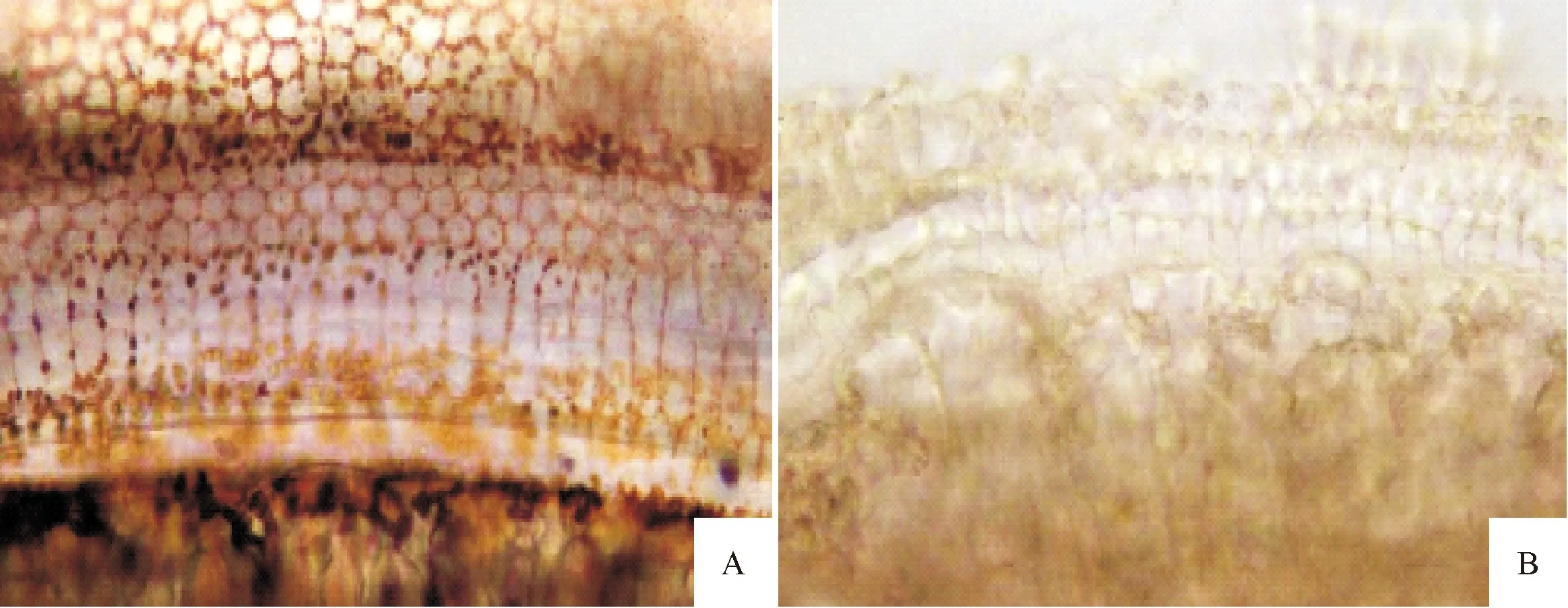
A:老年正常组;B:老年耳聋组
2.2 两组耳蜗TNF-α、IL-1β、IL-6表达水平 老年耳聋组耳蜗TNF-α、IL-1β及IL-6表达水平明显高于老年正常组,差异有统计学意义(P<0.05)。见表1。

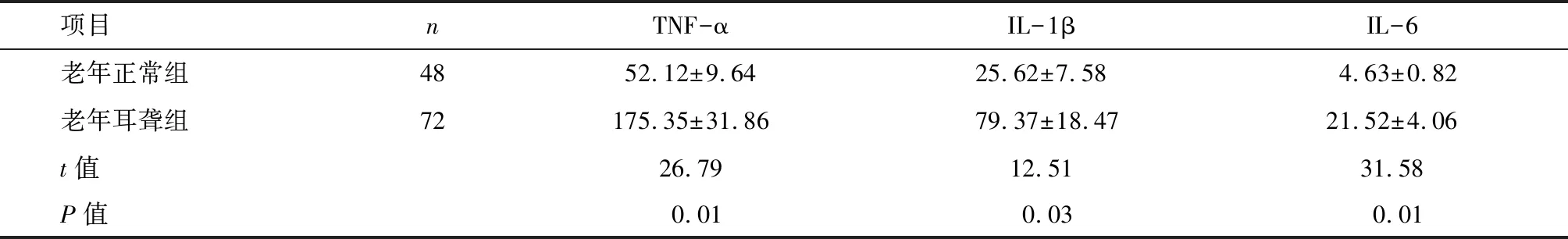
项目nTNF-αIL-1βIL-6老年正常组4852.12±9.6425.62±7.584.63±0.82老年耳聋组72175.35±31.8679.37±18.4721.52±4.06t值26.7912.5131.58P值0.010.030.01
2.3 两组耳蜗sVCAM-1、VE-cadherin、HMGB1表达水平 老年耳聋组耳蜗sVCAM-1、VE-cadherin及HMGB1表达水平明显低于老年正常组,差异有统计学意义(P<0.05)。见表2。
2.4 两组耳蜗NGF、NT-3蛋白表达水平 老年耳聋组耳蜗NGF、NT-3蛋白含量明显低于老年正常组,差异有统计学意义(P<0.05)。见表3。
2.5 两组耳蜗钙蛋白酶及钙蛋白酶mRNA表达水平 老年耳聋组耳蜗钙蛋白酶、钙蛋白酶mRNA表达水平显著高于老年正常组(P<0.05)。见表4。
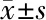

项目nsVCAM-1(ng/mL)VE-cadherin(mg/L)HMGB1(mg/L)老年正常组48293.36±27.525.64±0.613.95±0.47老年耳聋组72201.83±21.072.82±0.331.92±0.21t值20.4531.4927.38P值0.020.010.01
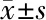

项目nNGFNT-3老年正常组482.52±1.020.85±0.21老年耳聋组721.24±0.490.53±0.14t值8.798.96P值0.040.04
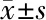
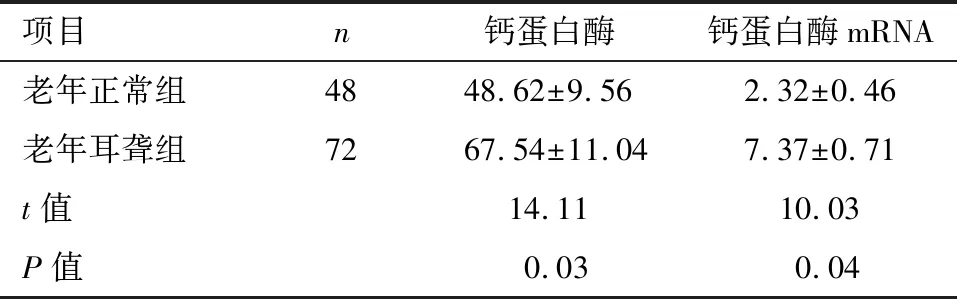
项目n钙蛋白酶钙蛋白酶mRNA老年正常组4848.62±9.562.32±0.46老年耳聋组7267.54±11.047.37±0.71t值14.1110.03P值0.030.04
3 讨论
目前医学界将老年开始出现的,双耳对称的,逐渐递进的神经性耳聋称为老年性耳聋。老年性耳聋是指随着年龄的增长,老年人听觉器官慢慢老化,耳蜗组织内各项指标渐渐出现异常表达,会逐渐出现听力减弱,严重者甚至听力丧失的一种老年性疾病,一般60岁以上的老年人60%以上都会出现不同程度的听力减弱,一般多表现为双侧感音神经性耳聋,以高频听力减弱为主,言语分辨率降低,出现重振、耳鸣等现象[4-5]。现今随着人口老龄化的日趋严重,老年性耳聋患者数量也日趋升高,迄今为止尚没有确切的方法治疗老年性耳聋,但良好的生活习惯可以预防老年性耳聋的发生[6]。
TNF-α是目前医学界发现的活性最强的抗肿瘤细胞因子,所以少量的TNF-α是有杀灭癌细胞的作用。TNF-α可以作用于多种细胞,可以诱导IL-1β、IL-6、IL-8在人体内的分泌,从而导致白细胞、毛细血管组织的损坏,最终对全身器官及组织造成损害[7]。IL-1β由单核细胞、成纤维细胞及内皮细胞等多种细胞分泌,在人体中分布广泛,可以同免疫球蛋白超家族的受体结合,促使集落刺激因子、血小板生长因子的产生,并诱导T细胞分泌IL-2,在人体免疫应答以及组织修复过程中起着重要作用[8]。IL-6由单核细胞、巨噬细胞、血管内皮细胞等多种瘤细胞分泌产生,可以促进免疫细胞的分化增殖,并提高其功能,是参与重要炎症反应的重要介质之一。IL-6可以有效上调细胞G蛋白活性及中性粒细胞功能,并促使细胞凋亡。TNF-α、IL-1β、IL-6同属于炎性因子[9]。本研究发现,老年耳聋组耳蜗TNF-α、IL-1β、IL-6表达水平均明显高于老年正常组,差异有统计学意义(P<0.05),说明TNF-α、IL-1β、IL-6可能与老年性耳聋有密切关系。sVCAM-1属于IgSF成员,在血管内皮细胞中有较高表达,和VLA-4作用后可以穿透血管壁到达炎症部位,还可以与T-B细胞发生反应。VE-cadherin可以维持血管内皮细胞功能的完整性,VE-cadherin可以通过连环蛋白,达到保持细胞连续性的目的[10-11]。HMGB1在哺乳动物细胞中广泛存在,属于高度保守的核蛋白,有良好的促炎作用,成为了目前医学界近年来研究的热点之一。本研究发现,老年耳聋组耳蜗sVCAM-1、VE-cadherin、HMGB1表达水平均明显低于老年正常组(P<0.05),说明sVCAM-1、VE-cadherin、HMGB1可能与老年性耳聋有密切关系,或许会成为治疗老年性耳聋的新靶点。NGF可以促进中枢神经元的生长、发育,维持神经系统功能的正常运行,可以修复神经功能的损伤[12]。NT-3是人体中最为重要的生长因子,可以刺激及控制神经,保护耳蜗神经元,目前神经营养因子-3多被用于构建组织神经支架[13]。本研究发现,老年耳聋组NGF、NT-3蛋白含量显著低于老年正常组(P<0.05),说明耳蜗NGF蛋白及NT-3蛋白含量在老年性耳聋中存在异常表达,对诊断治疗老年性耳聋中有重要应用价值。杜政德等[14]研究表明,老年性耳聋大鼠中NGF及NT均有异常表达,与本研究结果一致,但在其研究中,老年性耳聋大鼠NGF表达量高于本研究,可能是与所选大鼠品种不一样有关,本研究选取的均为实验用Wistar大鼠,研究结果可能会更加确切。钙蛋白酶属于降解蛋白酶的一种,钙蛋白酶的活性受到蛋白酶激活蛋白和蛋白酶抑制蛋白的调节,可以在骨骼肌的生长过程中有重要作用,可以促使肌肉嫩化,同时钙蛋白酶在老年耳蜗组织功能衰退及听力减弱的过程中同样发挥着重要的作用[15]。本研究中老年耳聋组耳蜗钙蛋白酶及耳蜗钙蛋白酶mRNA表达水平均明显高于老年正常组,差异有统计学意义(P<0.05),说明钙蛋白酶与老年性耳聋关系密切,其在耳蜗中高表达,会促使老年性耳聋的发生。
综上所述,老年大鼠耳蜗组织中TNF-α、IL-1β、IL-6、sVCAM-1、VE-cadherin、HMGB1、NGF蛋白、NT-3蛋白、钙蛋白酶及钙蛋白酶mRNA均与大鼠老年性耳聋有密切关联,其在老年大鼠耳蜗中的异常表达,对老年性大鼠耳聋的诊断、治疗及预后有重要意义。
