植物生长调节剂和基质种类对杉木无性系瓶外生根组培苗质量的影响
2019-10-23韦如萍胡德活郑会全王润辉
韦如萍 胡德活 晏 姝 郑会全 王润辉 曾 宏
( 广东省森林培育与保护利用重点实验室/广东省林业科学研究院,广东 广州 510520)
杉木(Cunninghamia lanceolata)是我国特有的传统优势造林树种,也是南方商品林基地建设的当家树种,在我国木材工业、木材战略储备以及生态建设中具有举足轻重的重要地位[1]。生产实践中,杉木无性繁育的方式主要包括扦插或组织培养。由于扦插育苗过程中尚存在土地资源消耗大、繁殖系数低、生产季节受限制等问题,使得具有高度集约化特性的组织培养技术在杉木无性繁育过程中得到快速发展[2-5]。组培苗的生根率和移栽成活率是实现工厂化育苗的关键影响因子[6]。目前,杉木组培苗生根方式多以瓶内生根为主,芽苗在生根期间需要在培养室内人工控制的环境下生长,容易导致苗木根系含水量过高、芽苗木质化程度低、整体十分娇弱,不利于苗木的移栽成活。同时,瓶内生根方式还具有育苗工序复杂、育苗周期长以及育苗成本高等问题[2-3]。因此,如何经济有效地提高组培苗生根率、移栽成活率以及苗木品质已成为亟待解决的关键问题。组培苗瓶外生根是近些年得到成功应用的苗木繁育新技术[4-9]。它是组培苗瓶内快速增殖技术与瓶外扦插技术的有机结合,也是组培苗生根和驯化过程的有效重叠,可以达到提高生产效率、降低生产成本和缩短育苗周期的多重目标[4-10]。近些年,组培苗瓶外生根技术已在多种花卉、农作物、造林树种中得到应用[4-9,11-15]。但在杉木组培苗瓶外生根方面,仅见何振革等[4]报道了以杉木种子园混系材料培养的组培无根继代苗移栽技术,以及高小坤[5]以杉木优良品种为材料经生根培养基诱导后进行的瓶外移栽,并侧重于生根促进剂和基质种类的筛选。而以杉木无性系为材料,分析植物生长调节剂和基质类型对瓶外生根组培苗综合质量的影响研究较少。为此,本研究以广东省林业科学研究院选育和繁育的杉木优良无性系组培继代无根芽苗为材料,从生根情况、根系形态、生物量累积等角度出发,探讨植物生长调节剂和基质种类及其处理方式对瓶外生根组培苗综合质量的影响,以期为实现低成本高品质的杉木无性系工厂化育苗技术提供理论依据。
1 材料与方法
1.1 试验材料
试验地位于广东省林业科学研究院(113°22′E,23°11′N)。属于亚热带季风气候,年平均气温20.4~21.9 ℃,年平均日照时数为1 820~1 960 h,年平均降雨量约1 800 mm,平均相对湿度77%。以广东省林业科学研究院选育的杉木“TL5”号无性系为材料,利用“TL5”号无性系植株基部萌芽为组织培养外植体获得无菌组培苗。选择继代培养30 d的无根芽苗在塑料大棚内进行封盖炼苗,光源为自然散射光,温度为25~30 ℃。封盖炼苗15 d后,打开瓶盖炼苗,开盖后及时注入清水,水面高出培养基表面1 cm左右。开盖炼苗1 d后,选择长度超过3 cm、生长健壮、叶色浓绿的芽苗作为瓶外生根的材料。
1.2 试验方法
1.2.1 植物生长调节剂筛选试验
试验在塑料大棚中进行。采用正交设计L9(34)试验(表1),试验因子包括植物生长调节剂种类(A),即IBA、NAA、ABT1#,植物生长调节剂浓度(B),即100、200、400 mg/L和浸泡时间(C),即0.5、1.0、1.5 h,不考虑因素间的交互作用。2017年10月初,以经过炼苗处理的继代无根芽苗为材料进行瓶外移栽。移栽前,根据试验设置用不同植物生长调节剂组合对芽苗基部进行浸泡处理,然后移栽入带有盖子的育苗盒中。育苗盒长×宽×高为187 mm×145 mm×110 mm,育苗穴深5.5 cm,每盒12穴。育苗基质由40%泥炭土、20%珍珠岩和40%蛭石组成;移栽前一天,用0.2%高锰酸钾溶液淋透育苗基质进行灭菌消毒。每穴种植1株苗木,每个处理设置3个重复,每个重复3个育苗盒,即36株苗。
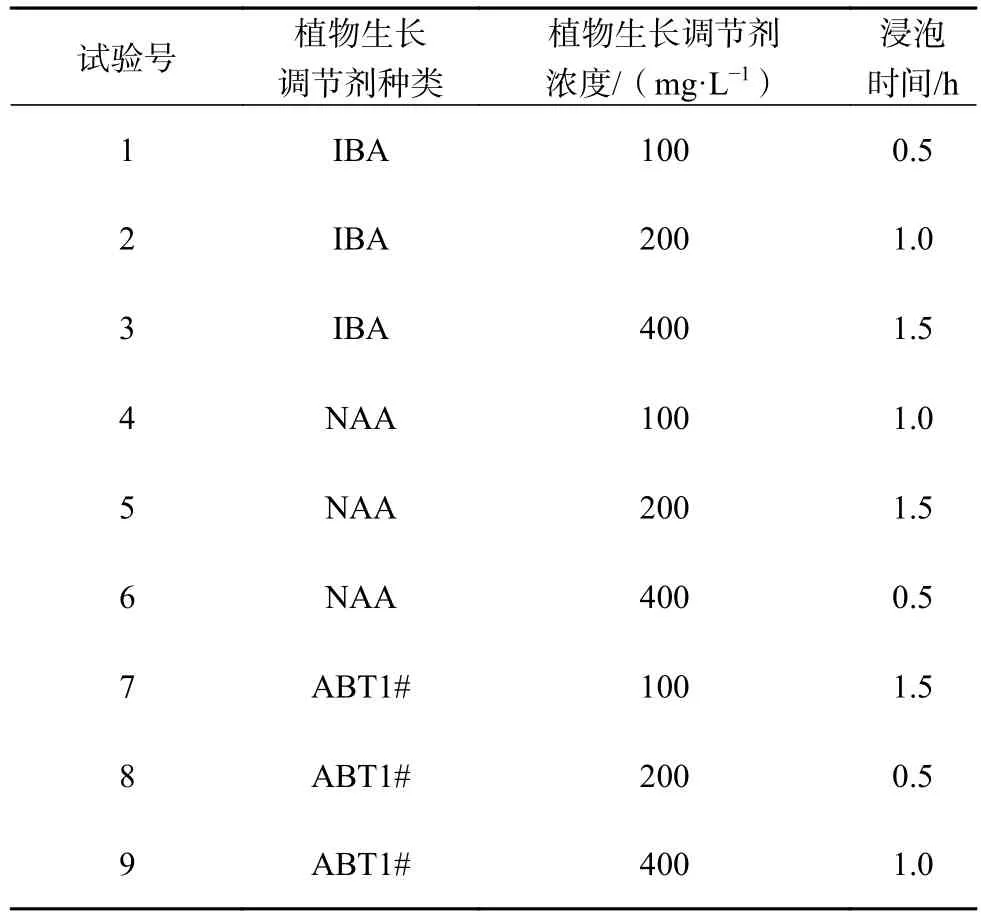
表1 L9(34)正交试验设计方案Table 1 Test schedule for orthogonal design of L9(34)
1.2.2 基质筛选试验
采用大田育苗方式。育苗基质包括泥炭土、珍珠岩、红心土、蛭石,采用单形重心混料实验设计{4,3},对4种育苗基质进行不同比例配比组合(表2),以红心土为对照基质(ck)。芽苗移栽前2 d,用0.2%高锰酸钾溶液淋透育苗基质进行灭菌消毒,覆盖薄膜备用。育苗袋长×宽为13 cm×9 cm。2017年12月初,选择已经过炼苗的继代无根芽苗,用清水洗净基部残留的培养基后再用100 mg/L IBA溶液浸泡芽苗基部1 h,然后扦插到试验设置的不同基质中(表2)。试验采用随机区组设计,每个处理3次重复,每个重复30株芽苗。芽苗移栽后即刻淋透水,并搭建小拱棚,覆盖薄膜。移栽后2周内,控制苗床湿度在80%~90%,温度25~30 ℃。移栽2周后,控制苗床湿度在70%左右。移栽1个月后,如果气温维持在20 ℃以下时,则继续加盖塑料薄膜,否则除去塑料薄膜。移栽1个半月后,用MS大量元素20倍液进行叶面喷施,此后隔1个月喷施1次,连续喷施3次。此后的管护措施参照常规育苗方法进行,各处理间保持一致。
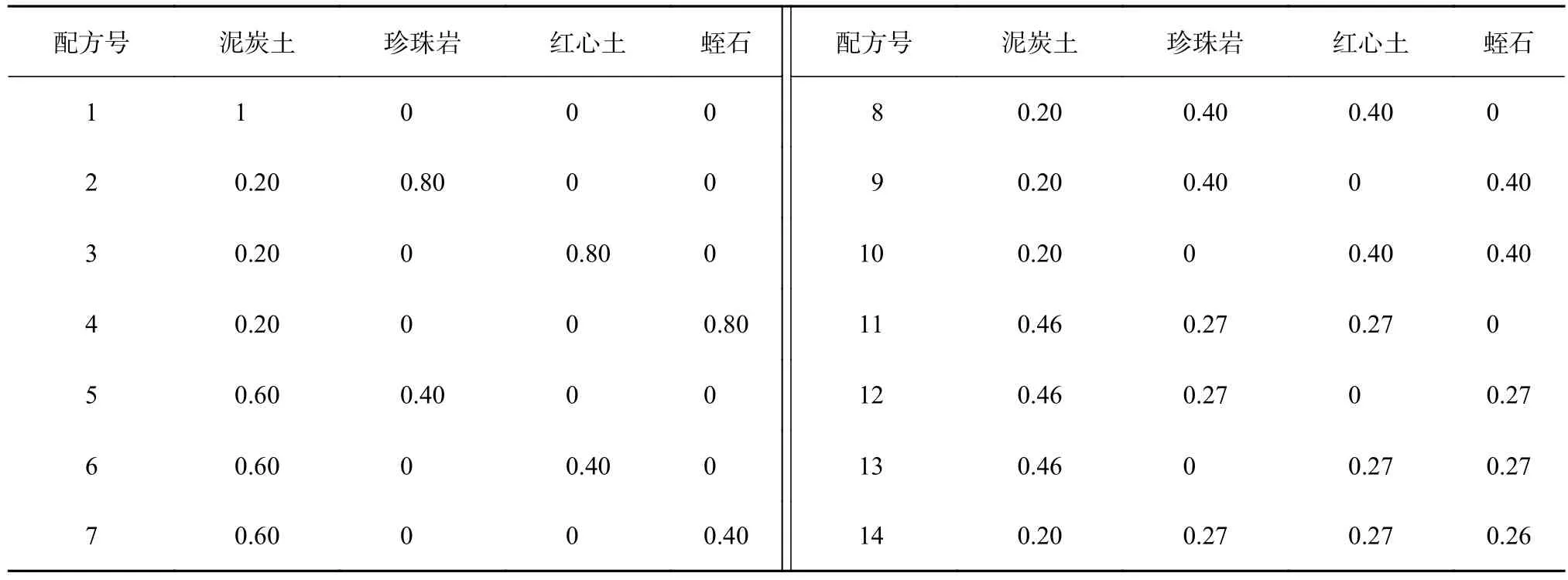
表2 不同育苗基质的成分及体积比Table 2 Types and volume ratio of media
1.3 数据采集
在芽苗移栽2个月后,调查苗木生根率,存活的苗木即统计为已生根的苗木。此外,对于植物生长调节剂筛选试验,还从各处理中随机选取3株苗木统计根数量。对于基质筛选试验,则在移栽6个月和12个月时,分别从各处理中随机选取3株苗木进行生长测定,指标包括苗高、地径、干物质质量以及根系形态。测定根系形态参数时,需要截取苗木的完整根系,清洗干净后利用Expression 11000XL(EPSON)进行根系扫描,再运用万深LA-S植物根系分析系统获取根体积、根表面积、根长、根直径等参数。测定苗木干物质质量时,新鲜样品需经105 ℃杀青30 min,然后再经70 ℃烘干至恒质量后称量。
1.4 数据分析
试验数据使用Excel 2010和SAS V8软件进行统计分析。多重比较采用Duncan法,苗木生根率经反正弦转换后再进行分析。苗木质量综合评价采用隶属函数法,计算公式如下[16]:
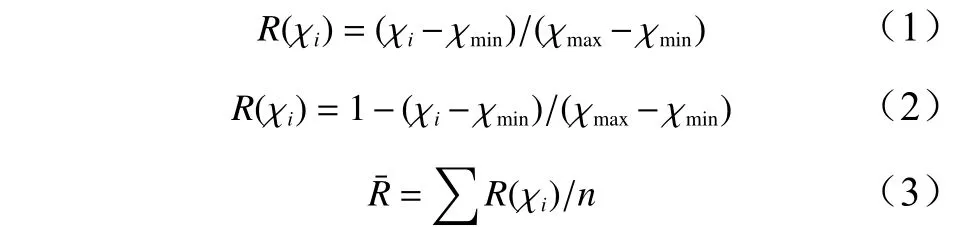
式中:χi为苗木某个性状指标测定值,χmax与χmin分别为该性状指标的最大值与最小值,当该性状与苗木质量呈正相关时使用隶属函数公式(1),当该性状与苗木质量呈负相关时使用反隶属函数公式(2);为苗木n个性状隶属函数值的平均值。
2 结果与分析
2.1 不同植物生长调节剂对组培芽苗瓶外生根的影响
由正交试验极差分析结果可知(表3),各因素对生根率和根数量的影响主次顺序为植物生长调节剂浓度(B)>植物生长调节剂种类(A)>浸泡时间(C),表明植物生长调节剂浓度是对生根率和根数量影响最大的因素,其次是植物生长调节剂种类,浸泡时间的影响相对较小。各因素不同水平的平均值比较结果显示,用100 mg/L IBA溶液浸泡芽苗基部1 h的处理方式将能获得最优的生根率和根数量。对正交试验筛选出的因素优组合进行验证试验,即用100 mg/L IBA溶液浸泡1 h的方式处理杉木无性系组培继代芽苗然后进行瓶外生根,结果表明,平均生根率为89.56%,每株苗木的平均根数量为4.26条,说明试验结果可靠。

表3 植物生长调节剂对杉木无性系组培芽苗瓶外生根的影响Table 3 Effect of exogenous hormone on rooting of ex vitro subculture plantlet buds of C. lanceolate clones
2.2 不同基质对组培芽苗瓶外生根率和苗木生长的影响
由图1a可知,移栽2个月后,不同基质配方中,移栽生根率存在显著差异,其中12号配方的移栽生根率最高,为89.82%,比对照提高71.64%;其次是7、13、14号配方,苗木生根率为66.03%~79.91%,而2、3、6、8、11号配方生根率较低,仅为23.48%~39.21%,明显低于对照。苗高、地径和干物质质量3个生长指标在不同配方间存在差异,但在不同的移栽时间里,这种差异有所不同。在移栽6个月后,以5、10、11、12、13号配方苗木总体生长较好,苗高为12.93~14.57 cm。移栽12个月后,则以14号配方苗木总体表现最好,1、7号配方次之,3个配方的苗高分别为29.77、20.97、23.80 cm,分别比对照提高 81.19%、27.63%、44.86%;而 2、3、8号配方苗高生长较差,其余配方与对照差异不显著。
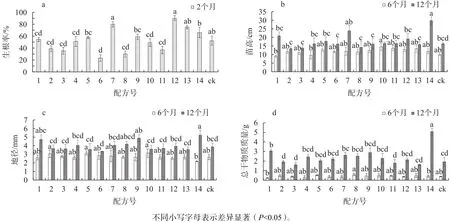
图1 不同基质配方对瓶外生根率及苗木生长的影响Fig. 1 Effect of media type on ex vitro rooting rate and growth of subculture plantlet
2.3 不同基质对瓶外生根组培苗根系形态的影响
苗木根系形态参数在不同基质配方中存在较大差异,而且在不同移栽时间里,根系形态的变化模式不同(图2)。在移栽6个月时,苗木根系形态参数只在少数配方间存在显著差异,其中2号和5号配方的苗木根系总体表现较好;移栽12个月后,根系形态参数在多数配方间差异明显,总体上以1、4、7、12、14号配方中苗木根系生长较好。又以7号和14号配方最好,其总根长分别比对照提高29.41%、28.31%,总根表面积分别提高11.37%、29.16%,总根体积分别提高44.97%、97.17%;根系总体生长较差的配方为2、3、6、8号,4个根系形态参数均明显低于对照,其余配方与对照差异不明显。
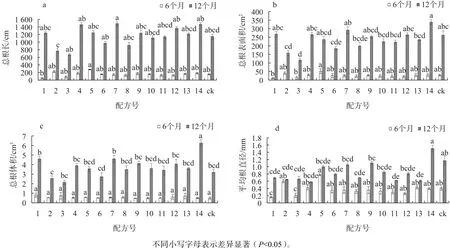
图1 不同基质配方对瓶外生根组培苗根系形态的影响Fig. 2 Effect of media type on root morphological parameters of ex vitro rooting subculture plantlet
2.4 瓶外生根组培苗质量综合评价
利用不同基质中杉木无性系瓶外生根组培苗的生长性状、根系形态参数等8个性状指标的标准化数据做主成分分析(表6)。前3个主成分累积贡献率为91.38%,已能够反映所有指标的绝大多数信息。第1主成分的贡献率较大(70.91%),对应较大特征向量的评价指标为总根长、总根表面积、总根体积、苗高、地径和总干物质质量,可统称为苗木生长因子;第2主成分对应较大特征向量的评价指标为生根率,可称为苗木存活因子;第3主成分对应较大特征向量的评价指标为平均根直径,可称为根系形态因子。由此可知,总根长、总根表面积、总根体积以及平均根直径等根系形态参数是评价杉木无性系瓶外生根组培苗质量的重要形态指标,同时苗高、地径、干物质累积量以及苗木生根率等也是不容忽视的质量指标。
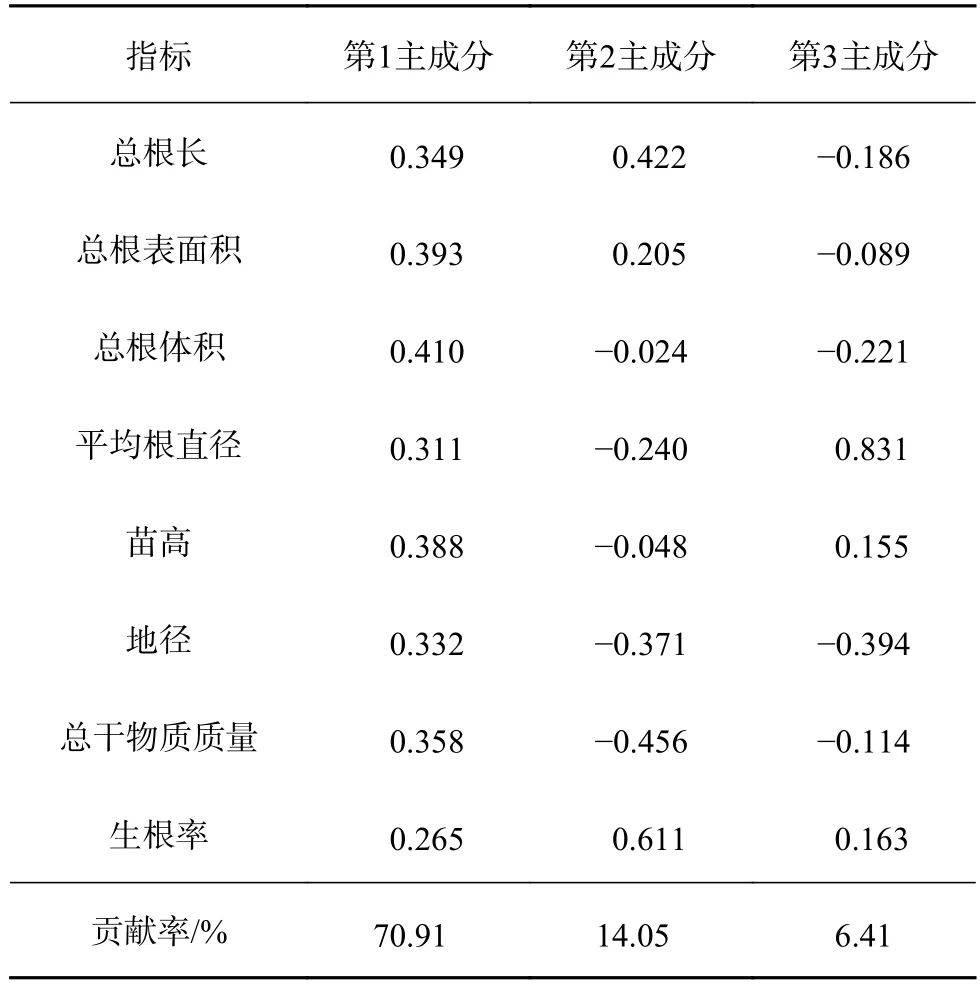
表6 主成分载荷矩阵Table 6 Principal component loading matrix
依据主成分分析结果可知,8个苗木性状指标均与杉木无性系瓶外生根组培苗的质量有密切关系。因此,取所有性状指标隶属函数值R(χi)的平均值()作为不同基质配方苗木综合质量的评价指标,平均值越大,表示苗木综合质量越好(表7)。由表7可知,有10个配方的值优于对照,排前5名的依次是14、7、1、12、4号配方,这些配方中均含有泥炭土、蛭石,同时均不添加或少量添加珍珠岩和红心土,苗木综合质量较好。值较低的配方为3、2、6、8号,这些配方中均没有添加蛭石,而且配方中珍珠岩或红心土的添加量较大,体积占比为0.40~0.80,苗木综合质量相对较差。进一步分析发现,红心土和珍珠岩体积占比均为0.27的11号配方,以及珍珠岩或红心土体积占比为0.40的5号和10号配方,其值也较低。
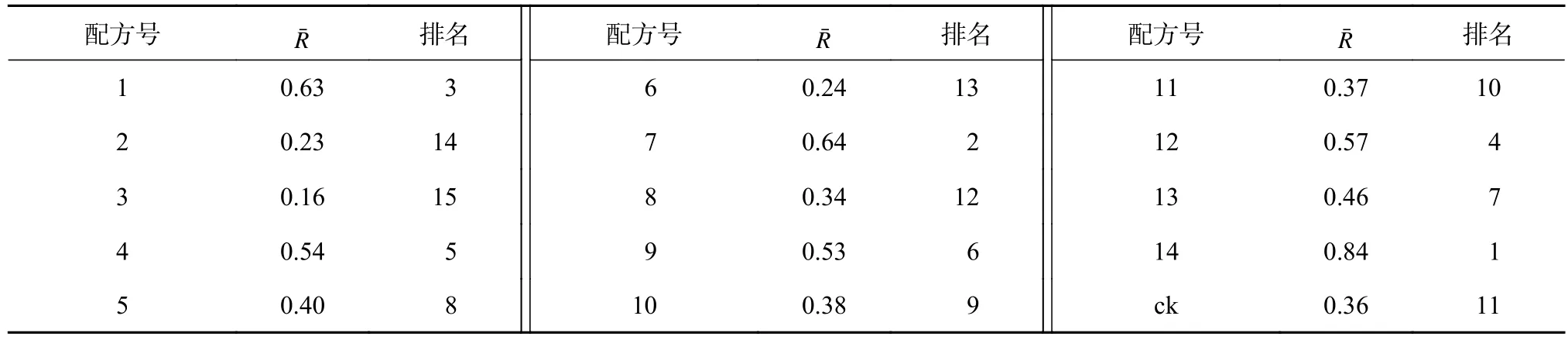
表7 瓶外生根组培苗性状指标隶属函数值Table 7 Membership function values of traits indexes of ex vitro rooting subculture plantlet
3 结论与讨论
培养基中细胞分裂素和生长素的比例对植物材料的器官再生途径起着关键的调控作用[13]。适宜浓度的生长素可以诱导芽的萌发和不定根的形成[12-14]。对不同植物的生根机理研究表明,在不定根发生过程中,有许多参与生长素合成、运输、信号传导等过程的基因表达量明显增强,暗示它们可能参与调控了不定根的发生[13]。植物生长调节剂NAA、IBA以及ABT生根促进剂都属于生长素类似物。对多个树种的研究表明,植物生长调节剂处理对组培材料瓶外生根过程中不定根的发生起到明显促进作用,但不同树种或同一树种的不同品系对不同植物生长调节剂的敏感性存在差异。对黑木相思(Acacia melanoxylon)组培继代芽苗瓶外生根研究表明,以50 mg/L ABT溶液浸泡25 min的处理方式生根效果最好[14]。澳洲茶树(Melaleuca alternifolia)组培继代芽则以0.4 mg/L ABT溶液浸泡30~50 min后再蘸取相同浓度ABT溶液与滑石粉的混合匀浆后移栽生根率最高[6]。马大杂种相思(Acacia mangium×A. auriculiformis)组培继代芽用100 mg/L IBA溶液浸泡1 h后移栽生根率为94.67%[12]。而“欧美杨107”(Populus×euramericanacv. Neva) 用 100 mg/L IBA溶液蘸取后扦插可获得81.67%的瓶外生根率[15]。本研究表明,杉木“TL5”号无性系组培继代芽在100 mg/L IBA溶液中浸泡1 h后移栽可获得最佳的瓶外生根率和根数量,但这与何振革等[4]采用种子园混系材料以及高小坤[5]采用杉木优良品种培育的组培继代芽苗瓶外生根结果存在差异,这可能与试验材料和试验方法不同有关。
育苗基质为植物根原基的萌动和根系的生长发育提供了必要环境。基质的成分和配比方式不同,其养分含量、物理和化学性质存在较大差异,对组培继代芽苗瓶外生根率、根系和苗木质量有较大影响[17-20]。优良的移栽基质具有良好的透气性、保湿性、营养性、酸碱性、易得性以及经济性等特点[7-8],能够满足芽苗基部切口进行呼吸作用时对氧气、水分及养分的需求[21],并能显著促进移栽芽苗的生长和根系形态的建成[3-10]。但不同植物种类对移栽基质的适应性不同。陈海霞等[8]研究指出,八仙花(Hydrangea macrophylla)组培无根芽苗在珍珠岩基质中生根差,但在混合基质(珍珠岩∶蛭石∶草炭土体积比为1∶1∶2)中根系和地上部分生长良好。肖玉菲等[6]对澳洲茶树(Melaleuca alternifolia)组培无根芽苗的移栽结果则显示,芽苗在红心土中生根效果最好,在河沙和轻基质中生根效果较差。本研究显示,杉木无性系组培继代芽苗瓶外生根时,以含有泥炭土、蛭石以及不含或含少量(体积占比为0.27)珍珠岩和红心土的14、7、1、12、4号配方苗木综合质量较好,其中7号配方的生根率和苗木质量均较好,可作为瓶外生根的重点参考基质。而没有添加蛭石,或者珍珠岩、红心土所占比例超过40%的2、3、6、8号配方以及纯红心土基质的苗木综合质量较差。表明基质中含有较多珍珠岩或红心土时不利于杉木无性系组培继代芽苗瓶外生根。这可能与珍珠岩质地轻、pH值高、养分少等特性有关[22],而红心土质地粘重、透水性差,当红心土所占比例过高时,在移栽初期高湿度环境下可能使基质通气性和透水性变差,进而影响芽苗生根和生长。此外,本研究还发现,泥炭土对杉木无性系继代芽苗瓶外生根有利,但添加的比例应适当。在苗木移栽成活率较高且苗木质量较好的7、12、13号配方中,泥炭土的体积占比为0.46~0.60,而泥炭土占比为1.0的1号配方,虽然苗木综合质量较好但移栽生根率仅为54.59%,暗示泥炭土所占比例过高时,可能导致基质中无机盐浓度过大,不利于芽苗的根萌动,但泥炭土较低的pH值加上良好的保温、保肥效果,可有效促进秋末冬初时期幼苗的生长。蛭石具有保肥、保水、透气等多重作用,对改善基质结构、缓冲pH值的快速变化等有良好促进作用[6,8,11],可与泥炭土一起作为杉木无性系组培继代芽苗瓶外生根的主要移栽基质进行合理使用。值得注意的是,本研究结果与何振革等[4]、高小坤[5]的结果有差异,这可能是试验材料、移栽季节、管护措施等不同所致。在今后的研究中将对材料类型、扦插季节、管护措施等因素进行更为深入系统的研究。
组培芽苗瓶外生根过程还受到外界环境的影响。其中温度和湿度是两个关键因素,对组培芽苗瓶外生根率和成活率影响较大[9,22]。王利民等[23]研究指出,只有在平均气温20~25 ℃,基质温度15~20 ℃条件下,火鹤(Anthurium scherzrianum)和红宝石(Philodendron enbesoeus)组培苗的根系才恢复快速生长。对草莓(Fragaria×ananassa)的研究结果也表明,光照、温度、湿度都会对组培芽苗瓶外生根产生影响,在芽苗移栽初期,相对湿度需要保持在95%以上,适宜温度为18~22 ℃,并以较强的散射光为光源才利于芽苗生根[9]。本研究小组总结多次移栽过程后发现,在11月至翌年2月期间,广州市白天气温多为15~25 ℃,天气凉爽,在此期间进行杉木无性系组培继代芽苗瓶外生根效果较好。而在其他季节,尤其是夏季高温高湿季节进行芽苗瓶外生根时,芽苗容易失水萎蔫,或者根部绵软腐烂,难以保持芽苗活力。但瓶外生根的生根率总体还是低于瓶内生根,可能是因为所处环境复杂、多个因素不易控制所致。今后还应对芽苗瓶外生根所需的最适温度、湿度、光照等环境条件进行更详尽的研究。
苗木质量是苗木自身遗传特性和对环境适应性的综合体现。在不同生长期,苗木质量评价结果可能不同。本研究表明,过早开展杉木无性系瓶外生根组培苗质量评价可能会产生偏差,而在苗木出圃时间段内开展苗木质量评价结果更可靠。组培继代芽苗的瓶外生根过程,是对芽苗生根和炼苗驯化过程的有效结合。该技术不仅节省了一次瓶内生根培养所需的无菌操作过程,还能利用瓶内培养过程中已被污染的芽苗为材料,只需经过简单的灭菌处理即可进行移栽,而且不影响芽苗生根率和后期生长。由此表明,采用杉木无性系组培继代芽苗瓶外生根育苗,可以有效简化技术流程、缩短育苗周期、缩减育苗成本,在杉木无性系产业化扩繁中有良好应用前景。
