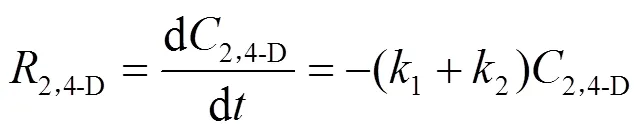Pd基双金属催化剂对2,4-D的液相催化加氢脱氯
2019-10-23罗豪鹏陈泉源
周 鑫,罗豪鹏,王 唯,陈泉源,周 娟
Pd基双金属催化剂对2,4-D的液相催化加氢脱氯
周 鑫,罗豪鹏,王 唯,陈泉源,周 娟*
(东华大学环境工程系,上海 201620)
以CeO2为载体,采用浸渍法分别合成了负载型Pd基催化剂(Pd/CeO2,Pd-Fe/CeO2,Pd-Co/CeO2和Pd-Cu/CeO2),并用于水中2,4-二氯苯氧乙酸的催化加氢脱氯.使用等离子体发射光谱仪、扫描电子显微镜和X-射线光电子能谱仪和CO化学吸附对材料进行表征.结果表明,CeO2作为载体可有效分散金属颗粒,双金属间的协同作用改善了其催化性能.其中Pd-Fe双金属催化剂具有相对优异的催化效果,随着Fe负载量的增加,Pd-Fe/CeO2的催化活性先升后降.2,4-二氯苯氧乙酸的催化脱氯以同步脱氯和逐步脱氯2种方式同时进行.
2,4-二氯苯氧乙酸;催化加氢还原;双金属;Pd-Fe/CeO2
2,4-二氯苯氧乙酸(2,4-D)是一种可有效去除阔叶杂草的除草剂,低浓度时也可以用作植物促生长剂,因其生产成本低,选择性好而在全球范围内广泛使用[1-2].由于它具有相对较高的水溶性和流动性,对地表水和地下水造成了一定污染[3].毒性研究表明,2,4-D是一种内分泌干扰物,易损害人体的肝和肾脏等器官,对哺乳动物可能存在致癌作用[4-5].因此,去除环境中残留的2,4-D已广泛引起了人们的研究兴趣,以减少其对人类健康和环境的威胁[6].
目前对于2,4-D的处理方法主要有吸附法[7],高级氧化法[8],还原脱氯法[9-10]等.液相催化加氢还原是一种能够有效去除水中氯代有机物的清洁技术.其原理为在常温常压条件下,催化剂利用氢气产生活性氢,取代氯代有机物中的氯原子,有效降低污染物的毒性[11].其反应速率与催化剂结构密切相关.贵金属Pd由于有较强的吸附解离H2的能力,常被应用于液相催化加氢反应中[12-13].二氧化铈(CeO2)作为载体可以很好地分散Pd颗粒,增加活性位点数,改善催化能力[14].其负载的Pd基催化剂可有效用于水中污染物的加氢还原.如Sun等[15]使用CeO2修饰的SBA-15为载体负载Pd,有效地提高了对溴酸盐的加氢还原效率. Saikia等[16]以水热法制备了Pd/CeO2并用于硝基芳烃的催化还原,取得了良好的效果.双金属催化剂较单金属催化剂而言,可通过金属间的协同作用,改善纳米材料的物理和化学特性,更好地应用于催化反应中[17-18]. 研究表明,在Pd基催化剂中掺杂过渡金属可增强Pd的氢化能力,有效提高对还原产物的选择性[19-20]. Zhou等[21]制备了一系列不同负载量的Pd-Au/CNTs并用于2,4-二氯酚的催化加氢,结果表明在相近的金属负载量下,双金属催化剂活性显著高于单金属催化剂.
本文合成了CeO2载体,并采用浸渍法分别合成了Pd-M/CeO2(M=Fe、Co、Cu)和Pd/CeO2等负载型催化剂,以及不同Fe负载量的催化剂Pd-Fe/CeO2,并用于水中2,4-二氯苯氧乙酸的催化加氢脱氯.通过在贵金属催化剂中掺杂过渡金属,提高了催化剂对污染物的处理效率,同时降低了催化剂成本,以期为实际工业应用提供科学依据.
1 材料和方法
1.1 催化剂制备与表征
沉淀法制备CeO2:取Ce(NO3)3·6H2O配成0.5mol/L的溶液,边搅拌边使用浓度为2mol/L的氨水调节pH值至10.0,继续搅拌30min后,用去离子水洗至中性,80℃烘干,450℃焙烧4h,得到CeO2载体.
浸渍法制备Pd基催化剂:取一定量CeO2载体加入PdCl2溶液,然后分别加入一定量的金属盐溶液(Fe(NO3)3,Co(NO3),CuCl2).搅拌2h后,85℃水浴蒸干,350℃H2氛围下还原2h,得到所需催化剂.分别记为Pd()/CeO2,Pd()-M()/CeO2(M=Fe、Co、Cu).其中为Pd实际负载的质量百分数(wt.%),为过渡金属实际负载的质量百分数(wt.%).
分别采用电感耦合等离子体发射光谱仪(ICP),扫描电子显微镜(SEM-EDS),X射线光电子能谱仪(XPS),比表面积测定仪(BET)以及CO化学吸附等设备对催化剂的结构和性质进行表征.
1.2 实验方法
2,4-二氯苯氧乙酸(2,4-D)的催化加氢脱氯反应在250mL的三口玻璃烧瓶中进行,分别为进气口、出气口和取样口.配制200mL一定浓度的2,4-D水溶液,使用1mol/L的NaOH溶液将反应pH值调至10.5,加入催化剂后通入N2(50mL/min),剧烈搅拌30min后将气流切换为H2(50mL/min)并开始计时,按一定的时间间隔取样,所有样品使用0.45μm的滤膜过滤后,通过高效液相色谱(Thermo U3000)检测其中有机物浓度.检测波长为285nm,柱温30℃,流动相为甲醇:水相乙酸 (5%)=60:40(:).根据液相所测污染物标准曲线计算得出实际浓度.每组实验重复2次以上.
2 结果与讨论
2.1 催化剂表征结果
由表1可知,引入过渡金属会对催化剂的CO吸附量造成不同程度的影响.其中,过渡金属Fe相较Co和Cu而言,CO吸附量的改变并不十分明显.在Pd-Fe催化剂中,当Fe的负载量较低时,如0.9%或2.7%,并不会显著影响其CO吸附量,但随着Fe负载量逐步增大,CO吸附量明显下降.可能是由于Fe覆盖在Pd颗粒表面,使得Pd活性位点数量有所减少,从而影响了CO在催化剂表面的化学吸附.

表1 催化剂基本性质
注:a通过ICP测定;b通过CO化学吸附检测得出.
图1是Pd(0.8)-Cu(2.5)/CeO2的SEM-EDS图,从中可以看出,Pd和Cu的分散较均匀,且不同金属及载体信号出现在同一区域内,表明2种金属间及金属与载体之间结合紧密,这与表1中通过CO化学吸附检测出的吸附量相互印证.

图1 Pd-Cu/CeO2SEM-EDS图
为了进一步研究金属间的相互作用,对催化剂进行了XPS表征.使用分峰软件XPS PEAK41对金属Pd的谱峰进行分析,图2为拟合后的谱图.其中,Pd/Pd0值见表2.
由图2可知,催化剂中同时存在金属态Pd(Pd0)和缺电子态Pd(Pd),且Pd/Pd0的值因引入的过渡金属不同而有所区别.表2列出了不同催化剂中Pd/(Pd0+Pd)值.可以看出,单金属催化剂Pd/CeO2中的Pd/(Pd0+Pd)值较高,这可能是由于较强的金属-载体相互作用导致.催化剂中添加过渡金属后, Pd/(Pd0+Pd)值有所降低,这是由于电子在双金属之间传递而引起Pd价态的改变,导致Pd含量降低.其中Fe对于这种改变的影响最为显著,Pd/Pd0的值最接近1.增加Fe的负载量,Pd/(Pd0+Pd) 的数值呈下降趋势,表明随着Fe负载量的增加,Pd和Fe这2种金属间的电子的转移逐渐加强.
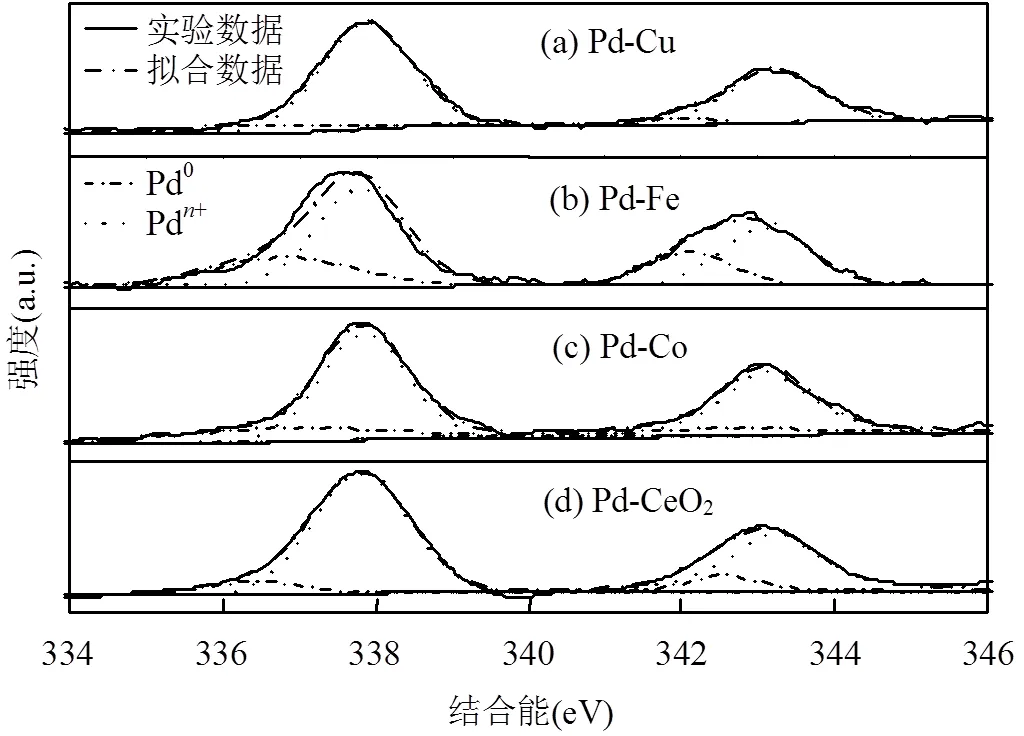

表2 催化剂的XPS谱图参数
2.2 不同过渡金属对2,4-D加氢脱氯的影响
图3中分别使用不同双金属催化剂对2,4-D进行催化加氢脱氯,比较引入不同的过渡金属对脱氯效果的影响.
由图3(a)可知,载体CeO2对2,4-D无加氢脱氯活性,在单金属催化剂中引入过渡金属不同程度上提升了催化剂的加氢还原能力.在Pd负载量相似时,催化剂的催化活性顺序为Pd-Fe>Pd-Co>Pd-Cu> Pd/CeO2,其中,Pd-Fe和Pd-Co催化剂在20min内即可将2,4-D中的氯完全脱除.根据XPS表征结果,Pd-Fe和Pd-Co催化剂中Pd/(Pd0+Pd)比值明显低于Pd-Cu和单金属Pd催化剂.有研究表明,当催化剂中同时存在Pd和Pd0时,催化剂才具有加氢脱氯活性(Pd0活化H2,Pd活化C-Cl),并且当Pd/Pd0接近1时可以取得最高的催化活性[22-23].本研究中Pd-Co与Pd-Fe催化剂的Pd/Pd0值较为接近1,有较强的活化H2和2,4-D中的C-Cl的能力,因此显示了较高的催化活性.
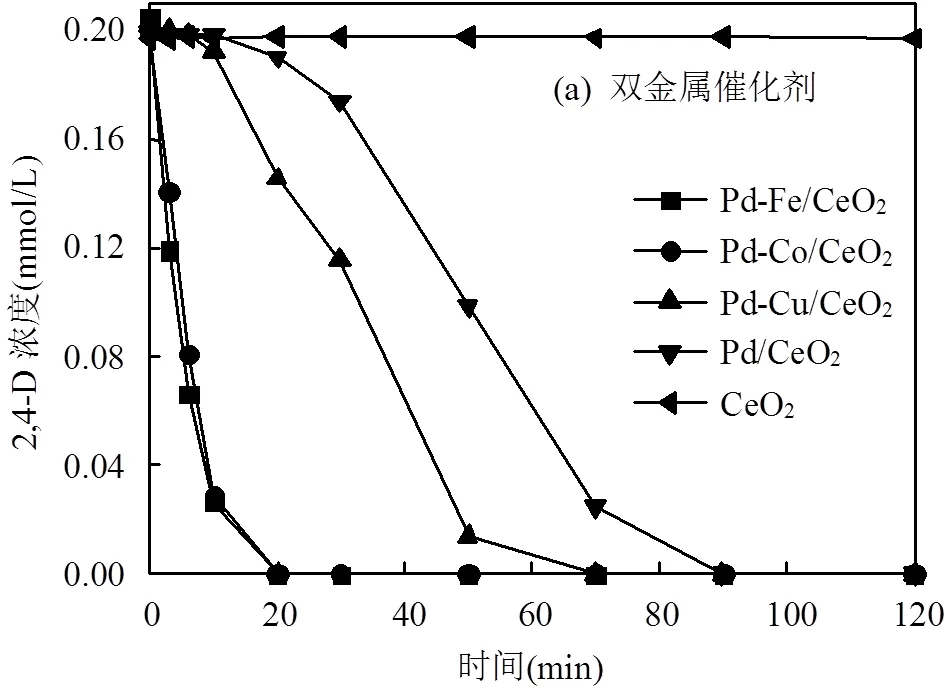
反应中催化剂用量(a) 0.25g/L, (b) 0.075g/L; 2,4-D (0.2mmol/L); pH=10.5
图3(b)显示了单金属与双金属催化剂对2,4-D的脱氯情况,Pd/CeO2及Pd-Fe/CeO2在2小时内脱氯效果分别为56.2%和100%,而Fe/CeO2对2,4-D的转化率几乎为零,可知Fe/CeO2并无催化加氢的能力,只有催化剂中含金属Pd时才具有催化2,4-D脱氯活性.
2.3 不同Fe负载量对2,4-D脱氯的影响
为了研究Pd与Fe的金属相互作用及其对催化脱氯的影响,使用不同Fe负载量的催化剂进行催化反应.

图4 Fe负载量对初活性的影响
反应中催化剂用量0.075g/L;2,4-D (0.2mmol/L);pH=10.5
图4显示了不同Fe负载量对反应初活性的影响,随着Fe负载量的增加,初始还原速率数值依次为3.24, 12.28, 15.28, 10.2和4.24(mmol/(L·gcat·h)).只有单金属存在时,反应初活性较低,引入Fe之后初活性有了明显的改变.当Fe负载量低于2.7%时,催化剂的催化活性随Fe负载量的增加而逐渐提高,进一步增加Fe负载量到4.7%后,初活性有所下降,但最终数值仍高于单金属Pd催化剂的初始反应速率.增加Fe负载量改变了Pd电子结构,增加了Pd0含量,加强了催化剂对H2的活化,但是随着Fe含量的增加,有较多的Fe包覆在Pd颗粒表面,造成反应活性位数量有所下降.综合各方面的因素,出现了初活性随着Fe负载量增加呈现出先升后降的趋势.
2.4 反应物初始浓度的影响
在非均相催化反应中,反应速率受到吸附在催化剂表面的反应物浓度的影响.通过改变反应物初始浓度,可以考察2,4-D在催化剂表面的吸附作用.反应结果如图5所示.
随着2,4-D初始浓度的增加,催化剂反应初活性逐渐升高,说明反应速率随2,4-D在催化剂表面吸附浓度的增加而逐渐增强.使用Langmuir- Hinshelwood模型对反应数据进行拟合可以进一步探究其中机理.
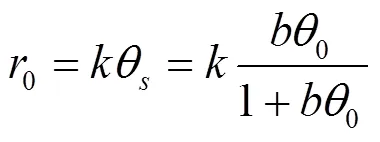
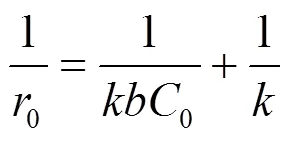
式中:0为2,4-D初始浓度为0时的加氢脱氯初活性;s为2,4-D吸附在催化剂表面的覆盖率;为反应速率常数;为2,4-D的吸附平衡常数.图5(b)显示1/r0与1/C0线性相关系数R2为0.95,即2,4-D的加氢脱氯反应符合Langmuir-Hinshelwood模型,表明2,4-D在催化剂表面的吸附过程是反应的速率控制步骤.
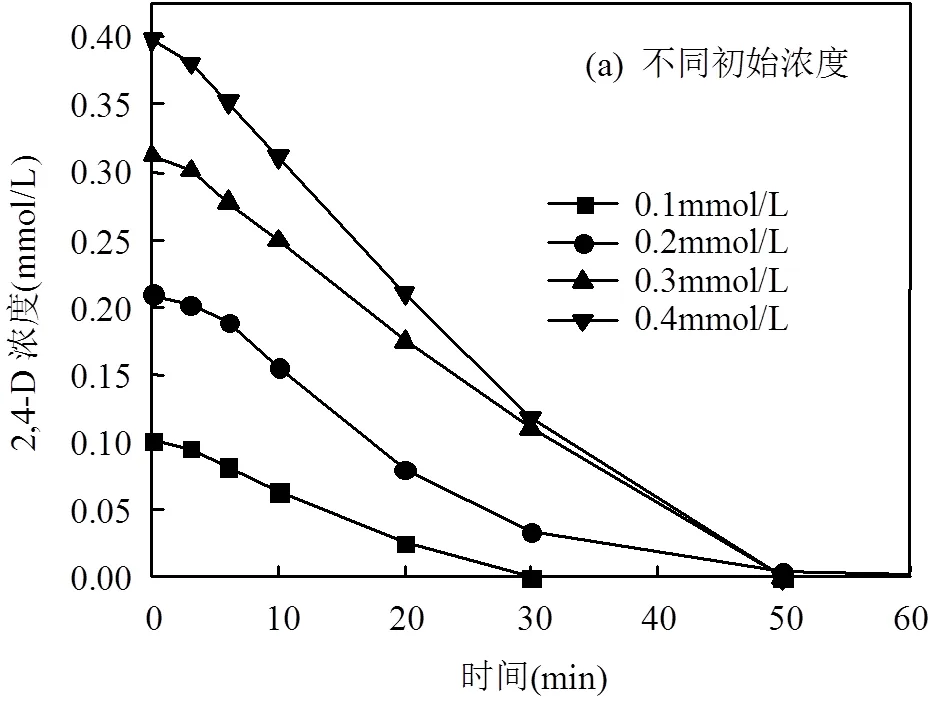
反应中催化剂为Pd(0.87)-Fe(2.7)/CeO2;投加量0.1g/L;初始pH=10.5
2.5 催化反应动力学
2,4-二氯苯氧乙酸的加氢脱氯曲线见图6.由图可知,脱氯过程可能存在同步脱氯和逐步脱氯2种途径,图7为其可能的脱氯过程.
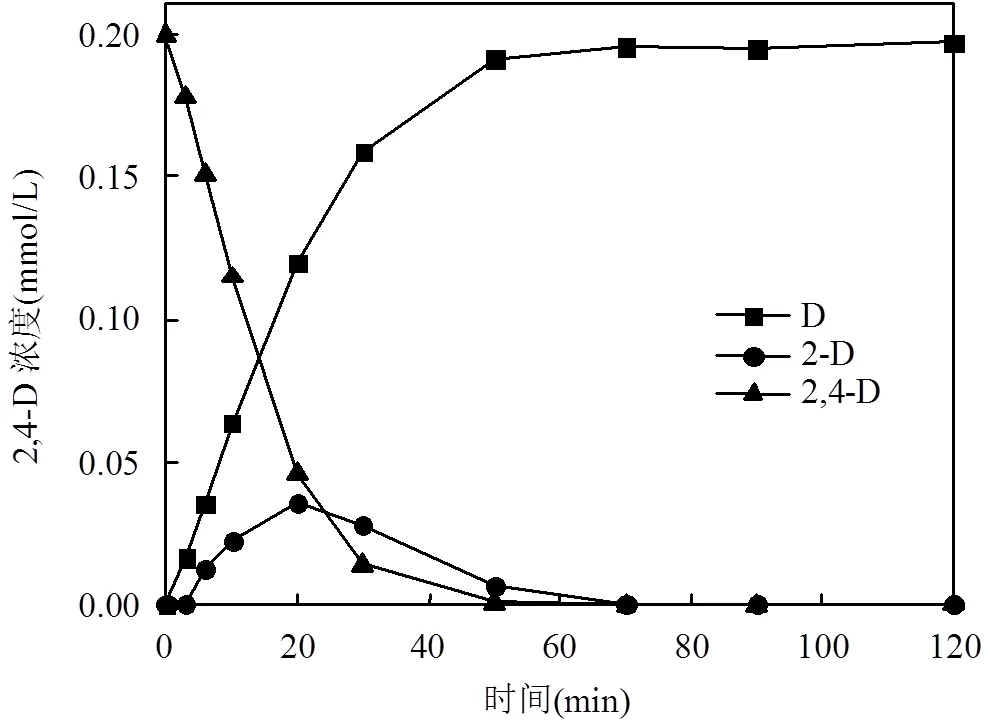
图6 Pd(0.87)-Fe(2.7)/CeO2对2,4-D的加氢脱氯曲线
反应中催化剂为Pd(0.87)-Fe(2.7)/CeO2; 投加量0.1g/L;2,4-D浓度0.2mmol/L;pH=10.5
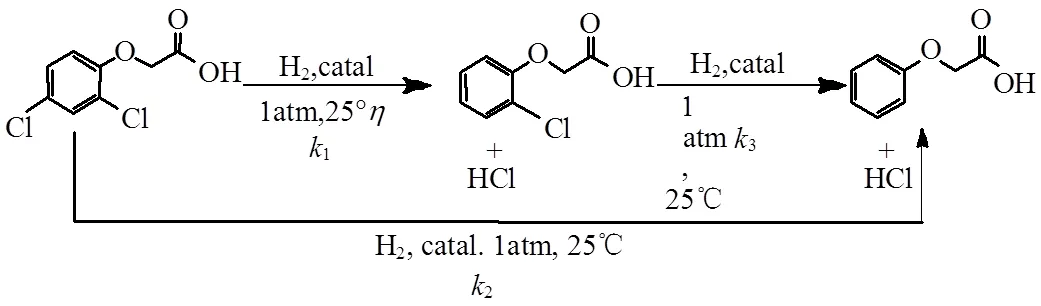
图7 2,4-二氯苯氧乙酸可能的脱氯反应途径
假设2,4-D的加氢脱氯反应符合一级动力学,其反应速率方程可写为: