AOB与AnAOB在不同生物填料上挂膜效果的研究
2019-10-23李鸿江徐晓晨杨凤林张树深
李鸿江,王 超,徐晓晨,杨凤林*,张树深
AOB与AnAOB在不同生物填料上挂膜效果的研究
李鸿江1,王 超2,徐晓晨1,杨凤林1*,张树深1
(1.大连理工大学环境学院,工业生态与环境工程教育部重点实验室,辽宁 大连 116024;2.清华大学核能与新能源技术研究院,北京 100084)
针对厌氧氨氧化工艺运行过程中污泥流失严重与启动时间长等问题,本研究通过对多种市售生物填料的挂膜实验,筛选适合好氧氨氧化菌与厌氧氨氧化菌挂膜的生物填料.结果表明,当活性污泥中的好氧氨氧化菌菌属为时,AQ1聚氨酯立方体填料最适合其挂膜,挂膜成熟时好氧氨氧化速率可以达到(0.81±0.08)mg N/(L·h),挂膜生物量为(0.87±0.14)mg VSS.而更适合厌氧氨氧化菌()挂膜的生物填料为K3环形填料,材质为聚乙烯或者聚丙烯.当厌氧氨氧化菌挂膜成熟时,其厌氧氨氧化速率可以达到(3.27±0.10)mg N/(L·h),挂膜生物量为(2.74±0.40)mg VSS.厌氧氨氧化菌在K3型填料上的挂膜要优于好氧氨氧化菌,其原因是厌氧氨氧化菌分泌的胞外聚合物含量要高于好氧氨氧化菌,而胞外聚合物是形成生物膜的重要因素.
好氧氨氧化菌;厌氧氨氧化菌;生物填料;生物膜;胞外聚合物
目前对氨氮废水的处理工艺主要分为物理化学工艺和生物处理工艺两类,生物脱氮工艺因其经济性而得到广泛的应用.生物脱氮的工艺主要有传统硝化反硝化工艺、短程硝化反硝化工艺、好氧反硝化工艺和厌氧氨氧化工艺等[1-5].自厌氧氨氧化(Anammox)反应发现以来,关于利用Anammox工艺进行生物脱氮的研究受到广泛关注.相比于传统的生物脱氮工艺,Anammox工艺具有能耗低、温室气体排放量少且不需外加有机碳源等优点[6].以厌氧氨氧化为核心的脱氮工艺被逐渐应用于实际废水处理中,因实际废水中所含的亚硝酸盐氮度较低,因此在利用Anammox工艺处理含氮废水时,需利用好氧氨氧化菌(AOB)将废水中的氨氮转化为亚硝酸盐氮之后厌氧氨氧化菌(AnAOB)则利用生成的亚硝酸盐氮与剩余的氨氮发生厌氧氨氧化反应生成氮气和部分硝酸盐氮.然而AnAOB属于化能自养的专性厌氧菌,倍增时间长(约为11d),AOB属于化能自养的好氧菌,倍增时间也在8h到几d之间[7],同时两种细菌在处理工艺中又较易流失,因此采取必要的措施以防止细菌流失是保证废水脱氮工艺稳定运行的必要条件.
移动床生物膜反应器(MBBR),通过向生物反应器内投加生物填料(biocarriers),使细菌吸附在填料上进而形成生物膜,从而有效地截留细菌,增加细菌的停留时间.MBBR工艺对含氮废水的脱氮效率具有显著的提升作用,有利于缓解城镇污水的脱氮压力[8-9].此外,郑敏等[10]研究发现采用MBBR工艺的城镇污水厂,相比于原来的悬浮污泥工艺,比好氧氨氧化速率高出约25.5%.同时,MBBR工艺中的生物填料可以使厌氧氨氧化反应在10 ℃的低温环境中也能顺利进行[11].在MBBR工艺中,用于好氧氨氧化菌和厌氧氨氧化菌挂膜的填料主要有SPR-III填料、Bioflow 9填料、PVA-gel珠填料、AnoxKaldnes K1和K3填料等,而材质多为聚乙烯[12-16].尽管关于好氧氨氧化菌和厌氧氨氧化菌的填料研究很多,但是各种填料种类繁多,在不同研究中都体现了各自填料的优势,目前关于各种填料分别利于好氧氨氧化菌与厌氧氨氧化菌挂膜的比较研究仍然较少.
基于以上研究背景,本研究选取了市面上较为常见的6种生物填料,分别比较AOB与AnAOB在不同填料上的挂膜效果,并探究其原因,为实际工艺应用中关于AOB和AnAOB填料的选取提供参考和依据.
1 实验材料与方法
1.1 实验装置
AOB与AnAOB培养装置如图1所示,反应器与二沉池均由有机玻璃制成,两反应器总容积均为13.0L,有效容积均为8.5L.AnAOB反应器与二沉池外包一层锡箔纸避光.AOB反应器pH控制在6.0~8.0之间,AnAOB反应器pH控制在6.5~8.0之间.AOB反应器曝气量根据进水氮负荷调节,溶解氧(DO)浓度最高不超过0.5mg/L;AnAOB反应器不定期曝氮气,以维持反应器内厌氧状态.AOB和AnAOB反应器温度均维持在(33±1)℃,回流比为200%.
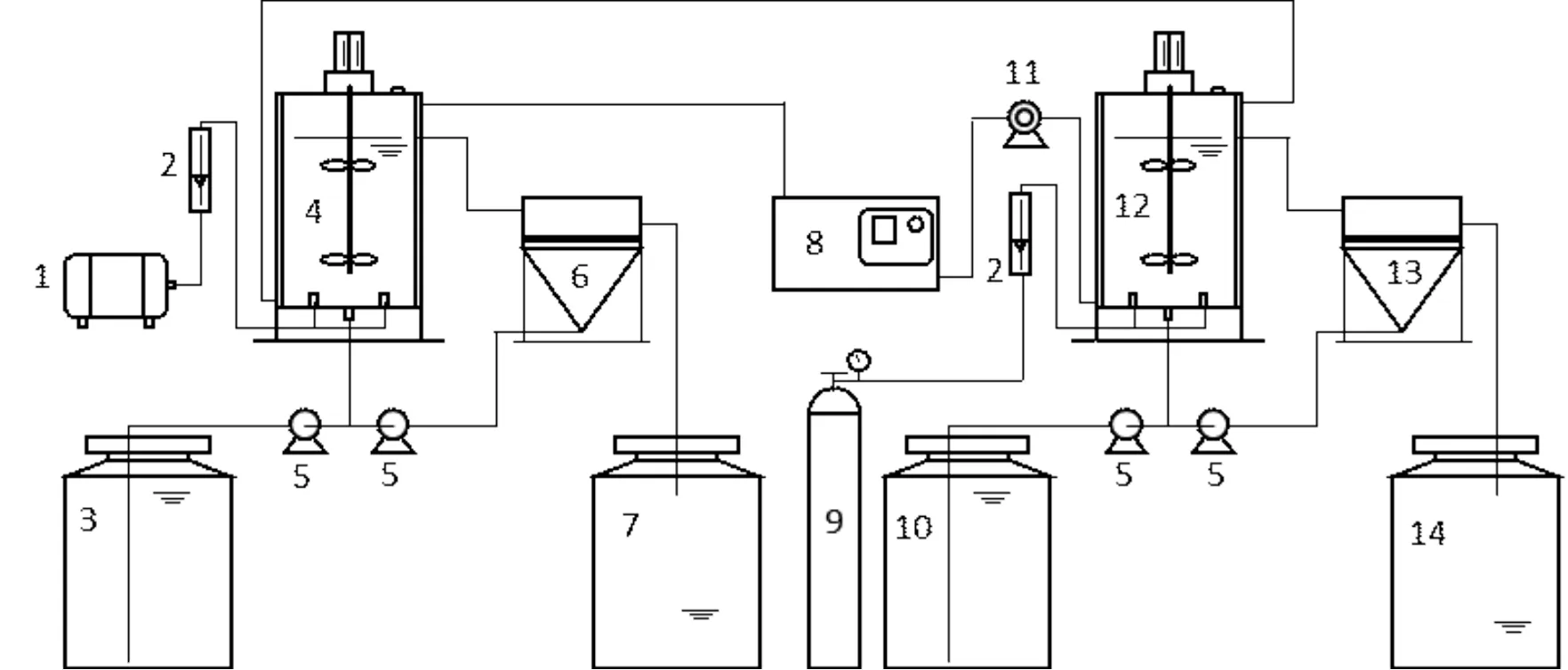
图1 实验装置示意
1.空气泵 2.气体流量计 3.AOB进水箱 4.AOB反应器 5. 蠕动泵 6.AOB沉淀池 7.AOB出水箱 8.恒温水箱 9.氮气罐 10.AnAOB进水箱 11.循环水泵 12.AnAOB反应器 13.AnAOB沉淀池 14.AnAOB出水箱
1.2 接种污泥
AOB反应器接种污泥取自大连市某污水处理厂,AnAOB反应器接种污泥取自课题组内厌氧氨氧化中试反应器[17].其中AOB反应器内悬浮固体浓度(MLSS)为3.90±0.03g/L;AnAOB反应器内MLSS为3.18±0.01g/L.
1.3 实验用水
实验用水为模拟废水.AOB所用氮源为NH4Cl, AnAOB所用氮源为NH4Cl和NaNO2,配水的NH4+-N与NO2--N比值采用理论比(1:1.32)[18].AOB与AnAOB所用无机盐与微量元素参考之前的研究[19],组分如下(g/L): KHCO31.25、KH2PO40.025、CaCl2· 2H2O 0.3、MgSO4· 7H2O 0.2、FeSO40.00625、EDTA 0.00625;1mL/L微量元素溶液(g/L) (EDTA15、ZnSO4·7H2O 0.43、CoCl2· 6H2O 0.24、MnCl2· 4H2O 0.99、CuSO4 · 5H2O 0.25、NaMoO4· 2H2O 0.22、NiCl2· 6H2O 0.19、NaSeO4· 10H2O 0.21、H3BO40.014、NaWO4· 2H2O 0.05).
1.4 生物填料
实验所用的6种生物填料均购自市场,是市面上常见的生物填料.采用快速排泥法进行挂膜,挂膜启动时,将6种生物填料以相同个数投放到反应器内,使反应器内生物填料的填充比为50%.各个生物填料具体参数见表1.

表1 实验所用生物填料参数
注:1PU (polyurethane)为聚氨酯;2PP (polypropylene)为聚丙烯;3PE (polyethylene)为聚乙烯.
1.5 挂膜实验
将AOB与AnAOB污泥分别放入各自的反应器进行培养,并每天测定两个反应器进出水的NH4+-N、NO2--N和NO3--N.整个培养过程分为两个阶段.
(1)第一阶段悬浮污泥批次试验
以比好氧氨氧化速率(SAOR)衡量AOB悬浮污泥活性.测定步骤:取AOB反应器活性污泥加入血清瓶,在瓶内配制NH4+-N溶液(无机盐与微量元素添加量与前述实验用水相同),血清瓶在水浴锅内加热至(33±1)℃并曝空气,每次实验3个平行样,共反应9h,每隔1h取一批水样测定NH4+-N、NO2--N和NO3--N.根据拟合的NH4+-N浓度降解曲线和污泥浓度算出SAOR,每10d测1次.
以比厌氧氨氧化活性(SAA)衡量AnAOB悬浮污泥活性.测定步骤:取AnAOB反应器活性污泥加入血清瓶,在瓶内配制NH4+-N和NO2--N培养液(无机盐与微量元素添加量与前述相同),曝氮气30min后密封血清瓶,血清瓶与一氮气袋相通,以保证取样时瓶内外气压相同,将血清瓶放入恒温摇床中以(33±1)℃、160r/min条件进行厌氧实验,每次实验3个平行样,共反应9h,每隔1h取一批水样测定NH4+-N、NO2--N和NO3--N.据拟合的基质浓度降解曲线和污泥浓度算出SAA,每10d测1次.
(2)第二阶段附着污泥批次试验
以好氧氨氧化速率(AOR)度量生物填料上AOB附着污泥对氨氮转化的快慢.测定步骤:在螺口瓶内配制NH4+-N溶液(无机盐与微量元素添加量与前述试验用水相同),取AOB反应器挂膜的填料加入螺口瓶,其余测定步骤与SAOR步骤相同.据拟合的NH4+-N浓度降解曲线计算出AOR,每20d测一次.
以厌氧氨氧化速率(AR)度量生物填料上AnAOB附着污泥对氮去除的快慢.测定步骤:在螺口瓶内配制NH4+-N和NO2--N培养液(无机盐与微量元素添加量与前述相同),取AnAOB反应器挂膜的填料加入螺口瓶,其余测定步骤与SAA步骤相同.根据拟合基质浓度降解曲线计算出AR,每20d测一次.
(3)填料附着污泥生物量测定
待生物膜成熟后,取出AOB和AnAOB反应器中的生物填料,对其所挂污泥进行称重,测定MLVSS,每次实验3个平行样.
(4)胞外聚合物的提取与测定
将生物填料上的附着污泥取下,采用热提取法提取胞外聚合物(EPS).蛋白质(PN)的含量采用修正的Folin-Lowry法[20-21]测定,标准物质为牛血清蛋白;多糖(PS)的含量采用蒽酮法[20-21]测定,标准物质为葡萄糖.EPS的提取总量以多糖和蛋白质含量的总和表示.
1.6 分析项目与测定方法
(1)常规项目分析方法
NH4+-N:纳氏试剂分光光度法[22]、NO2--N: N-(1-萘基)-乙二胺分光光度法[22]、NO3--N:紫外分光光度法[22];MLSS和MLVSS:重量法[22];pH值、DO及水温的测定采用Multi 3430多参数水质分析仪(德国WTW).
(2)微生物群落分析
在两个反应器运行的第0和80d对反应器内的活性污泥进行微生物群落分析.将取得的污泥样品置于50mL离心管中以15,000r/min离心10min,之后将离心得到的固体样品转移至送样管中,并置于-20℃冰箱内保存,后续DNA抽提、PCR扩增和Illumina Miseq测序委托上海美吉生物医药科技有限公司进行测定.
2 结果与讨论
2.1 AOB和AnAOB反应器运行效果
在第一阶段(1~80d)和第二阶段(81~340d)中AOB和AnAOB反应器的进水氮负荷(NLR)和水力停留时间(HRT)同步调整,如图2(a)所示.AOB和AnAOB反应器的运行情况分别如图2(b)和2(c)所示.
在第一阶段,AOB和AnAOB反应器的HRT均为1d.AOB反应器的进水氮负荷从0.2kg N/(m3·d)逐步升高到0.6kg N/(m3·d),NH4+-N转化成NO2--N的转化效率从17%升高到53.78%.AOB反应器运行的80d内,微曝气和适宜AOB生长的温度保证了最高不超过7.29%的NH4+-N转化成NO3--N,普遍在5%.AnAOB反应器在进水氮负荷0.2~0.4kg N/(m3·d)时,总氮去除率保持在90%以上.当进水氮负荷从0.4kg N/(m3·d)升高到0.6kg N/(m3·d)时,氮负荷的升高导致了反应器运行的稳定性变差,总氮去除量虽略有上升,但总氮去除率下降到64.41%,此时出水中NH4+-N、NO2--N和NO3--N浓度分别为83.86mg/L、104.52mg/L和32.46mg/L.
第80d AOB和AnAOB反应器采用快速排泥法进行生物填料挂膜.由图2(b)可知,第81d AOB反应器处理效果急剧下降,AOB反应器内仅有4.42%的NH4+-N转化成NO2--N,这表明生物填料的投加对反应器内的好氧氨氧化反应造成了不利影响.因此,在第91d将AOB反应器内进水NH4+-N浓度降至200mg/L,经过18d的运行,反应器的NH4+-N对NO2--N的转化率升高至33.24%.之后,通过逐步提升进水氨氮负荷的方法,最终将进水NH4+-N浓度提高至600mg/L,此时NH4+-N对NO2--N的转化率达到52.21%.由图2(c)可知,投加生物填料后对厌氧氨氧化反应也造成了不利影响.因此,在第91d同样将进水总氮浓度降低至200mg/L,总氮去除率提升至63.15%,到第110d去除率达到69.78%.之后,采取和AOB反应器同样的策略将进水总氮浓度提高到600mg/L,在第180d出水NH4+-N、NO2--N和NO3--N浓度分别为24.26mg/L、34.66mg/L和20.98mg/L,总氮去除率为86.49%.
图3 污泥样本的稀释曲线(a);污泥样本中微生物群落分析(b)
Fig.3 Rarefaction analysis of sludge samples (a); microbial community analysis in sludge samples (b) AOB1、AOB2分别表示AOB反应器运行第0和80d的样本;AnAOB1、AnAOB2分别表示AnAOB反应器运行第0和80d的样本
第181d起通过缩短HRT、变换进水氮源浓度来提升两反应器的抗负荷冲击能力.第240d起AOB反应器进水NH4+-N浓度的变化已基本不会造成出水NH4+-N浓度值的显著波动,表明反应器的抗负荷冲击能力逐渐变强,反应器运行的稳定性越来越好,第290~340d,NH4+-N对NO2--N的转化率稳定在52%~61%之间.除个别天数外,NH4+-N对NO3--N的转化率总体成功控制在5%以下.AnAOB反应器运行到第250d以后,进水总氮的浓度变化基本不会对出水的NH4+-N、NO2--N和NO3--N浓度产生影响,表明AnAOB反应器稳定性良好,抗负荷冲击能力强,第290~340d,总氮的去除率稳定在86%~91%之间.两反应器采取负荷变动的策略来培养污泥是因为生物膜的骨架结构由EPS构成[23],而Guo等[24]的研究指出交替的负荷能促进EPS的生成.
2.2 AOB和AnAOB反应器内微生物群落结构分析
如图3(a)所示AOB与AnAOB反应器在运行第0和80d的污泥样品测序后得到的稀释曲线趋向平坦,表明测序的数据量足够多,能够满足污泥样品内微生物群落的分析.如图3(b)所示,AOB反应器内AOB菌属为,其相对丰度由接种污泥中的0.56%升高到驯化后的9.12%,同时AOB反应器内的污泥经过80d的培养,污泥样品的微生物种类及丰度发生较大变化,这是因为进水从污水处理厂的实际废水变成了实验室配制的模拟废水,某些细菌因不能适应外界条件的变化而被淘汰.AnAOB反应器内AnAOB菌属为,此外,由于反硝化细菌的存在,实际反应器出水中的NO3--N浓度值低于反应器内仅发生厌氧氨氧化反应生成NO3--N的理论浓度值.
2.3 AOB和AnAOB反应器内微生物活性分析
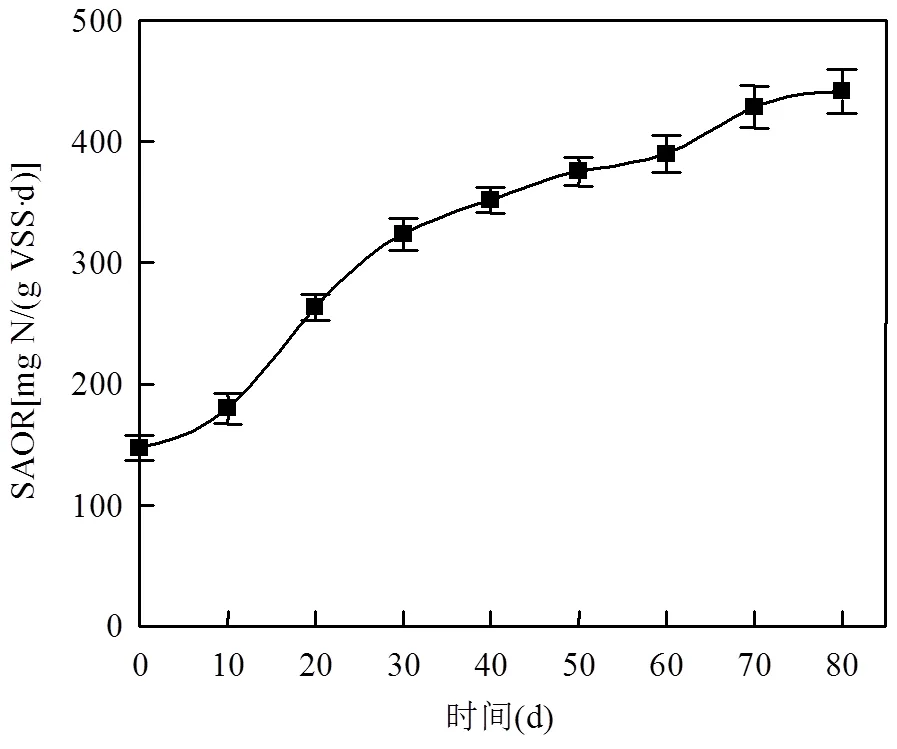
AOB与AnAOB反应器在第一阶段中污泥的活性变化分别如图4(a)与4(b)所示.AOB反应器内活性污泥第0d的SAOR仅为147.25±10.37mg N/(g VSS·d),之后每隔10d SAOR较上一次均有提高直至第70d,达到441.31±18.30mg N/(g VSS·d).根据高于孙洪伟等[25]研究的SAOR拟合曲线的峰值(0.32g N/( g VSS·d),可判断AOB反应器运行状态稳定良好,可进行第二阶段的挂膜实验.AnAOB反应器内活性污泥第0d的SAA仅为192.36±10.33mg N/(g VSS·d),后续每隔10d SAA均有增长直至第70d,达到552.42±16.73mg N/(g VSS·d),与厌氧氨氧化MBR的SAA峰值(0.0562g N/(g VSS·d))相近[26],可认为污泥的厌氧氨氧化活性已达到良好水平,此时反应器内总氮的去除率为64.41%,反应器运行稳定,可以进行第二阶段的挂膜实验.
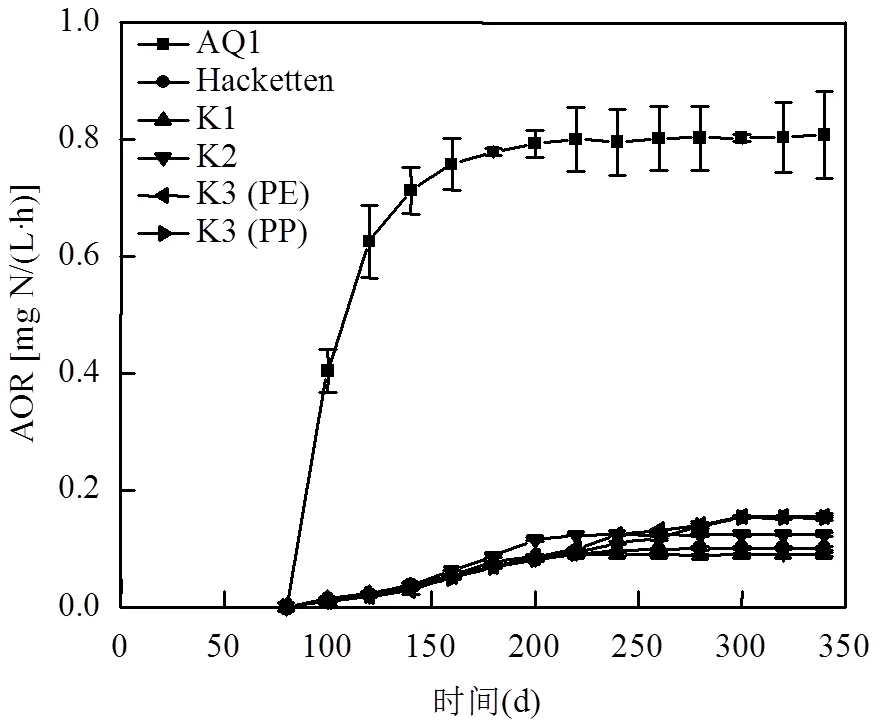
第二阶段中AOB反应器内单个生物填料AOR的变化与AnAOB反应器内单个生物填料AR的变化分别如图5(a)与5(b)所示.对于AOB反应器内挂膜的生物填料,AQ1型填料的AOR在挂膜20d增长最快,之后AQ1型填料的增长速率逐渐减小,在第200d,AQ1型填料的AOR达到稳定;而Hacketten、K1、K2、K3 (PE)和K3 (PP)型填料的AOR在挂膜20d的增长远低于AQ1型填料,且这5种生物填料AOR的增长基本相同.随后K2型填料的AOR增长略高于Hacketten、K1、K3 (PE)和K3 (PP)型.第340d单个生物填料的AOR从高到低排序依次是AQ1、K3 (PE)、K3 (PP)、K2、Hacketten、K1,AQ1型填料的AOR最大,可以达到0.81±0.08mg N/(L·h).由以上研究结果可知,生物填料AQ1型上的AOB具有最高的微生物活性.
对于AnAOB反应器内挂膜的生物填料,在挂膜第20d,AQ1型填料的AR增长最快,随后AQ1型的AR增长逐渐速度逐渐减小,在第160d达到稳定.与AQ1型填料不同的是K1型的AR增长缓慢, Hacketten型在挂膜第20d到260d中每20d的AR增长幅度变化相近, K2型填料的AR在挂膜后平稳增长,每隔20d的增长幅度略微提高直至挂膜第180d,第220d开始增长幅度变大,K3 (PE)和K3 (PP)型的AR曲线变化相近,曲线呈S型,其增长幅度基本呈现出先增大后减小的特征.在第340d单个生物填料的AR从高到低排序依次是K3 (PE)、K3 (PP)、Hacketten、K2、AQ1、K1,K3 (PE)型填料AR可以达到3.27±0.10mg N/(L·h).由以上研究结果可知,生物填料K3 (PE)型上的AnAOB具有高的微生物活性.
2.4 AOB和AnAOB反应器内生物填料挂膜效果分析
AOB和AnAOB反应器运行的第340d,其各自生物填料的AR与AOR均达到稳定,由此判断生物填料上的生物膜已经成熟.如图6所示,在挂膜过程中,AOB和AnAOB反应器内的生物填料均未发现填料有破损现象,此外AOB和AnAOB反应器内六中单个生物填料的AOR(AR)在挂膜末期均能达到稳定状态.因此,AOB 和AnAOB反应器内水力条件温和,未对挂膜和生物填料造成不利影响.对两反应器内不同生物填料生物量的测定结果如图7所示,对两反应器内生物填料附着污泥EPS含量分析的结果如表2所示.
AOB反应器单个生物填料附着污泥的生物量从高到低依次是AQ1、K3 (PE)、K3 (PP)、K2、Hacketten、K1型,AQ1型的生物量可以达到0.87±0.14mg VSS,排序结果与同期单个生物填料AOR的排序结果相同;AnAOB反应器附着污泥的生物量从高到低依次是K3 (PE)、K3 (PP)、Hacketten、K2、AQ1、K1型,K3 (PE)型和K3 (PP)型的生物量可以达到2.74±0.40、2.73±0.28mg VSS,排序结果同样与同期单个生物填料AR的排序结果相同.由此可知,生物填料上微生物活性的高低与吸附到生物填料上的污泥量存在一定的相关性.EPS分析结果表明,AOB反应器内生物填料附着污泥的EPS含量明显低于AnAOB反应器内同种生物填料附着污泥EPS的含量,说明AOB分泌的EPS含量要低于AnAOB分泌的EPS含量,这与Wang等[27]得到的分析结果一致.同时,EPS含量与生物填料附着污泥生物量的比较结果相同,说明生物填料挂膜的难易与生物膜中EPS含量存在一定的相关性.而对于生物填料AQ1型,单个生物填料附着污泥生物量相近,但生物填料的EPS分析结果相差较大,这很可能是因为AQ1型的结构疏松多孔,具有较好的吸附性能,AOB污泥是被动而非主动挂在AQ1型上,这能从图5中AQ1型AOR与AR在第二阶段初期的增长速度高于另五种生物填料的增长速度得到很好的验证.表2中PN/PS比在1.09~2.34之间,这与相关的研究结果相符[28].
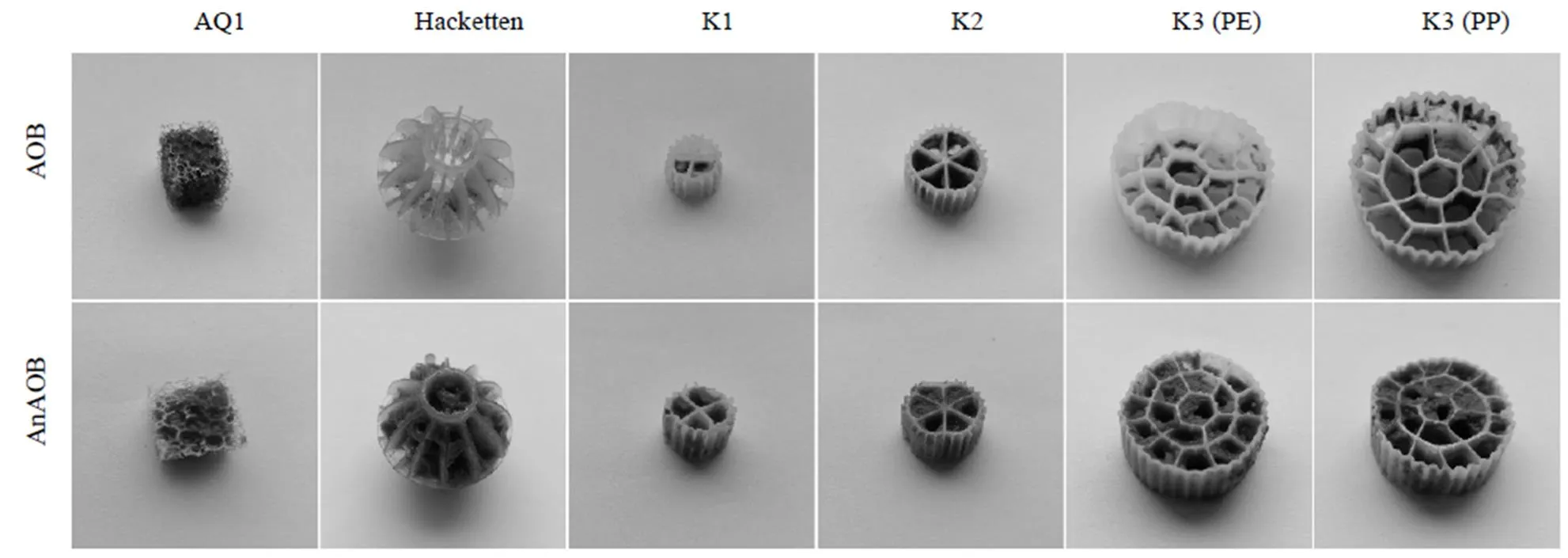
图6 生物膜成熟时期生物填料挂膜实物

图7 生物膜成熟时单个生物填料附着生物量
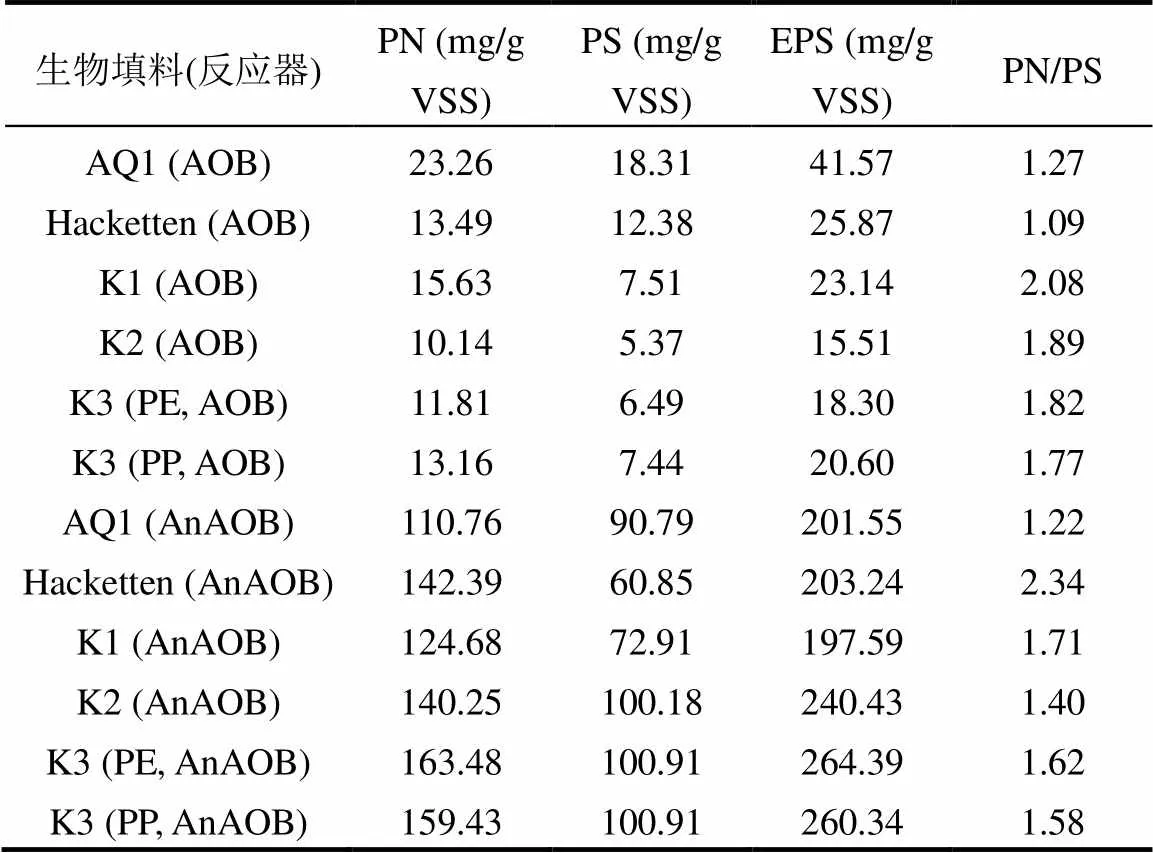
表2 生物填料附着污泥EPS含量
实验中类型、比表面积均相同但材料不同的K3 (PE)与K3 (PP)型对同种污泥挂膜效果几乎相同,说明PP与PE材质对AOB和AnAOB挂膜的效果一样.对于AOB,Hacketeen、K1、K2、K3(PE、PP)型的挂膜效果相近,且远劣于AQ1,这说明当AOB污泥被动挂膜时,生物填料的类型和规格并非是影响AOB污泥挂膜的绝对决定因素,主要决定因素是生物填料的材质和比表面积.而对于AnAOB,AQ1型的挂膜效果劣于Hacketeen、K2和K3(PE、PP)型,表明比表面积并不是影响AnAOB污泥挂膜的决定因素;K3(PE、PP)型的挂膜效果优于K2型和K1型,挂膜效果排序恰好与比表面积排序相反,但与内体积排序相同,推测可能是在某一范围内,生物填料的内体积越大, AnAOB的挂膜效果效果越好.K3(PP)型的挂膜效果优于Hacketten型,而两种生物填料的比表面积相同,这说明生物填料的类型与规格同样会影响AnAOB挂膜,造成这种结果的原因可能是生物填料的类型与规格不同,其内部的水流湍动程度不同,对挂膜的影响程度也就不同.综上所述,AOB主动挂膜效果较差,在生物填料中决定AOB挂膜效果的重要因素是生物填料的材质和比表面积; AnAOB主动挂膜效果较好,生物填料的类型、内体积是决定AnAOB挂膜的重要因素.而AOB与AnAOB的挂膜效果差异较大与两种细菌分泌的EPS含量不同有直接关系,此外AnAOB喜聚集生长[29],这也可能是AnAOB相对较易挂膜的重要原因.
3 结论
3.1 AOB反应器在投加生物填料后反应器NH4+- N的转化效果有明显提升,在HRT为0.5d,反应器进水氨氮在600~700mg/L时,氨氮的转化率能稳定在52%~61%之间,AOB菌属是.AnAOB反应器在投加生物填料后反应器氮去除率有大幅提升,在HRT为0.5d,反应器进水总氮在600~ 700mg/L时,反应器总氮去除率能稳定在86%~91%, AnAOB菌属是.
3.2 AOB与AnAOB及挂膜的6种生物填料,经过260d挂膜培养后,生物填料上的生物膜均达到成熟状态.其中AOB挂膜的最优生物填料是AQ1聚氨酯立方体填料,AnAOB挂膜的最优生物填料是K3型填料.对于生物填料K3型的挂膜效果,AnAOB显著优于AOB,这是由于AnAOB分泌的EPS量要高于AOB,有利于AnAOB在生物填料K3型上形成生物膜.而由于AOB分泌的EPS量较少,对于AOB的挂膜,更适合选择与AQ1型特征(疏松多孔、吸附性好)类似的生物填料,使AOB附着在生物填料上进行生长.
[1] Ma B, Wang S, Cao S, et al. Biological nitrogen removal from sewage via anammox: Recent advances [J]. Bioresource Technology, 2016,200:981-990.
[2] Delgado Vela J, Stadler LB, Martin KJ, et al. Prospects for biological nitrogen removal from anaerobic effluents during mainstream wastewater treatment [J]. Environmental Science & Technology Letters, 2015,2(9):234-244.
[3] Van Hulle S W H, Vandeweyer H J P, Meesschaert B D, et al. Engineering aspects and practical application of autotrophic nitrogen removal from nitrogen rich streams [J]. Chemical Engineering Journal, 2010,162(1):1-20.
[4] Sun S, Nàcher CPI, Merkey B, et al. Effective biological nitrogen removal treatment processes for domestic wastewaters with low C/N Ratios: A review [J]. Environmental Engineering Science. 2010,27(2): 111-126.
[5] Ahn Y. Sustainable nitrogen elimination biotechnologies: A review [J]. Process Biochemistry, 2006,41(8):1709-1721.
[6] Zhang Y, Ma H, Chen R, et al. Stoichiometric variation and loading capacity of a high-loading anammox attached film expanded bed (AAEEB) reactor [J]. Bioresource Technology, 2018,253:130-140.
[7] 陈重军,王建芳,张海芹,等.厌氧氨氧化污水处理工艺及其实际应用研究进展[J]. 生态环境学报, 2014,23(3):521-527.Chen Chongjun, Wang Jianfang, Zhang Haiqin, et al. Research progress in anammox wastewater treatment system and its actual application [J]. Ecology and Environmental Sciences. 2014,23(3):521- 527.
[8] Zekker I, Rikmann E, Tenno T, et al. Modification of nitrifying biofilm into nitritating one by combination of increased free ammonia concentrations, lowered HRT and dissolved oxygen concentration [J]. J. Environ. Sci. (China), 2011,23(7):1113-1121.
[9] 何国富,周增炎,高廷耀,等.悬浮填料活性污泥法优化填料投配比试验[J]. 环境工程, 2006,(1):78-80.He Guofu, Zhou Zengyan, Gao Tingyao, et al. Experiment on optimizing the adding ratio of suspended media for suspended media activated-sludge process [J]. Environmental Engineering, 2006,(1): 78-80.
[10] 郑 敏,杨 波,汪诚文,等.中试MBBR装置强化氨氮去除速率的影响条件研究[J]. 中国环境科学, 2012,32(10):1778-1783.Zheng Min, Yang Bo, Wang Cheng-wen, et al. Enhanced ammonia removal rate in a pilot-scale MBBR [J]. China Environmental Science. 2012,32(10):1778-1783.
[11] Gilbert E M, Agrawal S, Karst S M, et al. Low temperature partial nitritation/anammox in a moving bed biofilm reactor treating low strength wastewater [J]. Environmental Science & Technology, 2014, 48(15):8784-8792.
[12] 周家中,吴 迪,韩文杰,等.基于MBBR的CANON工艺处理消化液中式启动[J]. 中国环境科学, 2019,39(6):2378-2386. Zhou Jia-zhong, Wu Di, Han Wen-jie, et al. Pilot scale start-up of CANON disposal sludge-digestion wastewater treatment based on MBBR [J]. China Environmental Science, 2019,39(6):2378-2386.
[13] Zekker I, Rikmann, E, Tenno T, et al. Anammox bacteria enrichment and phylogenic analysis in moving bed biofilm reactors [J]. Environmental Engineering Science, 2012,29:946-950.
[14] Rouse J D, Burica O, Strazar M, et al. A pilot-plant study of a moving-bed biofilm reactor system using PVA gel as a biocarrier for removals of organic carbon and nitrogen [J]. Water Science & Technology, 2007,55:135-141.
[15] Abzazou T, Araujo R M, Auset M, et al. Tracking and quantification of nitrifying bacteria in biofilm and mixed liquor of a partial nitrification MBBR pilot plant using fluorescencehybridization [J]. Science of the Total Environment. 2016,541:1115-1123.
[16] Young B, Banihashemi B, Forrest D, et al. Meso and micro-scale response of post carbon removal nitrifying MBBR biofilm across carrier type and loading [J]. Water Research, 2016,91:235-243.
[17] Wang X, Xu X, Liu S, et al. Combination of complex adsorption and anammox for nitric oxide removal [J]. J. Hazardous Materials, 2016, 312:175-183.
[18] Chen H, Liu S, Yang F, et al. The development of simultaneous partial nitrification, ANAMMOX and denitrification (SNAD) process in a single reactor for nitrogen removal [J]. Bioresource Technology, 2009,100(4):1548-1554.
[19] Third KA, Paxman J, Schmid M, et al. Enrichment of Anammox from Activated Sludge and Its Application in the CANON Process [J]. Microbial Ecology, 2005,49(2):236-244.
[20] Zhang W, Cao B, Wang D, et al. Influence of wastewater sludge treatment using combined peroxyacetic acid oxidation and inorganic coagulants re-flocculation on characteristics of extracellular polymeric substances (EPS) [J]. Water Research, 2016,88:728-739.
[21] Li X Y, Yang S F. Influence of loosely bound extracellular polymeric substances (EPS) on the flocculation, sedimentation and dewaterability of activated sludge [J]. Water Research, 2007,41(5):1022-1030.
[22] 国家环境保护总局.水和废水监测分析方法[M]. 4版.北京:中国环境科学出版社, 2002.The State Environmental Protection Administration. Water and wastewater monitoring and analysis method (Fourth Edition) [M]. Beijing: China Environmental Science Press, 2002.
[23] Flemming H, Wingender J. The biofilm matrix [J]. Nature Reviews Microbiology, 2010,8(9):623-633.
[24] Guo Y, Liu S, Tang X, et al. Insight into c-di-GMP Regulation in Anammox Aggregation in Response to Alternating Feed Loadings [J]. Environmental Science & Technology, 2017,51(16):9155-9164.
[25] 孙洪伟,尤永军,白宝霞,等.游离氨对硝化菌活性的短期抑制影响试验研究[J]. 中国给水排水, 2015,31(3):19-23.Sun Hong-wei, You Yong-jun, Bai Bao-xia, et al. Study on short- term inhibition of free ammonia on activity of nitrifying bacteria [J]. China Water & Wastewater, 2015,31(3):19-23.
[26] Suneethi S, Joseph K. ANAMMOX process start up and stabilization with an anaerobic seed in Anaerobic Membrane Bioreactor (AnMBR) [J]. Bioresource Technology, 2011,102(19):8860-8867.
[27] Wang C, Liu S, Xu X, et al. Potential coupling effects of ammonia-oxidizing and anaerobic ammonium-oxidizing bacteria on completely autotrophic nitrogen removal over nitrite biofilm formation induced by the second messenger cyclic diguanylate [J]. Applied Microbiology and Biotechnology. 2017,101(9):3821-3828.
[28] 袁冬琴,王毅力.活性污泥胞外聚合物(EPS)的分层组分及其理化性质的变化特征研究[J]. 环境科学, 2012,33(10):3522-3528. Yuan Dong-qin, Wang Yi-li. Study on the stratification components of extracellular polymeric substances (EPS) in activated sludge and their variation characteristics in physicochemical properties [J]. Environmental Science, 2012,33(10):3522-3528.
[29] Wett B. Development and implementation of a robust deammonification process [J]. Water Science and Technology, 2007, 56(7):81-88.
Biofilm formation of ammonia-oxidizing bacteria and anaerobic ammonium-oxidizing bacteria on different biocarries.
LI Hong-jiang1, WANG Chao2, XU Xiao-chen1, YANG Feng-lin1*, ZHANG Shu-shen1
(1.Key Laboratory of Industrial Ecology and Environmental Engineering, Ministry of Education, School of Environmental Science and Technology, Dalian University of Technology, Dalian 116024, China;2.Collaborative Innovation Center for Advanced Nuclear Energy Technology, Tsinghua University, Beijing 100084, China)., 2019,39(10):4141~4149
The typical setbacks of the operation of anaerobic ammonium oxidation (Anammox) process were the serious sludge loss and long startup time. Herein, the biofilm formation experiments were designed to select several commercial biocarriers with better biofilm performance for ammonia-oxidizing bacteria (AOB) and anaerobic ammonium-oxidizing bacteria (AnAOB). The results showed that AQ1polyurethane cubic biocarrier was the most suitable biocarrier for AOB to form biofilm. The ammonia oxidation rate of matured biofilm was (0.81±0.08)mg N/(L·h) and the biofilm biomass was (0.87±0.14)mg VSS.was dominant species in the activated sludge. For AnAOB (), K3 annular biocarrier (made of polyethylene or polypropylene) was the most suitable biocarrier for the biofilm formation. The anaerobic ammonium oxidation rate of matured biofilm could reach (3.27±0.10)mg N/(L·h), and the biofilm biomass was (2.74±0.40)mg VSS. The biofilm formation of AnAOB on the K3 biocarrier was better than AOB. The reason was that the content of extracellular polymeric substances secreted by AnAOB was higher than that of AOB, and extracellular polymeric substances play an important role in biofilm formation.
ammonia-oxidizing bacteria;anaerobic ammonium-oxidizing bacteria;biocarrier;biofilm;extracellular polymeric substances
X703.5
A
1000-6923(2019)10-4141-09
李鸿江(1994-),蒙古族,男,内蒙古赤峰人,大连理工大学硕士研究生,从事水污染防治与控制工程的研究和应用.
2019-04-09
国家自然科学基金资助项目(21777018)
* 责任作者, 教授, yangfl@dlut.edu.cn
