皮层听觉诱发电位的P1-N1-P2成分在听力障碍人群中的研究进展*
2019-10-23熊晶晶杨影
熊晶晶 杨影
皮层听觉诱发电位(cortical auditory evoked potentials,CAEP)是由听觉刺激和电刺激引起的外周和中枢听觉系统的电反应[1],自上世纪六七十年代以来一直是人们关注和研究的热点。在过去,CAEP主要应用于评估成人听敏度和不能配合行为测试受试者的客观听阈测试,如:新生儿、听神经病、自闭症、智力障碍和老年痴呆患者等。目前,随着信息科学的进步,CAEP技术具有更高的灵敏度和特异性,以及可以自动检测、分析和记录皮层反应的特点[2],多应用于听力障碍人群的客观听阈测试、人工耳蜗植入(CI)术后效果评估和听神经病患者的言语感知能力评估等,本文就CAEP的P1-N1-P2成分在听力障碍人群中的研究进展进行综述。
1 CAEP的P1-N1-P2成分来源及发展特征
1962年,Williams等首先在睡眠状态下记录到了人的听觉长潜伏期反应(auditory long latency response,ALR),也称CAEP;1963年,Davis首先明确了ALR的主要波形(P1-N1-P2),并证明P1-N1-P2反应阈值很好地契合了行为听阈[3]。
CAEP发生在声刺激后50~300 ms,由一系列正波和负波组成,CAEP包括内源成分和外源成分,内源成分包括失匹配负波(mismatched negative wave,MMN)和P300等;外源成分P1-N1-P2是CAEP的重要组成部分,起源于听觉丘脑-皮质和皮质通路、初级听觉皮层和各种关联皮层[4]。P1被认为起源于初级听觉皮层,但P1也可能有来自海马体、颞平面、颞叶侧部和新皮层区域的成份,N1起源于额中央区和颞上回的听觉关联皮层等[5],P2似乎有多个位于多个听觉区域的起源,包括初级听觉皮层、次级听觉皮层和中脑网状激活系统等;据推测,P2的起源中心位于颞横回附近[6]。
儿童早期的CAEP波形主要表现为两个连续的正-负峰(P1和N2),P1-N1-P2复合为一个大的正波P1,P1和N2的潜伏期分别约为100 ms和200 ms(图1)。随着中枢听觉神经系统的成熟,P2和N1逐渐出现[7],在正常听力成人的头皮正中(Cz位点)记录到的P1-N1-P2由潜伏期大约为50 ms的正波P1,80~100 ms的负波N1以及180~200 ms的正波P2组成(图2)[8]。

图1 正常听力儿童P1-N1-P2-N2的波形
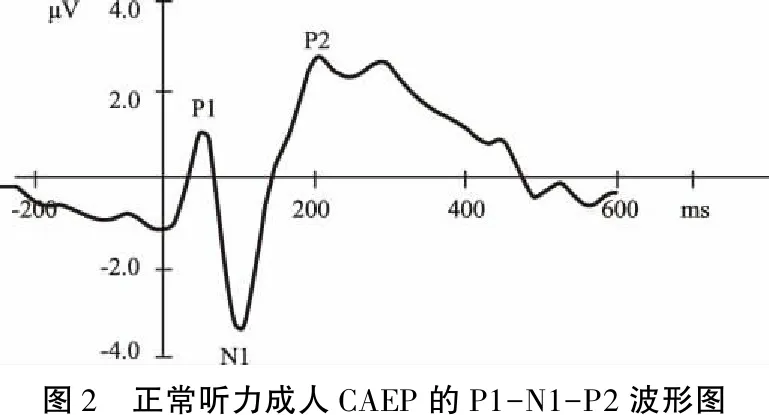
图2 正常听力成人CAEP的P1-N1-P2波形图
在正常听力的儿童中,CAEP的P1成分的潜伏期随年龄变化而变化[9]。已有多项研究表明随着年龄的增长,P1的潜伏期缩短,Sharma[10]和Ponton[11]等研究发现,儿童6岁时P1潜伏期约为85~87 ms,10岁时缩短为64~74 ms;成年时P1潜伏期约为50 ms,且P1的振幅随着年龄增长逐渐缩短。另一项研究也发现,随着年龄的增长,其波形有了改变,P1成分的潜伏期缩短,振幅有所下降,潜伏期每年缩短约1.6 ms[1]。因此,CAEP的P1成分可以用来推断婴儿和儿童的听觉通路的成熟状态[12]。
在婴幼儿时期,N1波与P1波相重合;随着年龄增长, N1开始出现并独立分化,潜伏期相对延长,而P1的潜伏期缩短、振幅减小[13]。在儿童中,在P1之后出现的潜伏期约为200 ms的宽大负波,称之为N1b;有些儿童(尤其是年龄较大的儿童)也会出现一个较早的负波N1a,N1b出现频率较高,而N1a的出现频率随着年龄的增长而增加。N1a和N1b的潜伏期均随年龄的增长而显著缩短,但振幅与年龄无关[10]。在年龄较大的儿童、青少年和成年人中,N1被视为一个独立的负向峰,但是如果CAEP的刺激速率相当缓慢,N1可以更早被引出[14]。P2最初在婴儿时期与P1融合,到2岁时接近成年人的潜伏期,随着年龄增加P2潜伏期延长,而振幅减小[5]。N2在10岁时的振幅和潜伏期表现出相对稳定,随后振幅逐渐减小,直到成年波形中看不到N2[15]。
通过分析主要由听觉皮层和相关丘脑区的电活动所产生CAEP的P1成分的波形和潜伏期的变化,可确定中枢听觉通路的发展程度和可塑性极限[16]。众所周知,中枢听觉神经系统的成熟依赖于内在和外在的因素,内在因素与个体的敏感性和学习能力有关,例如注意力和记忆的认知功能;另一方面,外在因素与个人在环境中的暴露有关[14]。上述内在因素和外在因素能够导致个体CAEP呈现不同的发展变化规律,从而导致复杂的P1-N1-P2-N2的每一个成分出现潜伏期的差异。随着听觉的刺激,在中枢听觉神经系统中出现了结构和功能上的改变,如:更多的神经元开始对声音刺激作出反应、树突分支的增加、神经元髓鞘化的增加、突触同步和连接的改善等[13]。这些解剖和生理变化导致了CAEP的波形和潜伏期变化,其波形变得更加明确,而振幅和潜伏期值都更低[17]。
2 CAEP的P1-N1-P2成分在听力障碍人群中的应用
2.1人工耳蜗植入术后效果评估 来自动物和人类实验的证据表明,在缺乏声刺激的情况下,中枢听觉通路不能正常发育。因此,听力受损的儿童如果没有通过助听设备获得足够的听觉刺激,就有可能导致中枢听觉通路发育异常,使言语和语言发展迟缓或异常[12]。CAEP是无创的脑电图测量,可以无创地确定特定患者听觉皮层的成熟状态[14]。Hossain等[9]的研究表明早期植入人工耳蜗(cochlear implants,CI)的儿童,在随访期间P1的振幅迅速增加,且伴随着潜伏期的降低,CAEP波形形态的显著变化也值得注意;所以可以通过分析P1成分的波形和潜伏期的变化,客观地测量中枢听觉系统的发展程度和可塑性[1]。Gilley等[4]通过测试发现与正常听力儿童相比,CI儿童的CAEP的P1成分的潜伏期较长;进一步的分析显示,P1的潜伏期似乎会在植入后的几年时间内持续发展。此外,Silva等[16]研究表明在人工耳蜗植入术后3个月及9个月,引出的CAEP的P1潜伏期缩短,但仍然明显比正常听力儿童的潜伏期长,P1成分潜伏期的缩短与听觉能力的提高成正相关,说明CI给予的听觉刺激促进了听觉通路的成熟以及听觉言语能力的发展,故P1成分是康复过程中听觉发育的重要生物标志物。
根据Dorman等[18]的研究,P1的潜伏期和波形变化取决于中枢听觉神经系统有没有接受足够的听觉输入。大约在出生后的3.5年内,中枢听觉系统仍然有很高的可塑性,之后,可塑性以指数形式降低,直到8岁及以后可以忽略不计。所以在3.5岁之前植入人工耳蜗,可在敏感期的早期阶段最有效地增强神经系统的可塑性[14]。一般来说,如果儿童在植入人工耳蜗前经历了少于3.5年的听觉剥夺,P1的潜伏期会在人工耳蜗植入3~6个月后进入正常范围;然而,经历了7年以上听觉剥夺的儿童,即使接受多年的声刺激后,通常也不会恢复正常的P1潜伏期,同时,这些患者的CAEP波形可能存在明显异常[18]。可见,CAEP客观地证明了植入CI刺激听觉皮层的关键年龄[9],且是非常重要的评估CI患者康复效果的方法之一,可以提供关于中枢听觉系统成熟和发展的信息[1]。
如果在中枢听觉系统发育的敏感时期,听觉感官输入被剥夺,那么中枢听觉系统就会受到大规模重组的影响[9],可能发生突触可塑性的显著变化,导致神经元连接异常、功能分化、听觉皮层区域的不成熟以及某些区域听觉功能的发展异常[1]。通过CI早期恢复听觉的输入,可以提供必要的声刺激从而保护听觉传导通路。然而,如果在正常发育时期之后,听觉输入没有恢复,那么跨模态重组的通路可能会表现出异常的功能特征,如:P1的振幅、潜伏期和CAEP的波形改变[9]。通过视觉和躯体感觉的方式对听觉皮层区域进行跨模态的重新定位是另一种可能影响听障儿童行为结果的重组形式,跨模态可塑性是指一种感觉模态的剥夺(如听力丧失时的听觉模态)导致被剥夺模态的皮质资源被完整的感觉模态(如视觉或躯体感觉系统)所重组的现象,以增加完整的感觉模态的处理能力作为感官剥夺的补偿[19]。越来越多的证据表明,视觉和躯体感觉系统都参与了高级听觉皮层在耳聋方面的跨模态重组,未来的研究需要确定跨模态可塑性在多大程度上可用于针对植入人工耳蜗儿童的临床效果评估结果制定个性化康复计划[14]。
2.2评估听神经病患者的听阈及言语感知能力 听神经病(auditory neuropathy,AN) 是具有独特临床表现的疾病,其特征是外毛细胞功能正常而传入神经的传导是无序的,其听性脑干反应(auditory brainstem response,ABR)缺失或严重异常,而耳声发射(otoacoustic emissions,OAE)和/或耳蜗微音电位(cochlear microphonics,CM)正常[20]。由于听神经病患者的言语识别率与其纯音听阈不成比例,所以不能单纯依靠其行为听力阈值来评估听神经病患者的听觉功能和言语感知能力。尽管记录不到ABR,但CAEP可以在大部分AN患者中被记录到。He等[21]的研究结果确定了使用CAEP测试AN儿童听阈的可行性,一般来说,CAEP和行为听力阈值在500到2 000 Hz之间差5到10 dB,250和4 000 Hz的差异更大,在250 Hz处,CAEP阈值比行为听力阈值高20~25 dB,在4 000 Hz处差异是10~15 dB。
在患有先天性AN的儿童中,感觉剥夺可能会改变中枢听觉系统结构的成熟过程。感觉剥夺时间越长,P1成分潜伏期越长[22]。Sharma等[23]研究发现,三分之一配戴了助听器的AN受试者的P1波潜伏期延长,这表明中枢听觉系统是低反应性,而这一特性与受损的言语感知有关。Rance等[20]研究发现CAEP的 P1成分与言语感知能力相关。CAEP大约在50%配戴助听器的患儿中被记录到,并且引出CAEP反应的患儿比没有引出CAEP反应的患儿有更好的言语感知能力。言语感知高度依赖于神经元同步化,特别是对细微的时间线索的辨别,听觉系统似乎将时间信息以及一些频率信息编码为精准定时的神经元同步化放电。CAEP可以提供关于听觉皮层的神经元同步化的额外信息,故其可以评估患者的言语感知能力并借此反映神经元同步化的情况。由于传入神经的受损或功能障碍会导致同步化中断以致知觉异常,若此时CAEP依旧能引出,说明有足够的残余的神经元同步化来编码言语感知所需的一些时间信息。因此,对于AN患儿,P1成分可以作为评估听阈及言语感知能力的一种测试方法[22]。
2.3诊断中枢听觉处理障碍患者 美国言语听力学会( American Speech and Hearing association,ASHA) 对中枢听觉处理障碍( central auditory processing disorder,CAPD) 的定义是: 中枢神经系统对于听觉信息的感知过程存在困难,表现为声音的定位和优势偏向、听觉的辨别、听觉模式识别、听觉的时间处理及竞争信号下的听觉能力(如双耳分听)等一项或多项能力表现不佳(https://www.asha.org/policy/tr2005-00043/)。其主要通过中枢听觉测试来诊断,包括听觉辨别测试、听觉时间处理和模式测试、双耳分听语音测试、单耳低冗余度语音测试、双耳相互作用试验、耳声发射、声反射阈测试、电生理学测量等,需要通过多项测试结果综合诊断。一般来说,中枢听觉处理是通过一些行为测试进行临床评估的,但认知能力对CAPD测试结果有显著影响,故在行为测试不可行的情况下使用电生理学测量方法可在一定程度上降低认知能力对测试结果的影响[24]。Jirsa等[25]研究发现CAPD患儿较同龄正常听力儿童CAEP的N1和P2的潜伏期延长;Liasis等[26]也发现类似结果,CAPD患儿N1的潜伏期显著延长,P2-N2波的振幅值更大,而N1-P2波的振幅值减小。Koravand等[24]的研究结果表明患有CAPD的儿童与未患该病的儿童相比,在非语言和语言刺激下引出的N2成分潜伏期延长及振幅降低显著,提示N2反应可能是CAPD患儿神经功能缺陷的一个标志;故CAEP的N1-P2及N2波潜伏期及振幅的改变可作为诊断CAPD患者的一种有效方法。
3 影响CAEP结果的因素
3.1受试者的意识状态 受试者的唤醒水平、警觉性和注意力都会影响CAEP的潜伏期、振幅或变异性。一般情况下,当受试者被要求阅读一本书或接受刺激(例如,计算刺激)而不是简单地睁着眼睛坐着时,会记录到一个更大或更稳定的反应[5]。因此,在记录过程中,通常需要让受试者观看没有声音的视频以保持清醒和警觉状态。
3.2信噪比 信噪比(signal to noise ratio,SNR)的不同会导致CAEP各波的潜伏期和振幅的改变。Small等[27]发现信噪比对婴儿和成人由语音刺激引出的CAEP影响取决于刺激声类型,当噪声是白噪声、刺激声是音节/m/和/t/时会受到影响;对于婴儿和成人,增加白噪声的强度,即SNR降低时,由/m/引出的CAEP波形比/t/引出的振幅更小和潜伏期更长。此外,还发现随着SNR的降低,由/m/和/t/引出的P2波潜伏期延长,但P1和N1波的潜伏期及P2波的振幅没有显著变化。Maamor等[28]选择刺激声为音节/ba/和/da/、SNR为-3、3、9 dB测试时也发现了类似结果。当引入噪声时,CAEP各波潜伏期延长、振幅减小;且信噪比在不同的噪声类型之间的影响并不一致,在连续噪声条件下,最大的信噪比效应表现为振幅的系统性降低和潜伏期的延长。
3.3电极位点 Small等[27]研究发现婴儿和8~12岁左右儿童的CAEP反应具有电极优势位点,而成人没有。Small等[29]的研究结果表明,大多数婴儿在C3位点振幅最大,其余的婴儿在Cz位点反应较大,所以电极位点的选择可能会影响婴儿的反应(C3>Cz>C4),但对成人没有影响;该作者之前在其实验室中已经注意到这一轻微的C3优势,但是应该注意到在C3位点,由语音和非语音刺激引出的反应在研究中是不一致的[27]。Koravand等[24]发现在9~12的儿童中,在Fz位点引出的P1振幅最大,此外,电极位点对P1的潜伏期有显著影响。Sussman等[15]报道在8~11岁的儿童组中,P1的振幅沿中线减小(Fz>Cz>Pz);而16岁组儿童和成人相似,P1的振幅在Fz和Cz位点没有显著不同,且Fz位点引出的CAEP波形可以看到N1成份的发展和出现。
3.4刺激间隔时间 刺激间隔时间(inter-stimulus interval,ISI)对CAEP的波形、振幅和头皮分布具有较大的影响。当ISI非常短时,N1的振幅通常会减小到无法轻易检测到,当ISI为1~4 s时,头皮分布的N1变化相对均匀;当ISI延长到至少10 s时,N1和P2的振幅增加;当ISI为8~16 s时,在Cz位点有一个清晰的最大值;且ISI与大多数其他刺激会相互作用以致影响CAEP的大部分参数[30],Gilley等[4]报道称随着ISI的延长,N1和P2引出率会增加,且随着ISI从2 000 ms缩短到360 ms时,N1-P2的峰间振幅值明显减小。此外,Sussman等[15]发现年龄和ISI对CAEP波形及P1、N1、P2等波的振幅和潜伏期有相互作用。
3.5大脑半球 Wunderlich等[31]研究发现,对婴幼儿给予音调和言语声刺激,大脑半球皮质反应是均匀分布的,但在4~6岁儿童的左半球皮质反应则更大。此外,对于颞叶引出CAEP的Na、Ta和Tb波分析,Pang等[32]发现3~12岁儿童由语音刺激引出的Na波振幅右侧大于左侧,而年龄较大的儿童结果相反;Shafer等[33]也发现,与左侧相比,右侧的Ta波振幅更大。
3.6刺激声强度和频率 Stuffebeam等[34]认为刺激声强度降低会导致CAEP各波的振幅减小、潜伏期延长。这些变化在较低的刺激声强度水平(20 dB SL内)最显著,特别是在阈值附近。响应幅度随着刺激强度增加而增加,但响应幅度在刺激声强度为阈上水平时(高于50~60 dB HL)甚至可能下降,而随着频率的增加,N1和P2波的振幅减小、潜伏期缩短[30]。李玉玲等[35]发现当刺激声强度一定时,刺激声频率对CAEP的N1、P2波特性有显著影响,低频刺激声/m/诱发的N1波振幅更大、N1波和P2波的潜伏期更长;当刺激声频率一定时,刺激声强度对P1-N1-P2各波潜伏期和幅值特性均无显著影响,这可能是因为其选择的刺激声强度为阈上水平有关。
3.7听觉经验 听觉经验也会对CAEP产生很大的影响。正常听力成人对某一声信号经训练后,其N1-P2峰间振幅值增大[8]。Tremblay等[36]对数名听力正常的年轻人进行音节/ba/的两个合成语音变体(浊音起始时间分别为-20 ms或-10 ms)的分辨训练后,当受试者学会正确识别两种刺激时,能观察到CAEP的P1、N1和P2的振幅变化,并且P1和N1振幅的显著变化记录在右半球而不是左半球,相反,P2振幅的增加在两侧半球都能观察到。
4 总结与展望
CAEP是探索大脑功能的重要电生理手段,由于它是一种自发的客观听觉生理反应,不依赖于个体的行为反应和主观配合,故可成为客观评价听力障碍或认知障碍儿童听觉能力发展的有效手段。CAEP可应用于评估听阈、人工耳蜗术前听觉通路的成熟程度、助听器佩戴效果及人工耳蜗植入效果等,尤其是在客观评估听神经病患者的听阈及言语感知能力方面意义重大。此外,CAEP的其他成分如P300、MMN等,可应用于评估言语感知能力和中枢听觉辨别能力、评价中枢系统发育状态、诊断听神经病及中枢听觉处理障碍等。随着电生理技术的不断发展和完善,CAEP作为一种有效的、可靠的客观听力检查方法,具有广泛的临床应用前景。
