固定化混合菌修复冻融土壤PAHs污染的研究
2019-10-23王天杰
普 聿,苏 丹*,王 鑫,王天杰,刘 伟
(1.辽宁大学环境学院,沈阳 110036;2.沈阳大学区域污染环境生态修复教育部重点实验室,沈阳 110044)
多环芳烃(PAHs)是一类具有复杂苯环结构的高积累有毒化合物,是土壤中难降解的有机污染物。在我国,土壤的PAHs污染处于中低水平,PAHs的生物聚集、难降解性导致其长时间积留在土壤的表层与亚表层中,土壤PAHs污染将是一个潜在的环境隐患。
固定化微生物技术是目前修复土壤PAHs污染的常用技术,该技术解决了微生物易受环境、温度影响以及生物有效性低等问题,很大程度上提高了反应的修复效果。目前土壤的PAHs污染修复主要基于常温条件下的微生物修复,在秋冬长期的冻融环境下,低温抑制了微生物的生长代谢,造成修复效果差[1]。已有大量研究表明嗜冷菌[2]和耐冷菌[3]均对冻融环境有较高的抗性,但在原位土壤修复中如何应用这类菌株尚缺乏相关研究。Juhasza等[4]研究表明,高环PAHs的降解主要以共代谢的方式,真菌分泌的酶类物质可分解高环PAHs的苯环,开环过程所产生的有毒中间物质通常需要细菌的联合作用才能将其矿化成水和CO2,真菌-细菌的联合作用极大提高了PAHs降解的差异性。微生物降解过程中群落的多样性与污染修复效率密切相关,能更清楚地揭示降解的机制,由于传统的分子指纹图谱通常一次分析低于100条微生物序列,对土壤中复杂的微生物分析性准确度覆盖率低[5]。高通量测序技术能一次对几百万条DNA分子进行测序分析,因而能更精准地分析土壤中复杂微生物的群落变化。
本研究通过构建玉米芯-耐低温真菌-细菌共生体系,分析其在低温环境下对PAHs污染土壤的生物强化修复效果;通过拟合PAHs的浓度变化,构建动力学方程,分析降解过程中微生物群落结构变化与污染物浓度变化的相关关系,从PAHs降解动力学与微生物多样性角度揭示玉米芯-真菌-细菌共生体系对冻融环境的抗性机制,为寒冷地区的PAHs污染土壤修复提供理论基础,同时也为普及和推广耐冷微生物修复环境污染提供一个全新的视角和方向。
1 材料与方法
1.1 供试材料
冻融土壤:2017年12月16日采自前北京焦化厂的表层冻融土(0~20 cm),其基本理化性质:pH 8.36,总氮0.251%,总碳12.36%。
载体玉米芯购自中国科学院沈阳应用生态研究所,乙腈为色谱纯(Sigma-Aldrich公司),正己烷和二氯甲烷均为分析纯(山东禹王实业总公司),硅胶60~100 mm(国药集团有限公司)。
菌株:混合菌由本研究室前期分离筛选,经菌株鉴定分别为假单胞菌(Pseudomonas sp.SDR4)和高山被孢霉菌(Mortierella alpina.JDR7)。
固定化增殖培养基(1.0 mL·g-1):蔗糖4 g、酵母膏 0.3 g、KH2PO40.05 g、(NH4)HPO40.2 g、MgSO4·H2O 0.025 g。
1.2 试验方法
1.2.1 固定化玉米芯混合菌的制备
将碾碎的玉米芯颗粒(1.0~1.5 cm)置于烘箱中120℃烘干,加入1.0%的生石灰溶液浸泡24 h,和麦麸(20%)混匀,控制含水率为47%,将pH调节为7.1,摇床振荡 24 h(110 r·min-1),离心 15 min(3000 r·min-1)后弃上清液,烘干后过筛,在高压蒸汽灭菌器(MLS-3780)121℃灭菌60 min。将假单胞菌和高山被孢霉菌至于完全培养基中,15℃、110 r·min-1摇床培养30~40 h,制得假单胞菌细菌密度为:6×108cfu·g-1、高山被孢霉菌孢子悬浊液密度为:6×108cfu·g-1。将假单胞菌与高山被孢霉菌接种于完全培养基中,15 ℃、110 r·min-1摇床混合培养3 d,制备复合菌剂(按体积比,假单胞菌∶高山被孢霉菌=1∶1)。用增殖培养基浸润灭菌后的玉米芯颗粒12 h,按10%量接种复合菌剂,放置于低温光照培养箱(GZH-0328)在15℃温度下适量的补充增殖培养基,避光培养7 d制得玉米芯固定化混合菌颗粒[6]。
1.2.2降解试验
模拟冬季土壤的冻融循环试验,将土样分装于培养瓶中,每瓶5 g,放置在XT5405型高低温冻融循环试验箱避光低温培养:在-10℃冻结2 d,10℃解冻2 d(降解总周期60 d,共冻融循环15次),试验设3组对照:(1)按土壤质量的10%接种固定化混合菌,游离菌为对照,表征游离菌与固定化菌PAHs的降解效果差异;(2)灭菌土壤投加空白载体,表征因载体吸附导致的非生物性的污染物降解;(3)未灭菌土壤,表征土著菌的降解效果,及投加混合菌后是否会产生竞争影响;(4)未灭菌土壤投加空白载体,表征固定化土著菌与固定化混合菌的降解效果差异。随时补加无菌水保证土壤含水率为30%。分别在0、15、30、45、60 d时测定土壤中Phe、BbF的残留量,计算各处理组的去除率(η)。
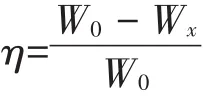
式中:W为初始土壤残余PAHs含量,g;Wx为土壤中残余PAHs含量,g。
每种处理设置3个平行,重复2次。实验分组如下:
CK为未灭菌土样(CK);CK1为灭菌土壤;CK2为灭菌土样+灭菌玉米芯载体;H为未灭菌土样+游离混合菌;MC-S4J7为未灭菌土样+玉米芯固定化混合菌颗粒;MC-CK为未灭菌土样+灭菌玉米芯载体。
1.2.3 土壤PAHs含量的提取和检测
土壤中PAHs含量采用超声提取HPLC法测定[7]。取土样过筛加入15 mL二氯甲烷超声2 h,滤膜过滤后加入10 mL二氯甲烷再次超声1 h,经硅胶柱净化处理,氮气吹干后1 mL乙腈定容,高效液相色谱仪(Agilent 1100型)测定,PAHs分析专用柱ZORBAX EclipsePAH,柱温(25±0.1)℃,流动相乙腈∶水=60%∶40%,流速 1.100 mL·min-1,进样量为 10 μL,各种PAHs以色谱峰保留时间定性,外标法定量,方法回收率为82.16%~91.43%。
1.2.4 微生物多样性
对原土样(CK)和投加玉米芯固定化混合菌(MC-S4J7)修复30 d后的土样进行高通量测序分析。主要分析步骤如下:根据OMEGA E.Z.N.ATMMagBind SoilDNA Kit试剂盒提取土壤样品的总DNA,利用Qubit 3.0 DNA检测试剂盒对基因组DNA精确定量[8]。第一轮PCR扩增:细菌(16S rDNA)已融合了Miseq测序平台的V3-V4通用引物,341F引物为:5’-CCTACGGGNGGCWGCAG-3’,805R引物为:5’-GACTACHVGGGTATCTAATCC-3’,真菌(ITS)已融合了Miseq测序平台的ITS1-ITS2通用引物,ITS1F引物为:5’-CTTGGTCATTTAGAGGAAGTAA-3’,ITS2R引物为:5’-GCTGCGTTCTTCATCGATGC-3’。引入Illumina桥式PCR兼容引物后,进行第二轮扩增[9]。利用Prinseq软件对高通量测序结果进行质量控制,将所测序列与RDP数据库进行序列比对,使用Mothur软件归类同种可操作分类单元(OTU),计算多样性指数,对测序结果进行物种分类分析和菌种差异分析。数据分析、接头、引物序列等去噪及OTU、Alpha和Beta多样性等相关分析均由上海生工有限公司完成,各指数计算方法如下:
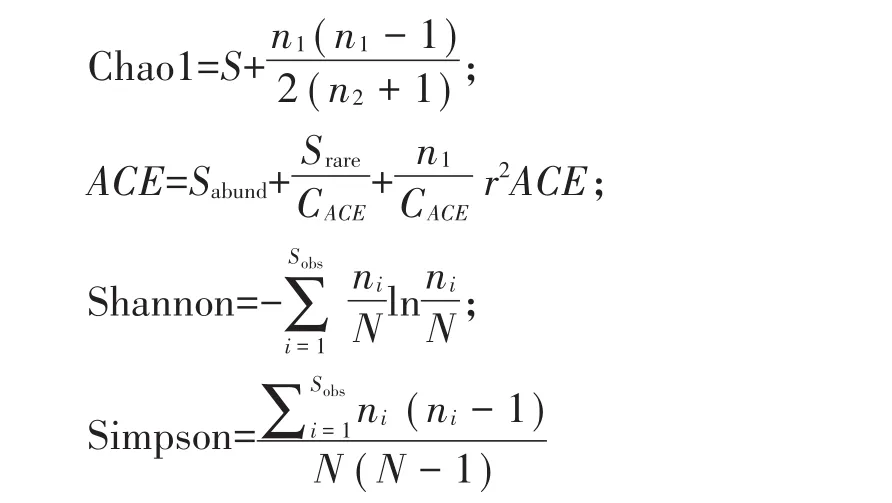
式中:Sobs为实际OTU;n1为只含1条OTU;n2为只含2条OTU;ni为第i个OTU包含序列数;N为总OTU数。
1.2.5 数据处理
使用SPSS 19.0软件对实验数据进行单因素方差分析,P<0.05表示差异显著。
2 结果与讨论
2.1 土壤PAHs含量
土壤中PAHs含量见表1。
由表1可知,土壤的PAHs总量为(247.1±18.14)mg·kg-1,土壤中以三环和四环PAHs为主,其中菲Phe(3环)占总量的40.2%,含量最高,高环PAHs中含量最高的是BbF,为(6.12±1.1)mg·kg-1。本试验主要研究两种含量较高且具有代表性的Phe、BbF的降解。

表1 焦化厂土壤中PAHs浓度Table 1 PAHs concentrations in coking plant soil
2.2 PAHs的非生物损失
Phe和BaP在土壤中不易挥发,较难降解,在低温冻融环境下培养60 d后,仅添加空白载体CK2与灭菌土壤CK1相比,对Phe和BbF去除差异不大,分别为0~4% 和 0~3%。在 CK1中仍有(89.76±1.49)%和(94.71±0.99)%的Phe和BaP,表征挥发损失和载体吸附所造成的污染物非生物损失很小。
2.3 PAHs的生物修复
通过土壤中PAHs含量变化来反映修复效果,修复结果见图1。
由图1知,60 d后3种处理组降解率分别为:MCH>H>MC-CK>CK。MC-S4J7的投加对冻融交替作用下的土壤修复效果显著(P<0.05),可分别降解(56.62±3.21)%和(38.21±1.82)%的Phe和BbF。玉米芯作为载体对微生物及酶都有很强的亲和力,将混合菌吸附固定后,载体本身构建的限定空间为菌体创造了缓冲的微环境,隔断了菌体与恶劣土壤环境的直接接触[10];很大程度上降低了土著菌或噬菌体的恶性竞争和侵害[11],同时玉米芯的孔隙结构会吸附、富集土壤中分布不均的PAHs,成为土著菌驯化的场所[12];菌体分泌的胞外酶也会被固定,提高了有效降解菌的活性和单位细胞密度;玉米芯腐殖化过程中产生的各种溶解性有机质可以促进高环PAHs的共代谢作用[13],因而提高了混合菌对Phe、BbF的降解作用。
处理组中Phe的降解率普遍高于BbF,这是因为微生物降解主要是利用水溶中的PAHs,BbF的苯环数多,其正辛醇-水分配系数Kow值较大[14],不易溶解,更易吸附在土壤有机质中,导致固相向液相的迁移率低[15],不易被菌株所利用,造成BbF的降解率低于Phe。
焦化土壤中存在的土著微生物对Phe和BbF有一定的降解作用,但由于温度过低、有毒微生物的恶性竞争及PAHs分布不均等问题,造成土著菌的降解酶活性低下,因此CK和MC-CK处理组的修复效果不显著。
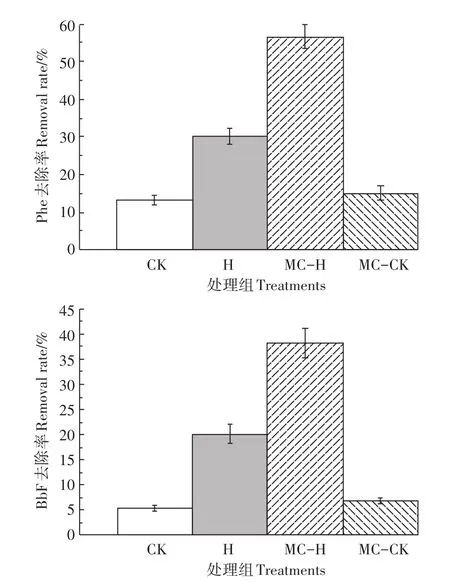
图1 混合菌对土壤中Phe和BbF的降解率Figure 1 Degradation rates of Phe and BbF by immobilized strains in 60 days
游离混合菌的投加,在一定程度提高了土壤中Phe、BbF的去除率,但修复效果并不理想。研究指出大部分常温微生物的最适生长温度在30℃以上[16],在低温环境下很难保持活性甚至处于休眠状态,假单胞菌(Pseudomonas sp.SDR4)和高山被孢霉菌(Mortierella alpina.JDR7)均为高效的耐冷菌株,耐冷菌株的细胞膜中含有较高的短链脂肪酸[17],可以提高细胞内外物质交换,此外分泌的同工酶也可以调节温度的变化[18],从而保持高的代谢活性,因此在0~5℃低温下仍可生长繁殖[19]。
2.4 PAHs降解速率及动力学
2.4.1 PAHs降解速率
微生物通过分泌酶类物质来降解PAHs,发生的酶促反应符合Michaelis-Menton动力学方程[20],根据动力学方程可计算出混合菌对Phe和BbF降解达到稳定前期和稳定期各个时段的降解速率v,见表2。
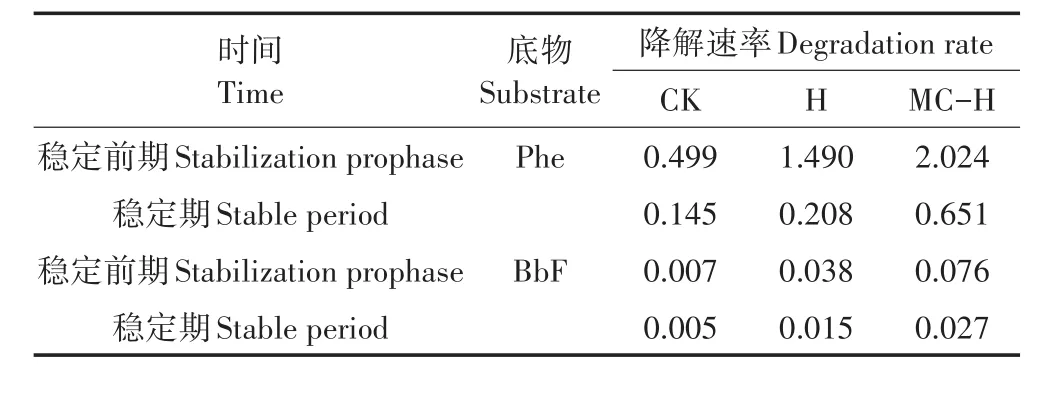
表2 混合菌对冻融土壤中Phe和BbF的降解速率(d-1)Table 2 Degradation rate per day of PAHs during specific presteady and quasi-staedy-steady by strains(d-1)
混合菌对土壤中的Phe和BbF降解速率在不同阶段的动态变化见图2。
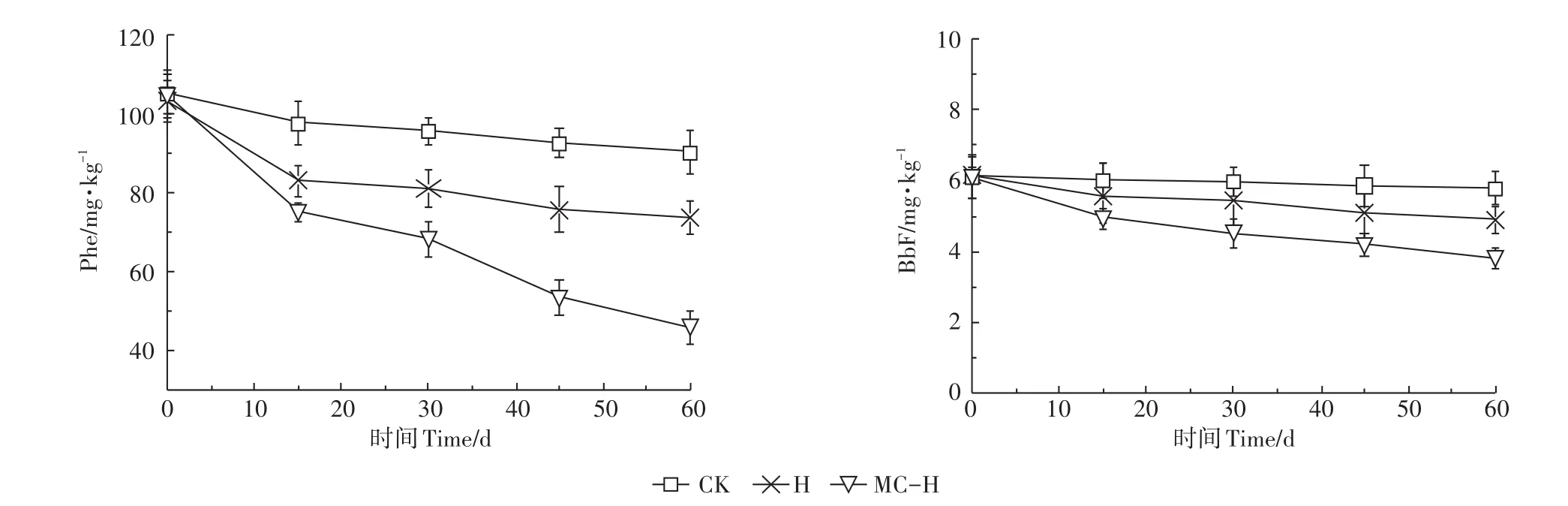
图2 混合菌对土壤中Phe和BbF的降解动态变化Figure 2 Dynamics of Phe and BbF in soils degrated by strains
由图2可知,3种处理方式下的土壤均呈现出一致的降解规律,0~15 d为降解的高速阶段,15~60 d降解进入缓慢阶段,趋于平缓。由Michaelis-Menton方程可知当反应到达稳定期时,降解速率与PAHs的浓度呈正相关。分析原因如下:降解试验的阶段性时期的降解机制不同,稳定前期(0~15 d)Phe和BbF的初始浓度较高,由物理、化学及生物3种降解机制共同作用,降解速率快,随着反应的进行,污染物浓度降低,生物降解成为主导作用,但生物降解的强度会随着降解周期的延长而减弱,导致速率下降;PAHs降解中产生的中间产物,其结构上含有一定的羧基、环氧等亲水基团,代谢的中间产物会被微生物降解、同化吸收,同时中间产物易与土壤共价结合,造成与未降解的PAHs产生竞争关系,降低PAHs的可提取态含量与生物可利用性,导致降解速率降低[21];土壤的纳米孔隙会吸附污染物,PAHs在孔隙中难被利用,易与降解菌产生隔断,导致降解速率降低[22]。
由表2知,H处理组在稳定前期和稳定期对Phe、BbF 降解速率分别为 1.490、0.208 d-1和 0.038、0.015 d-1,MC-H处理组降解速率明显高于H处理组,降解速率分别为2.024、0.651 d-1和0.076、0.027 d-1,固定化处理后的混合菌,对PAHs降解速率明显得到提高。
2.4.2 PAHs降解速率及动力学
建立Monod模型,得到动力学方程:
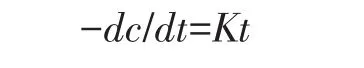
式中:c为PAHs浓度,mg·kg-1;t为反应时间,d;k为动力学常数。Phe和BbF降解符合一级动力学特征,结果见表3。
由表3可知,CK中Phe、BbF的半衰期分别为272.51、736.71 d,土壤中土著菌在低温下几乎不能生长代谢,原土壤中对高环BbF的降解菌过少,从而导致半衰期过长。经固定化处理的混合菌缩短了冻融土壤中Phe、BbF降解的半衰期,分别缩短至50.167、82.12 d。巩宗强等[23]研究指出一般降解微生物对Phe的自然降解半衰期为20 d,由于低温冻融环境与微生物的代谢呈负相关,且冻融作用会造成土壤的有机碳增加,从而使PAHs易与土壤有机碳结合,极大降低了PAHs的降解速率,延长降解半衰期[23]。
2.5 Alpha多样性分析
Alpha多样性分析指标是生态系统的群落多样性综合性指标[24],Ace和Chao 1指数越高,土壤群落丰富度越高,Shannon指数越大、Simpson指数越小则土壤群落多样性越高[25]。

表3 动力学方程Table 3 Dynamics equations
CK和MC-S4J7样品中分别共获得优质ITS序列、优质16S序列分别为109 728、160 298条,在97%相似性基础上ITS和16S可划分OTU分别为1207个和7105个。测序的覆盖率指数为0.99和0.96,说明本次测序可行性较高,覆盖了焦化土壤中所有的真菌细菌类群。土样Alpha多样性指数结果见表4。
由表4可知,MC-S4J7与CK的Alpha多样性指数存在明显差异,细菌群落丰富度和群落的均匀度降低,真菌的群落丰富度和群落均匀度提高;细菌的丰富度指数和Shannon指数为真菌的2~3倍,表征了焦化厂土壤土著微生物中以细菌为主。
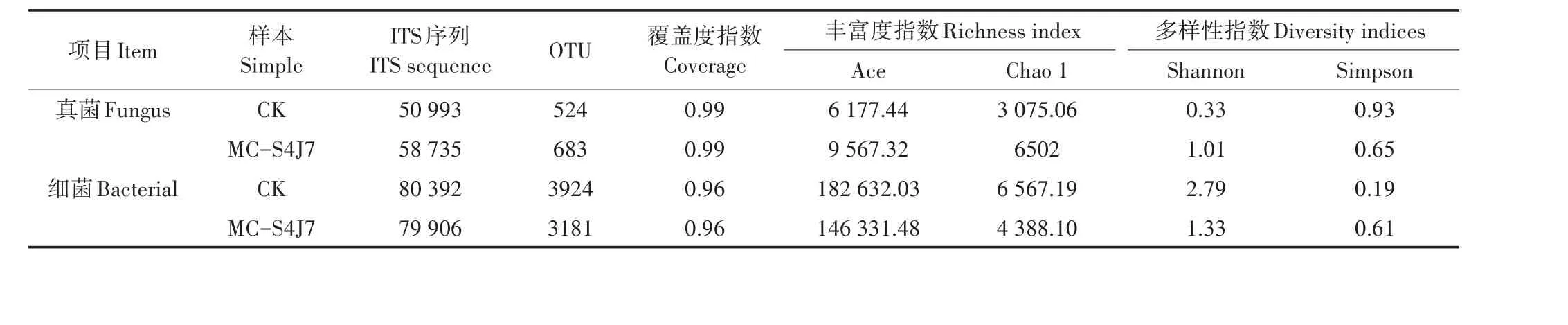
表4 焦化厂土壤Alpha多样性指数Table 4 Diversity index of soil Alpha in coking plant
分析原因如下:微生物对PAHs的降解主要通过降解和共代谢,焦化厂PAHs污染土壤中PAHs以三环和四环为主(约占90%,其中Phe含量最高),土壤中的土著微生物中以降解Phe的细菌居多。土样中投加的玉米芯含有大量的纤维素,真菌是纤维素、木质素等降解过程的主角,玉米芯的投加是处理后土样真菌群落多样性提高的主要原因。De Boer等[26]研究发现,土壤中的细菌诱发产生的抗生素会对真菌有一定抑制作用,高群落丰富度、均匀度的细菌会抑制真菌的生长代谢。土样修复30 d时,处于PAHs降解的稳定期,PAHs降解速率趋于稳定,此时土壤中存在大量的高效降解菌并成为优势菌株,造成细菌群落的丰富度和多样性指数降低,细菌的群落多样性降低极大减弱了对真菌的抑制作用,也一定程度上提高了真菌的群落多样性。
2.6 土壤微生物群落结构变化
2.6.1 门水平群落结构组成分析
分别对土样的细菌和真菌前20和前11个优势菌门进行分析,门水平下土壤细菌和真菌的群落结构相对丰度如图3、图4所示。
由图3可知,投加固定化混合菌生物强化修复30 d后,土壤细菌的优势菌门发生了明显的变化。土壤初期以放线菌门(Actinobacteria)为主,丰富度为86.71%,变形杆菌门(Proteobacteria)次之,丰富度为11.43%,还存在少量的硬壁菌门(Firmicutes),丰富度为0.68%。生物强化修复后变形杆菌门、硬壁菌门的丰富度均上升,变形杆菌门成为新的优势菌门,丰富度为88.72%。
由图4可知,投加固定化混合菌生物强化修复30 d后,土壤真菌优势菌门发生了明显的变化,土壤中门水平下群落结构发生了明显的改变,土壤中真菌群落明显增多。土壤初期以子囊菌门(Ascomycota)为主,丰富度为99.35%。生物强化修复后,鞭毛菌门(Mortierellomycota)成为新的优势菌门,丰富度为81.15%,子囊菌门(Ascomycota)丰富度降低至18.72%。
2.6.2 属水平的群落结构组成分析
属水平下土壤的细菌(前33优势菌属)和真菌(前20优势菌属)属水平下群落相对丰度如图5、图6所示。
由图5可知,修复前,土壤中细菌相对丰度大于0.5%的优势菌属有10个,分别是放线菌属(Actinoalloteichus)、假单胞菌属(Pseudomonas)、乔治菌属(Georgenia)、鞘脂菌属(Sphingobium)、斯克曼菌属(Skermanella)、双球菌属(Geminicoccus)、赤杆菌属(Novosphingobium)、分枝杆菌属(Mycobacterium)、短波单胞菌属(Brevundimonas)和诺卡氏菌属(Nocardioides),其丰富度分别为66.11%、6.26%、5.01%、2%、1.51%、0.92%、0.78%、0.62%、0.55%和0.54%。
投加固定化混合菌生物强化修复30 d后,细菌的菌属多样性降低,土壤中相对丰度大于0.34%菌属的种类下降至9个。土壤中细菌假单胞菌属(Pseudomonas)的相对丰度由6.26%上升至80.03%成为新的优势属,其他丰度较高的菌属为:代尔夫特菌属(Delftia),丰度为7.53%;芽孢杆菌属(Bacillus),丰度为4.91%;乔治菌属(Georgenia),丰度为0.02%。
由图6可知,修复前,真菌主要由曲霉属(Aspergillus)、镰刀菌属(Fusarium)构成,其丰度分别为97.98%、0.31%。
投加固定化混合菌生物强化修复30 d后,真菌的菌属多样性略有增加。真菌被孢霉属(Mortierella)成为显著的优势菌属,丰度上升至81.15%,地丝霉属(Geomyces)次之,丰度为7.46%,曲霉属(Aspergillus)丰度降低至6.72%,镰刀菌属(Fusarium)丰度提高至1.22%。
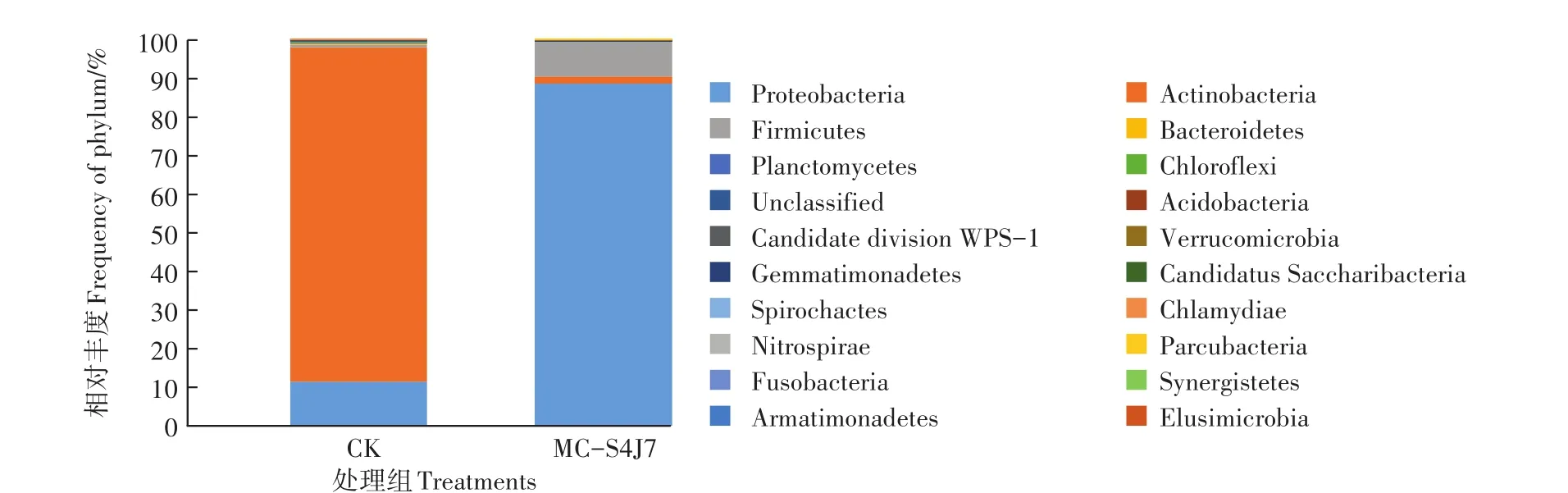
图3 土壤细菌门水平相对丰度Figure 3 Relative abundance of the dominant phyla in different treatments(Bacteria)
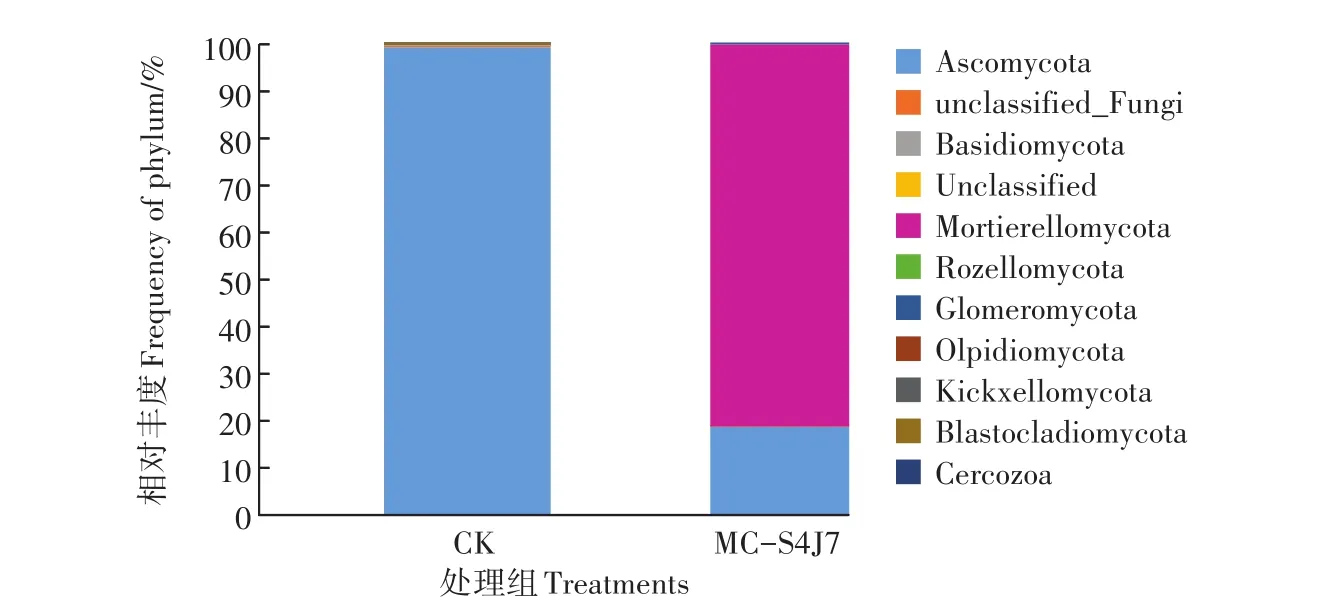
图4 土壤真菌门水平相对丰度Figure 4 Relative abundance of the dominant phyla in different treatments(Fungi)
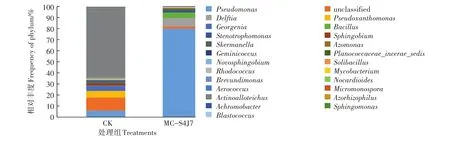
图5 土壤细菌属水平相对丰度Figure 5 Relative abundance of the dominant genera in different treatments(Bacteria)
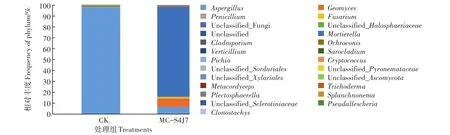
图6 土壤真菌属水平相对丰度Figure 6 Relative abundance of the dominant genera in different treatments(Fungi)
生物强化修复土壤中,固定化混合菌的投加对微生物群落结构造成了明显变化,显著降低了细菌的群落多样性和均匀度。Tian等[27]指出,土壤中微生物群落多样性变化是暂时的,到降解的末期时,土壤中PAHs浓度大幅度下降,降解速率逐渐缓慢,优势菌种的丰度会开始下降,直至与土壤中其他微生物达到一个平衡的状态,微生物的群落结构也会恢复到初期的稳定状态。玉米芯富集了土壤中分布不均的PAHs,同时为菌株提供了适宜的生存环境,保证菌株高效的存活率,土壤中的假单胞菌属(Pseudomonas)与被孢霉菌属(Mortierella)在降解过程中丰度均大于80%,结合降解反应的动力学方程,在稳定期的降解中假单胞菌属(Pseudomonas)、被孢霉属(Mortierella)的生长代谢是PAHs降解的主要原因,投加混合菌后,假单胞菌(Pseudomonas.sp SDR4)、高山被孢霉菌(Mortierella alpina.JDR7)的高丰度,即形成的真菌-细菌高效共生降解体系是PAHs降解率提高的主要原因。
3 结论
(1)玉米固定化真菌-细菌共生体系的构建对低温冻融环境有较好的抗性,显著提高了PAHs的降解率,60 d后,可分别降解(56.62±3.21)%和(38.21±1.82)%的Phe和BbF。
(2)Michaelis-Menton动力学方程分析显示,玉米芯固定化技术显著提升了PAHs降解启动速率,稳定前期对Phe和BbF降解速率可分别达到2.02 d-1和0.076 d-1,约为游离菌降解速率的2倍。
(3)一级反应动力学模型分析得出,固定化混合菌可将低温下Phe和BbF降解半衰期缩短至50.17 d和80.12 d,约为游离菌降解半衰期的0.41倍,Monod更清晰地分析了混合菌对低温土壤PAHs降解的动力学过程。
(4)投加玉米芯固定化混合菌生物强化修复改变了土壤微生物的结构和丰富度,降低了土壤细菌的种群多样性,细菌的Shannon多样性指数下降至2.33,属水平下假单胞菌(Pseudomouas sp.SDR4)和高山被孢霉菌(Mortierella alpina.JDR7)成为降解过程的优势菌株,降解率与SDR4和JDR7的丰度呈正相关,其相对丰度为80.03%和80.15%,形成了降解真菌-细菌共生优势菌株体系,明显提高了低温土壤中的PAHs污染的修复效果。
