2株邻苯二甲酸酯高效降解菌的筛选鉴定及其降解性能
2019-10-23周震峰
潘 琪,孙 淑,周震峰,2*
(1.青岛农业大学资源与环境学院,青岛 266109;2.青岛市农村环境工程研究中心,青岛 266109)
邻苯二甲酸酯(简称PAEs)是一类人工合成的有机化合物,主要被用作增塑剂和软化剂,是塑料生产过程的重要化工原料。全球塑料制品的广泛使用导致PAEs成为环境介质中最普遍存在的有机污染物之一[1]。国内外大量研究表明,PAEs具有内分泌干扰性[2-3],可通过呼吸、食物摄入和皮肤接触进入人体和动物体,干扰人类及其他动物正常的内分泌活动,进而影响生殖健康,威胁到人类及其他生物的生存[4-5]。
已有研究证实,PAEs属于难降解有机污染物,在环境中水解、光解速度较慢,微生物降解是PAEs衰减的主要途径[6],驯化分离高效降解菌成为PAEs污染环境生物修复的重要基础性工作[7-8]。近年来,国内外学者选择不同的PAEs化合物作为目标污染物,从污泥、土壤、河道底泥等环境介质中已经成功分离出部分PAEs高效降解菌,包括Gordonia sp.[9]、Sphingobium sp.[10]、Enterobacter sp.[11]、Arthrobacter sp.[12-13]、Achromobacter insolitus[14]、Bacillus sp.[15]、Paenibacillus sp.[16]、Pseudomonas sp.[17-18]、Enterobacter sp.[17]、Rhodococcus sp.[17]、Ensifer sp.[19]、Pseudomonas putida[20]、Chryseobacterium sp.[21]、Mycobacterium sp.[22]、Xanthobacter sp.[23]。由于国内外不同地域土壤和水体中PAEs浓度水平和单体组成存在显著差异[24-25],而已经报道的PAEs降解菌适用环境条件有限,因此,仍有必要进一步筛选高效广谱的PAEs降解菌,为PAEs污染环境修复提供更为丰富的菌种资源。
鉴于邻苯二甲酸二丁酯(DBP)和邻苯二甲酸二(2-乙基己基)酯(DEHP)是目前我国土壤和水体中最主要的2种PAEs化合物[24],故本文选择DBP和DEHP作为目标污染物,从土壤中筛选得到2株PAEs高效降解菌RXX-2和RXX-3,通过形态观察、生理生化及16S rDNA序列分析等手段对菌株进行了鉴定,并采用摇瓶振荡培养考察了菌株在不同的环境条件下对PAEs的降解性能,旨在为菌株用于PAEs污染环境修复提供一定的参考依据。
1 材料和方法
1.1 实验材料
DBP和DEHP购自北京百灵威科技有限公司;高效液相色谱分析所用试剂均为色谱纯,其余试剂均为分析纯。
牛肉膏蛋白胨培养基:牛肉膏3.0 g、NaCl 5.0 g、蛋白胨 10.0 g,H2O 1000 mL。
无机盐培养基:K2HPO4·3H2O 1.0 g、NaCl 1.0 g、MgSO4·7H2O 0.4 g、NH4NO30.5 g、CaCl20.1 g、FeCl3·6H2O 0.01 g,H2O 1000 mL。
1.2 实验方法
1.2.1 PAEs降解菌的驯化与分离
从青岛市设施菜地和白沙河沿岸采集土样,称10 g土样分别加入盛有100 mL灭菌蒸馏水的三角瓶中,在30℃、175 r·min-1条件下振荡混匀。按1%的接种量取上述样品菌悬液的上清液,加入到DBP/DEHP分别为50 mg·L-1的无机盐培养液中,避光振荡培养7 d后进行下一次传代,每次传代逐渐提高DBP和DEHP浓度,浓度系列递增为50~1000 mg·L-1。每7 d作为一个驯化周期传代一次,持续进行培养。取100 μL终期驯化液,涂布于DBP/DEHP浓度相同的无机盐固体平板上,置于30℃生化培养箱中静置培养。待长出肉眼可见菌落后,观察其生长特征,筛选出长势最好的菌株,挑取单菌落将其反复划线接种于新的无机盐固体培养基上,直至镜检纯化为止。
1.2.2 菌株的鉴定
利用微生物生化鉴定试剂对菌株进行生理生化特性的测定,委托生工生物工程(上海)股份有限公司测定菌株的16S rRNA序列,并用MEGA 5软件构建系统发育树。综合菌株的形态特征、生理生化特征及16S rDNA序列分析结果,对菌株进行鉴定。
1.2.3 菌悬液的制备
挑取新鲜单菌落接种到牛肉膏蛋白胨液体培养基中,在摇床中28℃、170 r·min-1恒温振荡培养至对数生长期。取出液体培养基,将培养液分装于50 mL已灭菌的离心管中,在室温条件下于4000 r·min-1离心分离10 min。弃去上清液后,使用灭菌的生理盐水(0.9%的NaCl溶液)重悬后再次离心,重复该过程3次后,用生理盐水将菌体调配成菌悬液(OD600=1.0)。
1.2.4环境条件对菌株降解PAEs的影响
(1)pH。将上述菌悬液接种到初始浓度为100 mg·L-1DBP/DEHP 无机盐培养基中,用 0.1 mol·L-1HCl和0.1 mol·L-1NaOH调节培养基的pH分别为5、6、7、8、9,在接种量1.0%(体积比)、温度25℃、转速150 r·min-1的条件下振荡培养5 d,测定剩余PAEs含量,并测定其OD600值。每个处理设置3个重复,下同。
(2)温度。将上述菌悬液接种到初始浓度为100 mg·L-1DBP/DEHP无机盐培养基中,设置培养温度为15、20、25、30、35 ℃,在接种量1.0%(体积比)、pH 7、转速150 r·min-1条件下振荡培养5 d,测定剩余PAEs含量,并测定其OD600值。
(3)转速。将上述菌悬液接种到初始浓度为100 mg·L-1DBP/DEHP无机盐培养基中,设置转速0、100、150、175、200 r·min-1,在接种量为1.0%(体积比)、pH 7、温度25℃的条件下振荡培养5 d,测定剩余PAEs含量,并测定其OD600值。
(4)接种量。将上述菌悬液接种到初始浓度为100 mg·L-1DBP/DEHP无机盐培养基中,接种量分别为0、0.5%、1.0%、1.5%、2.0%(体积比),在pH 7、温度25 ℃、转速150 r·min-1的条件下振荡培养5 d,测定剩余PAEs含量,并测定其OD600值。
(5)最佳条件下菌株对PAEs的降解性能。依据上述实验确定的最佳降解条件,将菌悬液接种到初始浓度为100 mg·L-1DBP/DEHP无机盐培养基中,振荡培养5 d,分别在第1、2、3、4、5 d测定剩余PAEs含量。
1.2.5 PAEs含量的测定
采取液液萃取法对样品中剩余PAEs进行提取。向100 mL的DBP/DEHP无机盐培养基中加入乙酸乙酯后振荡30 min,全部移至分液漏斗充分振荡后静置分层,收集上层萃取液。用乙酸乙酯洗脱,收集全部洗脱液至鸡心瓶中,加入适量无水硫酸钠去除水分。在玻璃砂芯漏斗中铺一定量弗罗里硅土,用乙酸乙酯过滤并洗脱,收集全部洗脱液至鸡心瓶中,旋转蒸发浓缩至干,加入色谱级甲醇定容至1.5 mL,过有机系0.22 μm滤膜后采用高效液相色谱仪进行分析。
色谱条件为:色谱柱:inertsil ODS-SP(250 mm×4.6 mm i.d.,5.0 μm);流动相A:甲醇,流动相B:水。采用梯度洗脱:设定B起始为30%,在20 min内匀速下降至5%,而后瞬间降至0%并保持5 min,再回到30%平衡10 min等待下一次进样;总流速:0.8 mL·min-1;柱温箱温度:32 ℃;进样量:20 μL;检测器:紫外检测器;检测波长:228 nm。
1.2.6 数据分析统计
利用SPSS 21.0对数据进行单因素方差分析(ANOVA)以确定不同处理组之间的差异,显著性水平为P<0.05,利用软件Origin 9.0作图。
2 结果与讨论
2.1 菌株的分离及生理生化鉴定
经过富集培养,分离得到2株PAEs降解菌,分别命名为RXX-2、RXX-3。2株降解菌于30℃恒温培养3~5 d后,对其菌落形态进行观察,详见图1。RXX-2菌落呈圆形,淡黄色,黏质不透明,边缘整齐,表面隆起,湿润光滑,直径一般在0.5~0.8 mm;RXX-3菌落呈圆形,白色,黏质不透明,边缘整齐,表面隆起,湿润光滑,直径一般在0.1~0.3 mm。
图1 菌落形态Figure 1 Colony morphology
利用微生物生化鉴定试剂对2株降解菌的生理生化特性进行测定,结果见表1。由表可以看出,菌株RXX-2和菌株RXX-3的生理生化特性相似,葡萄糖发酵、阿拉糖发酵、柠檬酸盐试验呈阳性,半乳糖发酵、甘露醇发酵、肌醇发酵、山梨醇发酵、鼠李糖发酵、蔗糖发酵、密二糖发酵、色氨酸酶、丙酮酸酶、脲酶、精氨酸脱羧酶、赖氨酸脱羧酶、鸟氨酸脱羧酶、吲哚、硫化氢、硝酸盐试验呈阴性,不同之处为菌株RXX-2的氧化酶试验呈阳性,菌株RXX-3的氧化酶试验呈阴性。
2.2 菌株的16S rDNA分子鉴定
经16S rDNA菌种鉴定,并绘制菌株RXX-2和RXX-3的系统发育树(图2)。结果表明,RXX-2与食异源物鞘氨醇菌(Sphingobium xenophagum)的相似性达到100%,RXX-3与鳗败血假单胞菌(Pseudomonas anguilliseptica)的相似性达到98%,综合菌株的形态特征、生理生化特征及16S rDNA序列分析结果,初步鉴定菌株RXX-2、RXX-3分别为食异源物鞘氨醇菌(Sphingobium xenophagum)和鳗败血假单胞菌(Pseudomonas anguilliseptica)。

表1 2株降解菌的生理生化特征Table 1 Physiological and biochemical characteristics of two degrading strains
2.3 环境条件对菌株降解PAEs的影响
2.3.1 pH对菌株降解PAEs的影响
pH对菌株降解PAEs的影响见图3。由图可知,在pH=5~9的范围内,随初始pH升高,菌株RXX-2、RXX-3的生长量及PAEs降解率均呈现先增大后减小的趋势,但2株降解菌的最适pH条件略有不同。在初始pH=8条件下菌株RXX-2的生长和降解能力最强,DBP和DEHP降解率分别达到32.5%和27.7%,而菌株RXX-3在初始pH=7条件下生长和降解能力最强,DBP和DEHP降解率分别达到98.8%和25.3%。进一步分析发现,菌株RXX-2在中性偏碱性(pH=7、8、9)条件下对PAEs的降解率显著高于酸性条件,这与文献[26]报道的红球菌(Rhodococcus sp.)相似,该菌株在中性偏碱性(pH=7、8)条件下生长降解状况最佳,其原因可能是PAEs在降解过程中会代谢成邻苯二甲酸、原儿茶酸等酸性物质所致[27],而菌株RXX-3在中性偏酸性(pH=5、6、7)条件下对PAEs的降解率显著高于碱性条件,表明2株降解菌分别适于不同酸碱环境的PAEs污染修复。
2.3.2温度对菌株降解PAEs的影响
温度对菌株降解PAEs的影响见图4。由图可知,在培养温度为15~35℃范围内,菌株RXX-2、RXX-3的生长量及PAEs的降解率随温度的升高呈现先增大后减小的趋势。菌株RXX-2和RXX-3的最适生长温度分别为25℃和30℃,温度过低(15℃)会明显影响菌株的生长,降解活性较低,当温度升至30℃时,PAEs降解率达到最高值,此时菌株RXX-2对DBP和DEHP降解率分别达到46.6%和31.2%,菌株RXX-3对DBP和DEHP降解率分别达到97.7%和43.7%,当温度继续升至35℃时,DBP和DEHP的降解率均显著低于30℃条件。该现象与其他学者[28-31]研究菌株在不同温度条件下降解PAEs的结论一致,其原因可能是温度会影响菌体的酶、核酸、蛋白质等组分,继而影响其细胞生长速率和生物化学反应速率[32]。
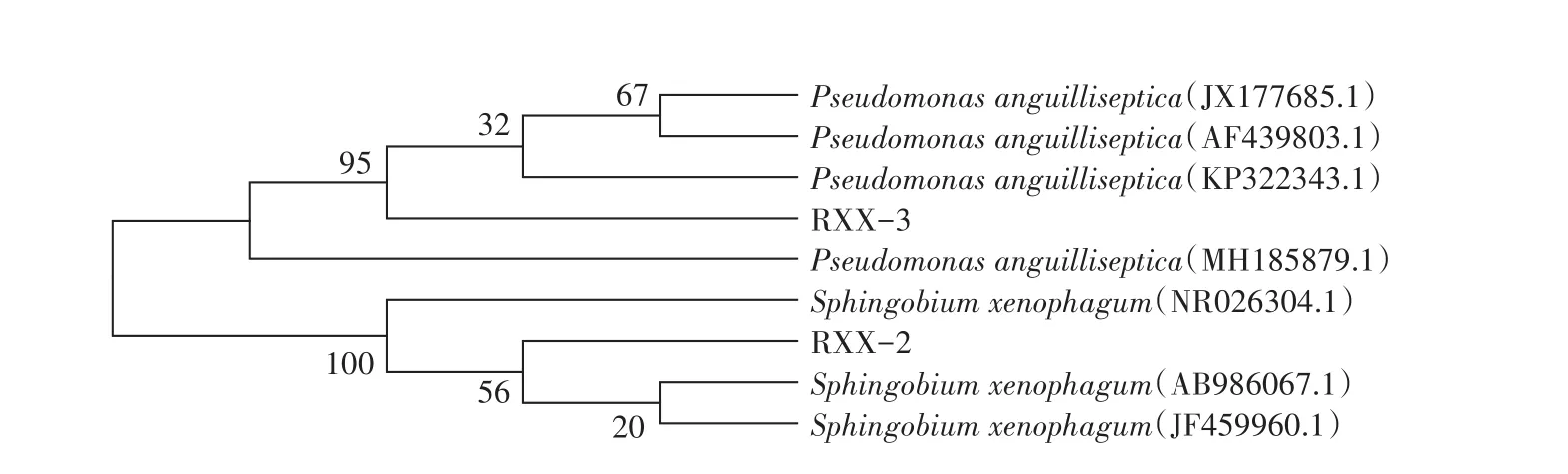
图2 菌株RXX-2和RXX-3的系统发育树Figure 2 Phylogenetic tree of strain RXX-2 and RXX-3
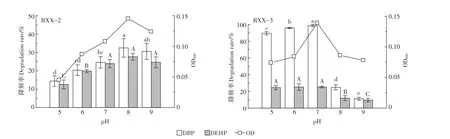
图3 pH对菌株降解PAEs的影响Figure 3 Effect of pH on degradation of PAEs by strains
2.3.3转速对菌株降解PAEs的影响
转速对菌株降解PAEs的影响见图5。由图可知,在转速为0~200 r·min-1的范围内,菌株 RXX-2、RXX-3的生长量及PAEs降解率随转速的升高均呈现先增大后减小的趋势。菌株RXX-2和RXX-3分别在转速 150 r·min-1和 175 r·min-1条件下生长量最高,但在转速为175 r·min-1时2株降解菌均表现出最强的降解能力,菌株RXX-2对DBP和DEHP降解率分别达到50.2%和34.7%,菌株RXX-3对DBP和DEHP降解率分别达到87.5%和37.9%。由此表明,转速过快或过慢都影响2菌株的生长,导致降解活性降低,这与周长健[33]分离的节杆菌(Arthrobacter sp.)JQ-1相似,当摇床转速在150~175 r·min-1之间时,菌株的生长降解状况最佳,其原因可能是由于摇床转速间接地反映了培养液中溶解氧(DO)含量,提高转速有利于空气中的氧气向培养基扩散,从而更好地满足菌株生长代谢的需求,但当转速过高时,菌株生长趋势开始变得缓慢,可能是由于摇床振荡过快造成菌株细胞破裂或培养液中DO已经达到饱和状态[34]。
2.3.4接种量对菌株降解PAEs的影响
接种量对菌株降解PAEs的影响见图6。由图可知,在未接种降解菌的条件下,DBP和DEHP降解率很低,随着菌液接种量的提高,2菌株的生长量及PAEs降解率均呈现先增大后减小的趋势。菌株RXX-2、RXX-3均在接种量1.0%的条件下生长量最高,菌株RXX-2在接种量为1.5%时对PAEs的降解能力显著高于其他接种量条件,DBP和DEHP降解率分别达到43.9%和39.1%,而菌株RXX-3在接种量为1.0%时对PAEs的降解能力最强,DBP和DEHP降解率分别达到91.0%和42.4%,尤其是对DEHP的降解能力显著高于其他的接种量条件。在正常情况下,菌液的接种量越高越有利于污染物的降解,但随着接种量的不断提高,较高的细菌数会形成对底物的竞争性利用,导致供单位微生物支配的营养物质减少,从而部分细菌会死亡,菌株降解活性下降,故表现为菌株在较高接种量时对底物的降解率反而降低[35]。
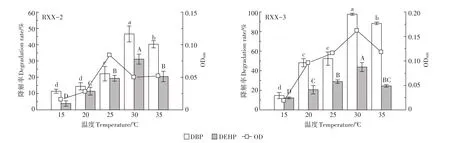
图4 温度对菌株降解PAEs的影响Figure 4 Effect of temperature on degradation of PAEs by strains
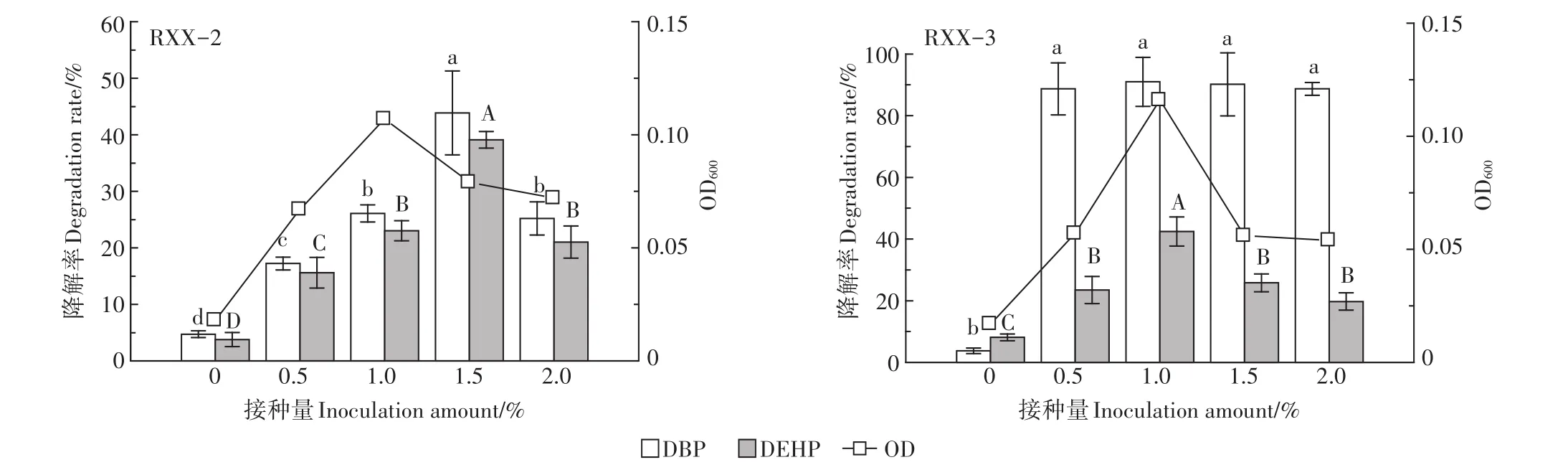
图6 接种量对菌株降解PAEs的影响Figure 6 Effect of inoculation amount on degradation of PAEs by strains
2.4 最佳条件下菌株对PAEs的降解性能
最佳条件下菌株对PAEs的降解性能见图7。由图可知,随着培养时间的延长,菌株RXX-2、RXX-3对DBP和DEHP的降解率持续升高,第3 d时,菌株RXX-3对DBP的降解率已超过90%,到培养末期,菌株RXX-2和RXX-3对DBP的降解率分别达到71.43%和98.98%,对DEHP的降解率分别达到52.85%和62.96%。在整个培养期,菌株RXX-3对DBP和DEHP的降解能力始终高于菌株RXX-2,且DBP的降解率始终高于DEHP,这主要是由于DBP的分子摩尔质量(278.4 g·mol-1)和lgKow(4.45,Kow为辛醇-水分配系数)均小于DEHP(分别为390.6 g·mol-1、7.50),而水溶解度(11.2 mg·L-1)高于 DEHP(0.003 mg·L-1)[2],导致其微生物利用率相对较高,降解速率较快。
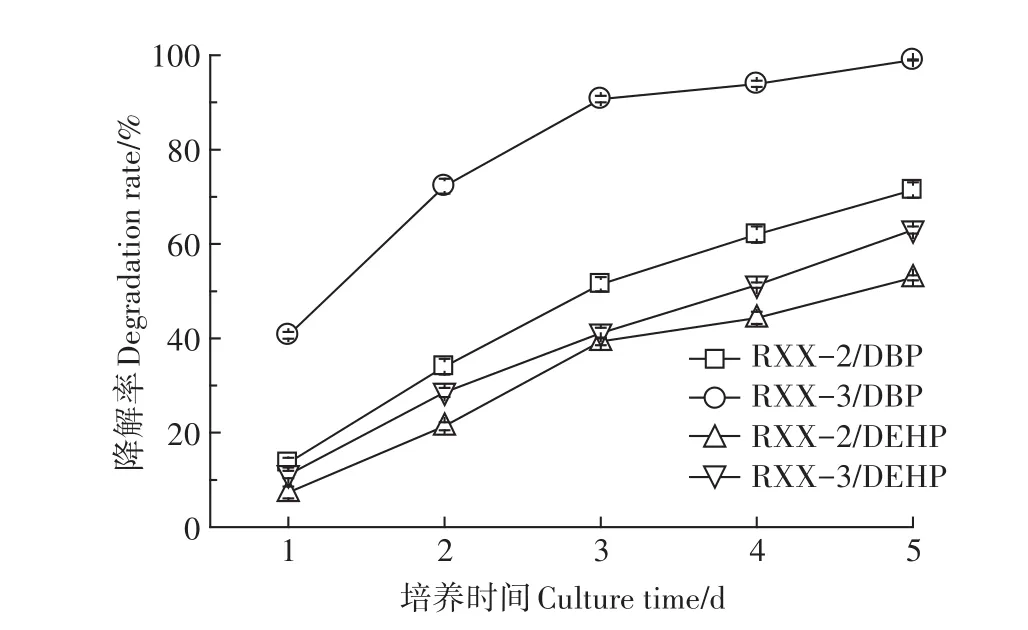
图7 最佳条件下菌株对PAEs的降解性能Figure 7 Degradation rates of strains to PAEs under the optimal conditions
3 结论
(1)从土壤中分离得到2株PAEs降解菌RXX-2、RXX-3,初步鉴定2菌株分别为食异源物鞘氨醇菌(Sphingobium xenophagum)和鳗败血假单胞菌(Pseudomonas anguilliseptica)。
(2)菌株RXX-2降解PAEs的最佳条件为pH 8、温度30 ℃、转速175 r·min-1、接种量1.5%,而菌株RXX-3的最佳条件为pH 7、温度30℃、转速175 r·min-1、接种量1.0%。
(3)在最佳降解条件下,经过5 d的培养,菌株RXX-2对DBP和DEHP的降解率分别达到71.43%和52.85%,RXX-3对DBP和DEHP的降解率分别达到98.98%和62.96%,表明筛选得到的2株降解菌在PAEs污染环境的生物修复方面具有良好的应用前景。
