三种杀虫剂胁迫对大豆幼苗抗氧化酶活性的影响
2019-10-22纪祥龙
纪祥龙,高 强,凌 飞,张 侨
三种杀虫剂胁迫对大豆幼苗抗氧化酶活性的影响
纪祥龙1,高 强2,凌 飞3,张 侨4*
(1. 山东省绿色食品发展中心,山东 济南 250013;2. 山东临沂烟草有限公司,山东 临沂 276000;3. 日照海洋文旅建设发展有限公司,山东 日照 276800;4. 中国绿色食品发展中心,北京 100081)
为明确啶虫脒、吡虫啉、烯啶虫胺3种杀虫剂对大豆的胁迫效应,测定了3种杀虫剂对大豆幼苗抗氧化酶活性的影响。结果表明,3种杀虫剂均可诱导大豆幼苗超氧化物歧化酶活性提高;吡虫啉处理的大豆幼苗体内过氧化氢酶和过氧化物酶的活性显著提高,啶虫脒和烯啶虫胺处理后大豆幼苗过氧化氢酶和谷胱甘肽过氧化物酶活性显著提高。为大豆田间合理使用农药防治蚜虫提供参考。
杀虫剂;大豆幼苗;抗氧化酶
大豆()是世界范围内最重要的油料作物和人畜主要的植物源蛋白[1]。大豆田间病虫害的发生与流行严重威胁着大豆的安全生产,常常造成较为严重的经济损失。蚜虫等刺吸类害虫是大豆田间的主要害虫之一,广泛分布于我国东北、华北等各大豆产区,其刺吸植株后造成叶片卷曲、生长迟缓、分枝及结荚减少,并传播大豆花叶病毒病等病害,若不及时防治,最终造成大豆严重减产[2-3]。目前田间对大豆蚜虫的防治仍以农药为主。农药作为非自然的污染胁迫因子,主要通过活性氧对农作物造成伤害,而抗氧化酶系统是植物体内消除活性氧的主要解毒代谢途径[4]。本研究以大豆为研究对象,比较分析了3种刺吸性昆虫杀虫剂啶虫脒、吡虫啉、烯啶虫胺使用后对大豆幼苗体内超氧化物歧化酶、过氧化氢酶、过氧化物酶和谷胱甘肽过氧化物酶活性的影响,以明确农药使用后大豆植株的解毒代谢途径,并为大豆田间蚜虫的防治提供理论参考。
1 材料与方法
1.1 供试大豆
供试大豆品种为齐黄34,由山东省农业科学院作物研究所提供。选择大小一致,颗粒饱满的大豆种子放入装有基质的塑料花盆(直径8 cm,高7 cm),加入适量肥料后置于温室培育,定期浇水。待植株出苗后生长至5叶期时使用杀虫剂处理,用于后续试验测定。
1.2 供试药剂
70%吡虫啉水分散粒剂、50%吡蚜酮可湿性粉剂和10%烯啶虫胺可溶液剂均购自中化农化有限公司。
1.3 试验方法
使用丙酮稀释药剂至常规使用浓度,使用微量取液枪量取一定药液,轻轻涂抹于大豆幼苗上部第3片完全展开的叶片,以丙酮为对照,各处理重复5次。施药24 h后收集各叶片,根据北京索莱宝科技有限公司试剂盒说明书,测定大豆幼苗超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)的活性。
1.4 数据分析
使用SPSS16.0单因素方差分析LSD比较分析各药剂处理后大豆幼苗体内抗氧化酶活性的差异性变化。
2 结果与分析
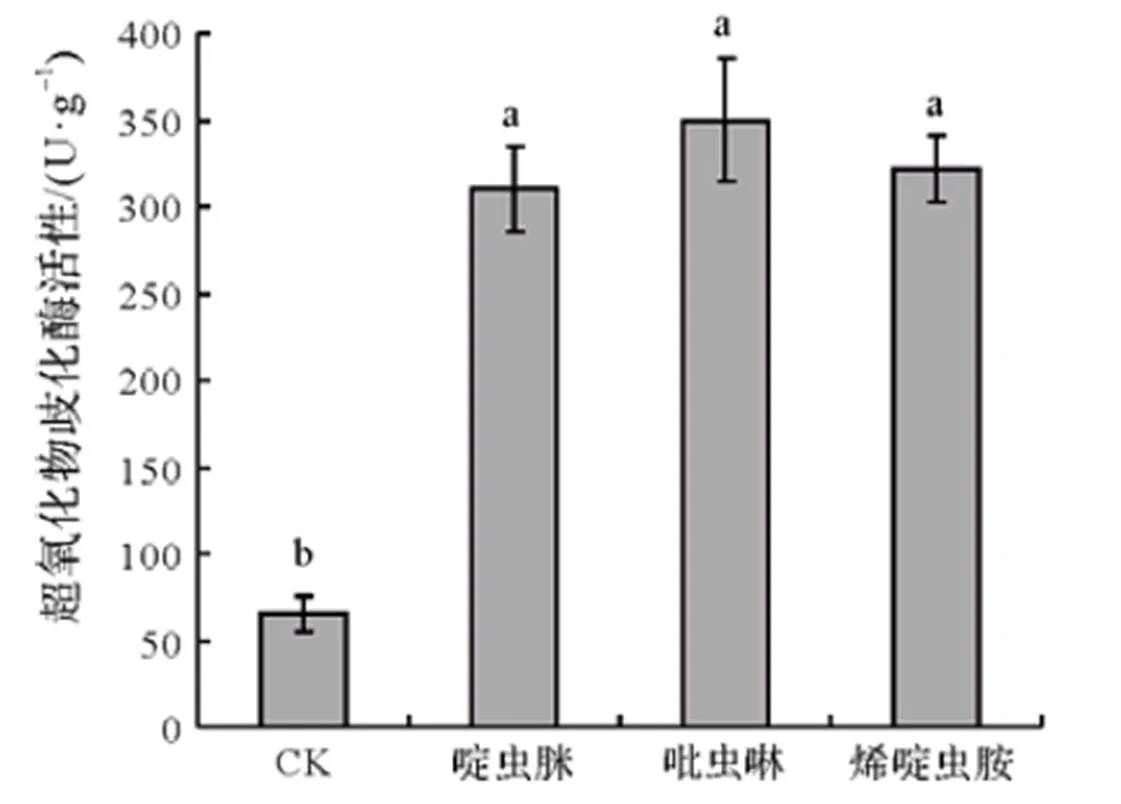
2.1 3种杀虫剂对大豆幼苗超氧化物歧化酶活性的影响
图1表明,施药24 h后,与对照相比,3种农药均可造成大豆体内超氧化物歧化酶活性的显著提高(<0.05)。
2.2 3种杀虫剂对大豆幼苗过氧化物酶活性的影响
使用吡虫啉后,可显著诱导大豆幼苗体内过氧化物酶活性的提高(<0.05),而啶虫脒和烯啶虫胺胁迫对该酶活性无显著性影响(图2)。
单因素方差分析LSD差异比较,不同字母表示处理间差异显著(P<0.05),下同

单因素方差分析LSD差异比较,不同字母表示处理间差异显著(P<0.05),下同
2.3 3种杀虫剂对大豆幼苗过氧化氢酶活性的影响
图3表明,经啶虫脒和烯啶虫胺处理的大豆幼苗体内的过氧化氢酶的活性较对照明显增强(<0.05),而使用吡虫啉后对其无影响。
2.4 3种杀虫剂对大豆幼苗谷胱甘肽过氧化物酶活性的影响
结果表明,施药24 h后,吡虫啉胁迫对大豆幼苗体内谷胱甘肽过氧化物酶活性无显著影响,而啶虫脒和烯啶虫胺处理植株体内该酶的活性显著提高(<0.05,图4)。

图3 3种杀虫剂对大豆幼苗过氧化氢酶活性的影响(平均值±标准误)

图4 3种杀虫剂对大豆幼苗谷胱甘肽过氧化物酶活性的影响(平均值±标准误)
3 讨 论
在植物的生长发育过程中,通常情况下自由基的水平较低,不会对植物造成细胞的损害,细胞内自由基的产生与清除处于动态平衡状态。当植物受到外界生物或者非生物因素胁迫时,如病虫害侵染、干旱、盐碱、高温和低温等,会造成植物体内活性氧含量的增加,若活性氧清除不及时,最终会造成植物组织和细胞的氧化损伤,影响作物的正常生长[5-8]。
当产生逆境胁迫时植物自身启动活性氧清除系统,以降低和清除体内自由基,从而防御活性氧和其他自由基对膜脂的破坏,维持正常的植物细胞代谢[9-10]。本研究结果表明,合理配制使用啶虫脒、吡虫啉、烯啶虫胺等3种药剂后,大豆幼苗可通过提高相关抗氧化酶的活性保护自身从而降低农药胁迫的伤害。其中过氧化氢酶可催化植物细胞内的过氧化氢降解为水和氧气,防治膜脂过氧化,是C3植物中过氧化氢清除的关键因子[11]。谷胱甘肽过氧化物酶系是植物体清除自由基的另一种方式,它可以使有毒的过氧化物还原成无毒的羟基化合物,同时促进过氧化氢的分解,从而保护细胞膜的结构及功能不受过氧化物的干扰及损害[12]。在生产实践中,应注意化学农药的合理使用,避免作物因药害胁迫造成机体内活性氧产生与清除平衡的破坏,导致作物氧化损伤而影响正常生长。
[1] Munns R, Tester M. Mechanisms of salinity tolerance[J]. Annual Review of Plant Biology, 2008, 59(1): 651-681.
[2] 霍治国, 李茂松, 王丽, 等. 气候变暖对中国农作物病虫害的影响[J]. 中国农业科学, 2012, 45(10): 1926-1934.
[3] 王素云, 暴祥致. 大豆蚜虫对大豆生长和产量影响的试验[J]. 大豆科学, 1996, 15(3): 243-247.
[4] 原向阳, 郭平毅, 张丽光, 等. 干旱胁迫下草甘膦对抗草甘膦大豆幼苗保护酶活性及脂质过氧化作用的影响[J]. 中国农业科学, 2010, 43(4): 698-705.
[5] 解玉玲. 干旱胁迫对大豆生理生化影响的研究进展[J]. 长沙大学学报, 2015, 29(2): 26-28.
[6] Chen J, Zhao X, Liu X, et al. Growth and physiology of two psammophytes to precipitation manipulation in Horqin Sandy Land, Eastern China [J]. Plants, 2019, 8(7): 244.
[7] Houston K, Tucker M R, Chowdhury J, et al. The plant cell wall: a complex and dynamic structure as revealed by the responses of genes under stress conditions[J]. Frontiers in plant science [J], 2016, 7: 984.
[8] Tosens T, Niinemets U, Vislap V, et al. Developmental changes in mesophyll diffusion conductance and photosynthetic capacity under different light and water availabilities in Populus tremula: how structure constrains function [J]. Plant, cell & environment, 2012, 35(5): 839-856.
[9] Das K, Roychoudhury A. Reactive oxygen species (ROS) and response of antioxidants as ROS-scavengers during environmental stress in plants [J]. Frontiers in Environmental Science, 2014, 2: 53.
[10] 刘强, 柳正葳, 贺根和, 等. 铝胁迫对烟草叶片呼吸作用和活性氧代谢的影响[J]. 江西农业大学学报, 2017, 39(1): 37-42.
[11] Kreslavski V D, Los D A, Allakhverdiev S I, et al. Signaling role of reactive oxygen species in plants under stress [J]. Russian Journal of Plant Physiology, 2012, 59(2): 141-154.
[12] Drotar A, Phelps P, Fall R. Evidence for glutathione peroxidase activities in cultured plant cells [J]. Plant Science, 1985, 42(1): 35-40.
Effects of Three Different Insecticide Stress on Antioxidant Enzyme Activity in Soybean Seedlings
JI Xiang-long1, GAO Qiang2, LING Fei3, ZHANG Qiao4*
(1.Shandong Green Food Development Centre, Ji’nan 250013, China; 2. Linyi Tobacco Company, Linyi, Shandong 276000, China; 3. Rizhao Ocean Culture and Tourism Development Co., Ltd., Rizhao, Shandong 276800, China; 4. China Green Food Development Center, Beijing 100081, China)
To explicit the stress effects of Acetamiprid, imidacloprid, and nitenpyram on soybean, the antioxidant enzyme activities in soybean seedlings were tested. The results showed that all three insecticides could induce the activity of superoxide dismutase in soybean seedlings. The activity of catalase and ascorbate peroxidase in imidacloprid-treated soybean seedlings was significantly improved, and the catalase and glutathione peroxidase activities were significantly increased in soybean seedlings treated with acetamiprid and nitenpyram compared with the control.
insecticide; soybean seedlings; antioxidant enzyme
http://xuebao.jxau.edu.cn
10.3969/j.issn.2095-3704.2019.03.43
S565.1
A
2095-3704(2019)03-0203-03
2019-08-31
2019-09-10
纪祥龙(1983—),男,高级农艺师,主要从事绿色生产技术研究与推广,jixianglong5@163.com;
张侨,高级农艺师,zhangqiao1981@sina.com。
纪祥龙, 高强, 凌飞, 等. 三种杀虫剂胁迫对大豆幼苗抗氧化酶活性的影响[J]. 生物灾害科学, 2019, 42(3): 203-205.
