乌鸡源多杀性巴氏杆菌杀禽亚种16S rDNA鉴定及药敏分析
2019-10-22伍思华邓贤才邬向东
黄 萃,伍思华,李 钰,邓贤才,邬向东
乌鸡源多杀性巴氏杆菌杀禽亚种16S rDNA鉴定及药敏分析
黄 萃,伍思华,李 钰,邓贤才,邬向东*
(江西农业大学 动物科学技术学院,江西 南昌 330045)
2018年底某乌鸡场突然暴发一起急性死亡疫情,细菌分离纯化得到菌株JX-Pm01。该分离菌株经染色镜检、16S rDNA基因片段PCR扩增与测序分析,结果表明分离菌株JX-Pm01与多杀性巴氏杆菌同源性接近100%,其中与杀禽亚种同源性最高,达99.3%,初步判定分离菌株为多杀性巴氏杆菌杀禽亚种,该次疫情为禽霍乱。为防治该病提供参考,筛选敏感药物进行防治,笔者对分离菌株JX-Pm01进行了药物敏感试验,结果表明该分离菌株对氨苄西林、丁胺卡那、多西环素和恩诺沙星敏感,对头孢曲松、卡那霉素、氟苯尼考、红霉素、林可霉素和诺氟沙星耐药。
乌鸡;16S rDNA鉴定;多杀性巴氏杆菌;多杀性巴氏杆菌杀禽亚种;药敏分析
多杀性巴氏杆菌()是引起畜禽巴氏杆菌病的病原菌,是一种革兰氏阴性短杆菌,有荚膜,无鞭毛、不形成芽胞、不运动,可感染家禽、猪和牛等多种动物以及人,引起禽霍乱、猪肺疫和牛出血性败血症等多种传染病[1-2]。多杀性巴氏杆菌病广泛流行于世界各地,目前在我国多种家畜、家禽和野生动物中均有多杀性巴氏杆菌病发生,且发病率和死亡率均较高,给畜禽生产带来巨大的经济损失,是危害畜禽养殖业的重要细菌传染病之一[3-4]。因此,畜禽多杀性巴氏杆菌病的诊断和防治至关重要。
2018年11月南昌某鸡场鸡群突然发病,且短时间内出现大批死亡,江西农业大学动物科学技术学院从发病鸡的肝脏中分离到一株细菌,在本实验室经过微生物学诊断和16S rDNA基因鉴定,判定其为多杀性巴氏杆菌杀禽亚种;同时选取14种抗生素进行了药敏试验,结果表明分离菌对氨苄西林、丁胺卡那、多西环素和恩诺沙星敏感,为该鸡场的病情防治提供了及时有效的帮助。
1 试验材料
1.1 病料来源
江西省南昌市某鸡场送检发病乌鸡的肝脏等病料。
1.2 主要试剂和仪器 普通琼脂培养基、鲜血琼脂培养基和TSA培养基,由实验室自制;小牛血清,购自杭州江滨生物技术有限公司;PCR Mix、100 bp DNA Ladder,购自北京全式金生物科技有限公司;胶回收试剂盒,购自Omega公司;饱和酚、溴化乙锭(EB)、SDS、Tris碱等,购自Solarbio公司;琼脂糖购自Sigma公司;药敏纸片,购自杭州微生物试剂有限公司。
1.3 主要仪器
SW-CJ型净化工作台,购自苏州净化设备有限公司;YXQ-LS-75S11型立式压力蒸气灭菌器、SPX-150B-Z型生化培养箱,购自上海博讯实业有限公司医疗设备厂;5415R型冷冻台式高速离心机,购自Eppendorf公司;K960型PCR仪,购自杭州晶格仪器有限公司。
1.4 引物设计
分离株的16S rRNA基因序列的扩增采用细菌16S rRNA通用引物,引物由上海生工生物工程股份有限公司合成。引物序列如下:16S(F)5'-AGAGTTTGATCCTGGCTCAG-3',16S(R)5'-GGTTACCTTG TTACGACTT-3'。
2 试验方法
2.1 细菌分离
无菌取发病鸡肝脏,分别接种于鲜血琼脂培养基和普通琼脂培养基,在37 ℃恒温箱中培养24 h后进行观察,挑取可疑单个菌落进行纯化培养。
2.2 染色镜检
勾取纯化培养的单个菌落进行革兰氏染色,油镜镜检,观察记录其形态特征。
2.3 细菌16S rDNA鉴定
2.3.1 细菌DNA提取 取一支1.5 mL EP管,加入100 μL双蒸水,勾取2接种环纯化培养的单个菌落,混匀,煮沸10~15 min;12 000 r/min离心7 min,取上清,作为细菌DNA模板,-20 ℃保存备用。
2.3.2 细菌16S rDNA的PCR扩增 PCR反应体系:总体积为25 μL,其中含16S (F)和16S (R)各1 μL、PCR Mix 12.5 μL、DNA模板1 μL以及ddH2O 9.5 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性40 s,55 ℃退火50 s,72 ℃延伸50 s,34个循环;72 ℃延伸10 min。PCR反应产物用10 g/L琼脂糖凝胶进行电泳,30 min后在紫外灯下观察结果,并拍照记录。
2.3.3 16S rDNA测序与序列分析 用胶回收试剂盒回收目的片段,将纯化回收的目的片段送至上海华大基因生物科技有限公司双向测通测序。运用NCBI基因库中的BLAST对获得的序列进行同源性检索,与细菌16S rRNA基因序列进行对比,若同源性百分比≥99%,可以定义到种的水平;若同源性在97%~98.9%,可以定义到属的水平;若<97%,则定义为科。选取与分离菌16S rDNA基因序列同源性高的细菌用DNAStar进行核苷酸同源性比对分析。
2.4 药敏实验
采用药敏纸片扩散法,取100 μL小牛血清涂布于TSA培养基,于37 ℃恒温箱放置5 min,干燥后将药敏纸片贴于TSA培养基上,置于37 ℃恒温箱中培养24 h后测量抑菌圈直径。判定标准:抑菌圈直径<10 mm为耐药;抑菌圈直径在10~15 mm为中度敏感;抑菌圈直径>15 mm为高敏。
3 结果与分析
3.1 细菌分离结果
分离菌在鲜血琼脂培养基上形成圆形、边缘规则、表面光滑、乳白色的露滴状小菌落,无溶血现象(图1);在普通琼脂培养基上几乎不生长。
3.2 染色镜检
分离菌经革兰氏染色后进行镜检,结果如图2。可见分离株为革兰氏阴性的短杆菌,菌体两端钝圆,呈单个散在分布或成双存在。可疑为多杀性巴氏杆菌,并命名为JX-Pm01。

图1 细菌分离结果

图2 细菌染色结果(革兰氏染色,10×100)
3.3 细菌16S rDNA鉴定
3.3.1 16S rDNA基因PCR扩增结果 如图3所示,可以看到1条清晰的条带,且长度约为1 500 bp,与预期大小相符。

1:分离株16S rDNA扩增结果;M:100 bp Marker
3.3.2 16S rDNA基因测序与序列分析 分离株JX-Pm01的基因片段长度为1 443 bp,所得序列与NCBI基因库BLAST中多杀性巴氏杆菌16S rDNA基因序列同源性达100%,初步判定该分离菌株为多杀性巴氏杆菌。选取BLAST同源性检索中与分离菌同源性较高的多杀性巴氏杆菌杀禽亚种(subsp.)、多杀性巴氏杆菌败血亚种(subsp.)、咬伤巴氏杆菌()、犬巴氏杆菌()、咽巴氏杆菌()、口巴氏杆菌()、买氏巴氏杆菌()、产气巴氏杆菌()、豚放线杆菌()、流感嗜血杆菌()、副猪嗜血杆菌()、多源曼氏杆菌()、溶血性曼氏杆菌()与分离菌JX-Pm01的16S rDNA基因序列进行同源性比对分析,结果如图4。
结果表明JX-Pm01与巴氏杆菌核苷酸相似性达91.3%~99.3%,与多杀性巴氏杆菌同源性达99.1%,其中多杀性巴氏杆菌杀禽亚种与JX-Pm01同源性最高,达99.3%,进一步表明分离株为多杀性巴氏杆菌杀禽亚种。而与同科的豚放线杆菌、流感嗜血杆菌、副猪嗜血杆菌、多源曼氏杆菌、溶血性曼氏杆菌核苷酸同源性高达91.4%~97.3%,说明巴氏杆菌各种属之间的差异性较小,尤其与咽巴氏杆菌的同源性达97.3%。
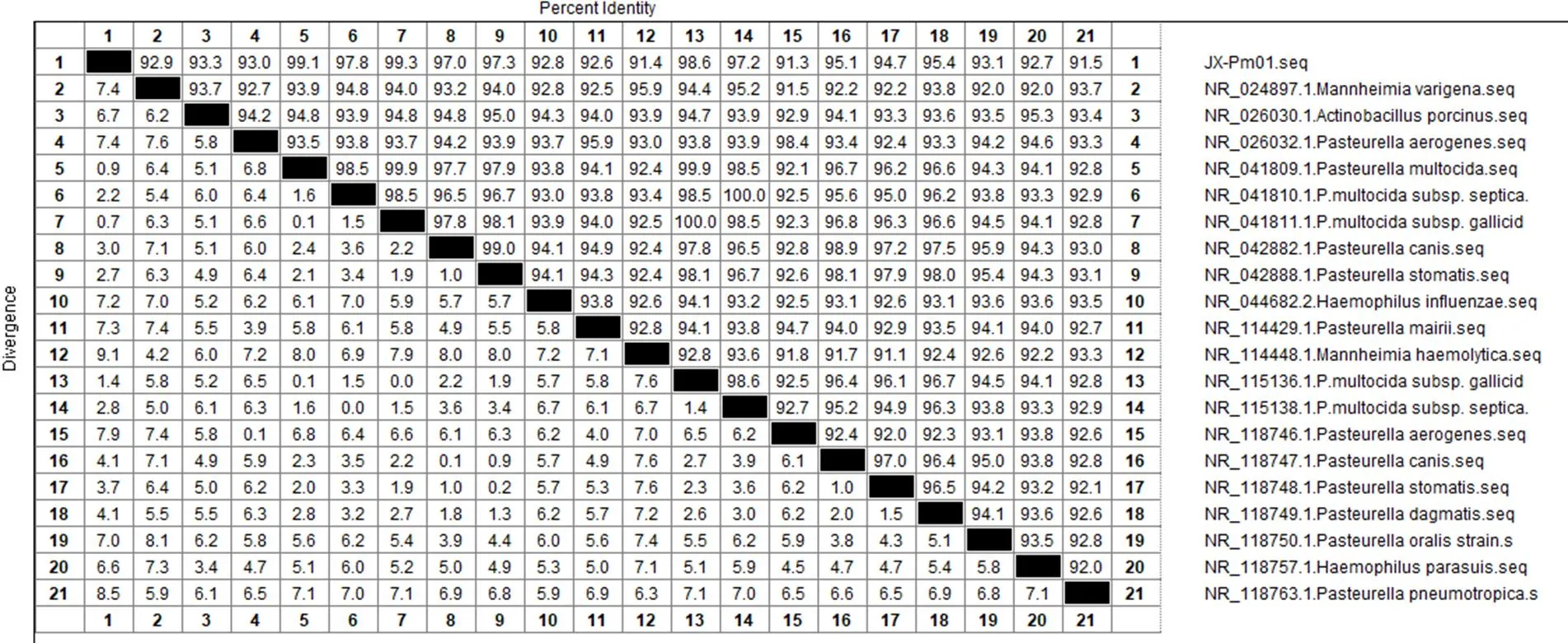
图4 分离菌16S rDNA基因序列同源性比对分析
3.4 药敏实验
分离株JX-Pm01对14种药物敏感性测定结果如表1,JX-Pm01对氨苄西林、丁胺卡那、多西环素和恩诺沙星高度敏感,对头孢哌酮、四环素、环丙沙星和复方新诺明中度敏感,对头孢曲松、卡那霉素、氟苯尼考、红霉素、林可霉素和诺氟沙星耐药。

表1 分离菌株JX-Pm01对14种药物的敏感性
S表示高度敏感;I表示中度敏感;R表示耐药;—表示未检测到抑菌圈
4 小结与讨论
试验从患病鸡肝脏分离到一株细菌JX-Pm01,经染色镜检结合临床症状和病理剖检,可疑为多杀性巴氏杆菌。经16S rDNA基因片段PCR扩增与测序分析,基本判定其为多杀性巴氏杆菌杀禽亚种。
多杀性巴氏杆菌引起的禽霍乱被OIE列为B类疫病[5],其发病率和死亡率均较高。及时准确诊断对于该病的防治,降低养殖户的损失有重要意义。选用抗菌药物仍是防治霍乱的主要措施,然而耐药性的产生,甚至是多药耐药基因[6],使本病的药物治疗效果不佳。本试验通过药敏试验,结果表明JX-Pm01对氨苄西林、丁胺卡那、多西环素和恩诺沙星敏感,对头孢哌酮、四环素、环丙沙星和复方新诺明中度敏感,而对头孢曲松、卡那霉素、氟苯尼考、红霉素、林可霉素和诺氟沙星耐药。这与边彦超等[7]和王彩丽等[8]报道的多杀性巴氏杆菌对药物的敏感与本试验分离菌的耐药性存在不少差异。因此当养殖场发生多杀性巴氏杆菌病时,需要根据药敏试验筛选药物进行科学用药,减少病原菌对抗生素耐药性的产生,使其获得良好的治疗效果。
[1] Wilkie I W, Harper M, Boyce J D, et al. Pasteurella multocida: diseases and pathogenesis[J]. Current Topics in Microbiology and Immunology, 2012(361):1-22.
[2] 高家登, 扎西达瓦, 曲久, 等. 多杀性巴氏杆菌病的研究[J]. 中国畜禽种业, 2017(9):35-37.
[3] Harper M, John M, Edmunds M, et al. Protective efficacy afforded by livevaccines in chickens is independent of lipopolysaccharide outer core structure[J]. Vaccine, 2016,34(14):1696-1703.
[4] 彭欠欠, 苏佳文, 孙王杨吉, 等. 一株多杀性巴氏杆菌的分离鉴定与耐药性研究[J]. 中国家禽, 2017(10):51-53.
[5] 王开文. 一例鸡巴氏杆菌病的诊治[J]. 湖北畜牧兽医, 2016,37(5): 33-34.
[6] Kumar P, Singh V P, Agrawal R K, et al. Identification ofisolates of ruminant origin using polymerase chain reaction and their antibiogram study[J]. Tropical Animal Health and Production, 2009,41(4):573-578.
[7] 边彦超, 刘小兰, 康绍珠, 等. 鸡巴氏杆菌的分离鉴定及体外抑制实验[J]. 江西畜牧兽医杂志, 2018(1):20-23.
[8] 王彩丽, 荣俊, 王化俊, 等. 鸡多杀性巴氏杆菌的鉴定和药物敏感试验[J]. 湖北农业科学, 2010, 49(5):1162-1165.
16S rDNA Identification and Drug Sensitivity Analysis ofsubsp.
HUANG Cui, WU Si-hua, LI Yu, DENG Xian-cai, WU Xiang-dong*
(School of Animal Science and Technology, Jiangxi Agricultural University, Nanchang 330045, China)
At the end of 2018, a black chicken farm violently developed an acute death epidemic, and the strain was isolated and purified to obtain strain JX-Pm01. The isolated strain was stained by microscopy, 16S rDNA gene fragment PCR amplification and sequencing analysis. The results showed that the isolated JX-Pm01 was nearly 100% homologous to, and the highest homology with thesubsp., was up to 99.3%, which initially determined that the strain wassubsp., and the epidemic was avian cholera. In order to provide a reference for the prevention and treatment of this disease, screening sensitive drugs for its prevention and treatment, a drug sensitivity test on the isolated strain JX-Pm01 was conducted. The results showed that the isolated strain was sensitive to ampicillin, amikacin, doxycycline and enrofloxacin, but was resistant to ceftriaxone, kanamycin, florfenicol, erythromycin, lincomycin and norfloxacin.
black chicken; 16S rDNA identification;;subsp.; drug sensitivity analysis
http://xuebao.jxau.edu.cn
10.3969/j.issn.2095-3704.2019.03.52
S831;S852.61
A
2095-3704(2019)03-0243-05
2019-08-30
黄萃(1995—),女,硕士生,主要从事动物病原及免疫学研究,1415365418@qq.com;
邬向东,dxywxd2006 @126.com。
黄萃, 伍思华, 李钰, 等. 乌鸡源多杀性巴氏杆菌杀禽亚种16S rDNA鉴定及药敏分析[J]. 生物灾害科学, 2019, 42(3): 243-247.
猜你喜欢
——和田盘羊
