从基质代谢角度探讨扶正化瘀方抗心肌纤维化的细胞分子机制
2019-10-19朱珂娄利霞祁轶斐
朱珂 娄利霞 祁轶斐
[摘要] 目的 通过观察扶正化瘀方(FZHY)对血管紧张素Ⅱ(AngⅡ)诱导的心肌成纤维细胞(CFs)细胞外基质(ECM)代谢的影响,探讨其抗心肌纤维化(MF)的分子机制。 方法 差速贴壁法提取乳鼠原代CFs,传代培养。将细胞分为3组,每组6个样本,分别加入2% FBS-DMEM(空白对照组),1×10-7mol/L AngⅡ(AngⅡ组),1×10-7mol/L AngⅡ+100 μg/mL FZHY(FZHY组)。干预48 h后,采用ELISA法检测Ⅰ型胶原(ColⅠ)、ColⅢ、基质金属蛋白酶(MMP)-2、MMP-9、TIMP-1、TIMP-2的分泌情況;采用实时荧光定量PCR法检测ColⅠ、ColⅢ、MMP-2、MMP-9、TIMP-1和TIMP-2 mRNA的表达情况。 结果 与空白对照组比较,AngⅡ组ColⅠ、ColⅢ含量及mRNA的表达增加(P < 0.01);与AngⅡ组比较,FZHY组ColⅠ、ColⅢ含量及其mRNA表达下降(P < 0.05或P < 0.01)。与空白对照组比较,AngⅡ组MMP-2、MMP-9、TIMP-1和TIMP-2及其mRNA表达增加(P < 0.05),MMP-2/TIMP-2和MMP-9/TIMP-1有降低趋势;与AngⅡ组比较,FZHY组MMP-2、MMP-9、TIMP-1和TIMP-2及其mRNA表达下降,MMP-2/TIMP-2降低(P < 0.05或P < 0.01),MMP-9/TIMP-1有降低趋势,但差异无统计学意义(P > 0.05)。 结论 FZHY可减少CFs ColⅠ、ColⅢ的表达,其机制可能与下调MMP-2、MMP-9、TIMP-1、TIMP-2及其mRNA表达,降低MMP-2/TIMP-2、MMP-9/TIMP-1比值,调控ECM代谢有关。
[关键词] 扶正化瘀方;心肌纤维化;心肌成纤维细胞;细胞外基质;金属基质蛋白酶
[中图分类号] R541 [文献标识码] A [文章编号] 1673-7210(2019)08(b)-0012-04
[Abstract] Objective To observe the effect of Fuzheng Huayu Recipe (FZHY) on the extracellular matrix (ECM) metabolism of rat cardiac fibroblasts (CFs) induced by angiotensin Ⅱ (Ang Ⅱ), and to explore the mechanism of FZHY in treating myocardial fibrosis. Methods Differential adherent method was used to extract primary CFs from neonatal rats and subculture them. Cells can be divided into three groups, each group of 6 samples, add 2% FBS-DMEM (blank control group), 1 × 10-7 mol/L Ang Ⅱ (Ang Ⅱ group), 1 × 10-7 mol/L Ang Ⅱ + 100 μg/mL FZHY (FZHY group). Intervention after 48 h, collagentype Ⅰ(ColⅠ), ColⅢ, matrix metalloproteinases (MMP)-2, MMP-9 and TIMP-1 and TIMP-2 secretion were detected by the method of ELISA; ColⅠ, ColⅢ, MMP-2 and MMP-9 and TIMP 1 and TIMP-2 mRNA expression were detected by real-time fluorescent quantitative PCR method. Results Compared with blank control group, Col Ⅰ, Col Ⅲ content and mRNA expression of Ang Ⅱ group increased (P < 0.01). Compared with Ang Ⅱ group, Col Ⅰ, Col Ⅲ content and its mRNA of FZHY group expression decreased (P < 0.05 or P < 0.01). Compared with blank control group, MMP-2, MMP-9 and TIMP 1 and TIMP-2 and its mRNA expression of Ang Ⅱ group increased (P < 0.05). MMP-2/TIMP-2 and MMP-9/TIMP-1 showed a decreasing trend. Compared with Ang Ⅱ group, MMP-2, MMP-9 and TIMP 1 and TIMP-2 and its mRNA expression, and its MMP-2/TIMP-2 of FZHY group decreased (P < 0.05 or P < 0.01), and MMP-9/TIMP-1 had a tendency to decrease, but there was no statistical significance (P > 0.05). Conclusion FZHY can reduce the CFs ColⅠ, ColⅢ expression, its mechanism may be related to downgrade MMP-2, MMP-9 and TIMP 1 and TIMP-2 and its mRNA expression, reduce the MMP-2/TIMP-2, MMP-9/TIMP-1 ratio, regulating the metabolism of ECM.
[Key words] Fuzheng Huayu Recipe; Myocardial fibrosis; Myocardial fibroblast; Extracellular matrix; Metalloproteinase
心肌纤维化(MF)是由心肌成纤维细胞(CFs)增殖和细胞外基质(ECM)合成与降解失衡所导致的病理改变[1-2]。基质金属蛋白酶(MMPs)是调控ECM代谢的重要酶系[3],MMPs及其组织抑制剂(TIMPs)比例失衡導致的ECM代谢紊乱是MF的重要原因之一[4]。前期研究证实,扶正化瘀方(FZHY)可改善MF[5-6],但其具体的细胞分子机制尚不明确。本研究采用差速贴壁法提取乳鼠原代CFs,观察FZHY对血管紧张素Ⅱ(AngⅡ)诱导的CFs基质代谢的影响,探讨其抗MF的可能机制。
1 材料与方法
1.1 动物
3日龄Wistar乳鼠20只,雌雄不限,由北京维通利华实验动物技术有限公司购进,许可证号:SCXK(京)2016-0006,合格证号:11400700277357。
1.2 试剂
Neonatal Heart Dissociation Kit(美天旎公司,货号:130-098-373);Vimentin抗体(武汉博士德生物工程有限公司,货号:BM0135);a-SMA抗体(武汉博士德生物工程有限公司,货号:BM4172);AngⅡ(中肽公司,货号:CJ-04-01164);ELISA试剂盒(Elisa Biotech公司,货号:EIA-3504);RNAprep pure Cell/Bacteria Kit(TIANGEN公司,货号:DP430);FastKing gDNA Dispelling RT SuperMix(TIANGEN公司,货号:KR118-02);SuperReal PreMix Plus(TIANGEN公司,货号:FP205-02)。
扶正化瘀方由丹参8 g、虫草4 g、桃仁2 g、绞股蓝6 g、松花粉2 g、五味子2 g 六味中药组成。本实验所用扶正化瘀方浸膏由上海黄海制药有限责任公司提供,得膏率为13.75%,用2%FBS-DMEM稀释1000倍后使用。
1.3 仪器
超净工作台(北京半导体一厂);二氧化碳培养箱(德国,Heraeus);全自动组织处理系统(美天旎公司);紫外分光光度计(Pharmacia Biotech公司);Agilent Mx3000P PCR仪(美国ABI)。
1.4 CFs的培养和鉴定
根据Neonatal Heart Dissociation Kit说明书操作,无菌条件下取Wistar乳鼠心脏,采用差速贴壁法获取CFs,实验用3~5代CFs,10%FBS-DMEM常规培养,倒置显微镜下观察CFs形态,采用免疫细胞化学法进行鉴定。
1.5 分组及处理
以7.5×104个/mL浓度接种CFs于6孔板中,每孔2 mL。待细胞生长至60%~70%,换无血清DMEM孵育24 h。分别加入2%FBS-DMEM(空白对照组),1×10-7mol/L AngⅡ(AngⅡ组),1×10-7mol/L AngⅡ+100 μg/mL FZHY(FZHY组)。干预48 h后,收集细胞上清及细胞进行相关实验。
1.6 ColⅠ、ColⅢ、MMP-2、MMP-9、TIMP-1和TIMP-2含量的检测
采用ELISA法,取上清按试剂盒说明书操作。在样本孔和标准品孔中分别加入40 μL待测样本和不同浓度的标准品;每孔加入100 μL抗体,37℃孵育1 h;吸弃残液,加入底物A、B各50 μL,37℃避光15 min;加入50 μL终止液,在450 nm处测定各孔OD值,根据标准曲线计算样本浓度。
1.7 ColⅠ、ColⅢ、MMP-2、MMP-9、TIMP-1和TIMP-2 mRNA的表达
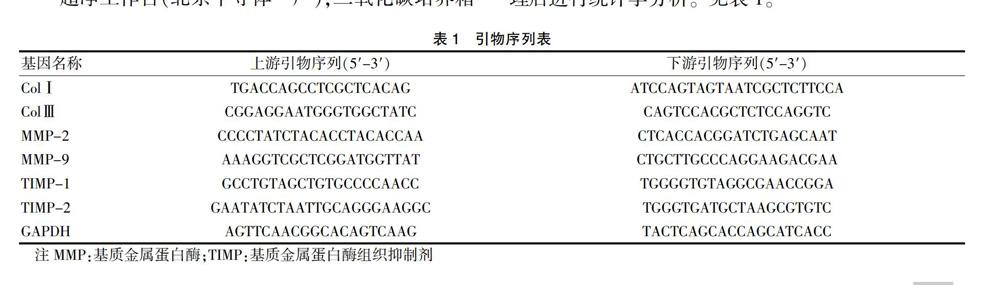
采用实时荧光定量PCR法检测。根据RNAprep pure Cell/Bacteria Kit、FastKing gDNA Dispelling RT SuperMix说明书操作提取细胞总RNA,并反转录为cDNA。PCR反应条件为95℃预变性15 min,95℃ 变性10 s,60℃退火-延伸32 s共40个循环,以GAPDH为内参。所得CT值按照2-△△ct的方法,进行均一化处理后进行统计学分析。见表1。
1.8 统计学方法
采用SPSS 22.0统计学软件进行分析,计量资料采用均数±标准差(x±s)表示,多组间比较先进行方差齐性检验,满足方差齐性采用单因素方差分析,总体有差异用LSD-t法进行两两比较,不满足方差齐性用Welch法及Dunnett′s T3法进行多重比较。以P < 0.05为差异有统计学意义。
2 结果
2.1 CFs的鉴定
显微镜下观察,CFs生长迅速,细胞多呈梭形或三角形,折光性弱,无自发搏动。免疫细胞化学鉴定结果显示,Vimentin染色呈阳性,a-SMA染色呈阴性。细胞纯度达95%以上。
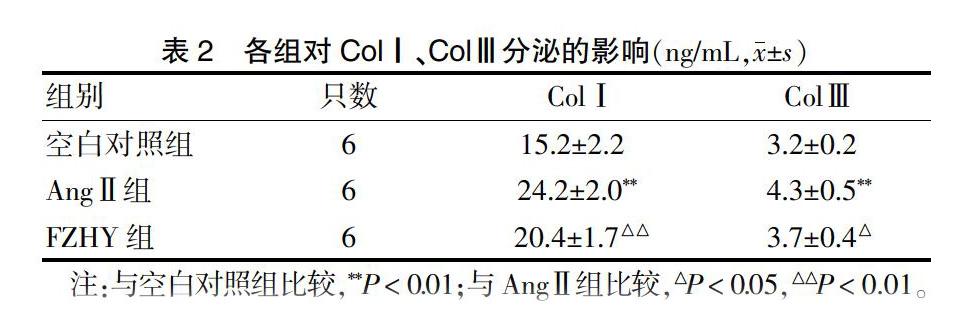
2.2 各组对ColⅠ、ColⅢ含量的影响
与空白对照组比较,AngⅡ组ColⅠ、ColⅢ含量增加(P < 0.01);与AngⅡ比较,FZHY组ColⅠ、ColⅢ含量减少(P < 0.01或P < 0.05)。见表2。
2.3 各组对ColⅠ、ColⅢ mRNA表达的影响
与空白对照组比较,AngⅡ组ColⅠ、ColⅢ mRNA表达水平升高(P < 0.01);与AngⅡ比较,FZHY组ColⅠ、ColⅢ mRNA表达水平下降(P < 0.05)。见表3。
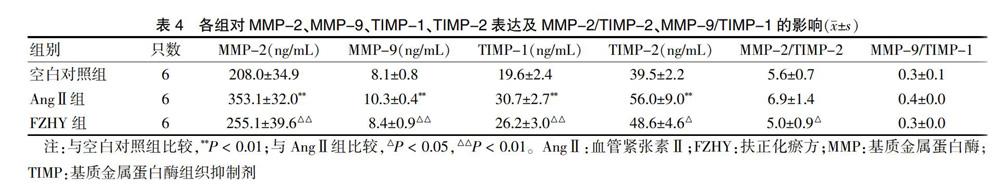
2.4 各组对MMP-2、MMP-9、TIMP-1、TIMP-2表达及MMP-2/TIMP-2、MMP-9/TIMP-1的影响
与空白对照组比较,AngⅡ组MMP-2、MMP-9、TIMP-1和TIMP-2含量增加(P < 0.01),MMP-2/TIMP-2和MMP-9/TIMP-1有下降趋势;与AngⅡ比较,FZHY组MMP-2、MMP-9、TIMP-1、TIMP-2含量以及MMP-2/TIMP-2减少(P < 0.05或P < 0.01),MMP-9/TIMP-1有降低趋势,但差异无统计学意义(P > 0.05)。见表4。
2.5 各组对MMP-2、MMP-9、TIMP-1和TIMP-2 mRNA表达的影响
与空白对照组比较,AngⅡ组MMP-2、MMP-9、TIMP-1和TIMP-2 mRNA表达水平升高(P < 0.05);与AngⅡ比较,FZHY组MMP-2、MMP-9、TIMP1和TIMP2 mRNA表达水平下降(P < 0.05或P < 0.01)。见表5。
3 讨论
FZHY由丹参、桃仁、五味子、绞股蓝、虫草、松花粉组成,具有活血化瘀,益气扶正的功效。前期研究[7]显示,MF过程中同样存在成纤维细胞增殖,ECM合成降解失衡的病理及正虚血瘀的病机。在“异病同治”理论指导研究发现,FZHY可抑制心肌胶原表达,改善心梗后MF[8]。
ECM主要由ColⅠ、ColⅢ组成[9],其过度沉积是MF形成的重要原因[5]。CFs是合成ColⅠ、ColⅢ的主要场所,某些病理条件刺激下,CFs过度增殖并大量分泌ColⅠ、ColⅢ[10],导致ECM合成增多,心肌僵硬度增加,MF发生[11]。AngⅡ通过激活CFs的AT1-R,影响CFs增殖和胶原表达[12]。故本研究采用AngⅡ建立CFs的MF细胞模型,结果显示,AngⅡ可诱导CFs的ColⅠ、ColⅢ表达升高,经FZHY处理后其表达明显降低,提示FZHY可通过抑制AngⅡ诱导的CFs胶原表达,减少ECM沉积,改善MF。
MF形成不仅包括ECM合成增多,还包括ECM降解失衡及胶原网络破坏等[13]。MMPs是一组由CFs等分泌,参与ECM降解与破坏的蛋白水解酶家族[14]。MMPs不仅能直接降解ECM并活化其他类型MMPs产生级联效应[15],还能调节胶原的合成,使正常胶原被缺乏连接结构的纤维间质代替[16-17]。MMP-2和MMP-9是其重要成员,过量表达可破坏胶原网络,促进CFs增殖、分化及迁移,致ECM沉积和MF形成[18-19]。TIMPs是MMPs的特异性抑制剂,以1∶1的比例与MMPs形成复合体,阻断MMPs与底物结合,抑制其活性[20]。TIMP-2与MMP-2,TIMP-1与MMP-9能分别形成酶原复合物,其比例失衡可促进MF的发展[21]。结果显示,AngⅡ组MMP-2、MMP-9、TIMP-1、TIMP-2表达升高,MMP-2/TIMP-2、MMP-9/TIMP-1有升高趋势,提示AngⅡ诱导了CFs MMP-2、MMP-9表达的相对升高,使ECM代谢紊乱,促进了MF发展。经FZHY干预后,CFs的MMP-2、MMP-9、TIMP-1、TIMP-2表达及MMP-2/TIMP-2、MMP-9/TIMP-1比值降低,提示FZHY可通过降低CFs的MMP-2/TIMP-2和MMP-9/TIMP-1水平,调控ECM代谢平衡,改善MF。
本研究从ECM代谢角度探讨了FZHY抗MF的细胞分子机制,证实FZHY可减少CFs ColⅠ、ColⅢ的表达,其机制可能与下调MMP-2、MMP-9、TIMP-1、TIMP-2及其mRNA表达,降低MMP-2/TIMP-2、MMP-9/TIMP-1,调控ECM代谢有关。研究结果为FZHY治疗MF提供了新的理论依据。然而MF的分子机制复杂,纤维化过程中ECM代谢还受TGF-β、非编码RNA等众多因素的调控。今后我们将在这些方面做进一步探讨。
[参考文献]
[1] 朱锦星,凌望,程大雁,等.中药干预心脏成纤维细胞活化防治心肌纤维化研究进展[J].时珍国医国药,2018,29(8):1971-1974.
[2] 马金,丁春华.心脏成纤维细胞与心肌纤维化[J].中華心血管病杂志,2014,42(3):269-272.
[3] López B,González A,Díez J. Role of matrix metalloproteinases in hypertension-associated cardiac fibrosis [J]. Curr Opin Nephrol Hypertens,2004,13(2):197-204.
[4] 马双陶,杨大春,唐兵,等.白藜芦醇抑制基质金属蛋白酶抗酒精性心肌纤维化[J].中国动脉硬化杂志,2012,20(1):21-24.
[5] 祁轶斐,任学娇,娄利霞,等.FZHY对心肌梗死后心肌纤维化大鼠细胞外基质代谢的影响[J].中医杂志,2018, 59(7):607-611.
[6] 任学娇,祁轶斐,娄利霞,等.FZHY对心肌梗死大鼠心肌纤维化及TGF-β1/Smads信号通路的影响[J].中西医结合心脑血管病杂志,2018,16(9):1185-1189.
[7] 吴爱明,赵明镜,张冬梅,等.心梗后心力衰竭模型大鼠中医证候特点及心脏的超声评价[J].中国中西医结合杂志,2007,27(3):227-230.
[8] 吴爱明,翟建英,张冬梅,等.扶正化瘀胶囊对心肌梗死大鼠心肌纤维化的影响[J].现代生物医学进展,2013,13(14):2618-2621.
[9] 卓小桢,刘懿,李娜,等.白藜芦醇通过TGF-β1/Smad3信号通路抑制心肌成纤维细胞中AngⅡ诱导的Ⅰ/Ⅲ型胶原合成[J].西安交通大学学报:医学版,2018,39(4):525-529,557.
[10] 于婷,王小梅.通心络对高糖培养下心肌成纤维细胞增殖和凋亡的影响[J].中国医科大学学报,2018,47(2):132-136.
[11] Tang M,Zhong M,Shang Y,et al. Differential regulation of collagen typesⅠandⅢexpression in cardiac fibroblasts by AGEs through TRB3/MAPK signaling pathway [J]. Cell Mol Life Sci,2008,65(18):2924-2932.
[12] Chi JY,Wang L,Zhang XH,et al. Activation of calcium-sensing receptor-mediated autophagy in angiotensinII-induced cardiac fibrosis in vitro [J]. Biochem. Biophys. Res. Commun.,2018,497(2):571-576.
[13] 刘军锋,贾克刚,刘运德.基质金属蛋白酶与心脏重构及心肌病理损害的研究进展[J].中华老年心脑血管病杂志,2007,9(7):499-500.
[14] 王娟,程志清.基质金属蛋白酶及其组织抑制剂与病毒性心肌炎心肌纤维化[J].中国心血管杂志,2007(06):467-469.
[15] Trim JE,Samra SK,Arthur MJ,et al. Upstream tissue inhibitor of metalloproteinases-1 (TIMP-1) element-1,a novel and essential regulatory DNA motif in the human TIMP-1 gene promoter,directly interacts with a 30-kDa nuclear protein [J]. J Biol Chem,2000,275(9):6657-6663.
[16] 陈漫天,魏盟.心室重构中细胞外基质合成与降解失平衡的研究进展[J].同济大学学报:医学版,2004,25(3):261-264.
[17] Briest W,H?觟lzl A,Rassler B,et al. Significance of matrix metalloproteinases in norepinephrine-induced remodelling of rat hearts [J]. Cardiovasc Res,2003,57(2):379-387.
[18] Dong J,Gao C,Liu J,et al. TSH inhibits SERCA2a and thePKA/PLN pathway in rat cardiomyocytes [J]. Oncotarget,2016,7(26):39 207-39 215.
[19] Gao C,Li T,Liu J,et al. Endothelial Functioning and HemodynamicParameters in Rats with Subclinical Hypothyroid and the Effects ofThyroxine Replacement [J]. PLoS One,2015,10(7):1-14.
[20] Fan D,Takawale A,Basu R,et al. Differential role of TIMP2 and TIMP3 in cardiac hypertrophy,fibrosis and diastolic dysfunction [J]. Cardiovasc Res,2014,103(2):268-280.
[21] 劉焱,刘刚,刘坤申.基质金属蛋白酶抑制剂与心脏疾病[J].临床荟萃,2005,20(16):953-955.
(收稿日期:2018-01-08 本文编辑:封 华)
