氢氧化镁的复合改性研究
2019-10-19崔香梅兰生杰朱东海
刘 英,崔香梅,兰生杰,朱东海
(1.青海大学化工学院,西宁 810016;2.青海大学省部共建三江源生态和高原农牧业国家重点实验室,西宁 810016)
1 引 言
随着经济的发展,高分子材料被广泛应用于多个领域,但其热稳定性差且极易燃烧。发生火灾时释放出的大量浓烟和有毒气体,对社会、个人财产和生命安全造成极大威胁[1]。为了改善高分子材料的可燃性能,常添加阻燃剂来提高材料的阻燃性能。阻燃剂一般分为有机阻燃剂和无机阻燃剂,有机阻燃剂在燃烧时产生腐蚀性和有毒气体并伴有浓烟,易造成二次危害[2]。而无机阻燃剂因绿色、无污染等优势被广泛研究和应用[3]。Mg(OH)2是一种重要的添加型无机阻燃剂,具有无毒、无烟、无腐蚀性、分解温度高、能有效促进基材成炭和成本低等优点[4-9]。但是,Mg(OH)2作为阻燃剂,其阻燃效率低,需填充60wt%以上才能达到很好的阻燃效果[10-11]。同时,Mg(OH)2有很强的亲水性,表面极性大,使得与非极性的聚合物材料相容性差。直接添加会造成Mg(OH)2在高分子材料中分散不均匀,严重影响复合材料的加工性能和力学性能[12-13]。为了发挥Mg(OH)2阻燃剂的优势,克服其不足,可通过表面改性改变其表面性能,如使其由“亲水疏油性”变为“亲油疏水性”,提升在聚合物中的分散性,从而增加与聚合物材料的相容性。对Mg(OH)2进行表面改性的研究已有大量报道,常用的改性剂有脂肪酸及其盐、硅烷偶联剂和钛酸酯偶联剂等[14-17],大多是既能与Mg(OH)2中的羟基反应,又可与高分子材料进行化学键合或物理缠绕的两性有机化合物。改性后的Mg(OH)2添加到复合材料中可降低对其力学性能的不利影响。通常情况下,单一表面改性剂的改性效果有限,而两种或两种以上表面改性剂对Mg(OH)2的复合改性,有望得到更好结果。硅烷偶联剂(KH550)是一种常见的偶联剂,其氨基可以与环氧树脂的环氧基键合,但疏水性差,改性后的Mg(OH)2分散效果不理想。而单一的十二烷基磷酸酯(DDP)对氢氧化镁改性的分散效果很好,而且DDP自身也是一种良好的阻燃剂,可以与Mg(OH)2起到协同阻燃的作用。为了发挥KH550的优势,并弥补其改性后分散性较差的不足,本论文采用DDP和KH550为复合改性剂,对Mg(OH)2表面进行湿法改性,探讨其较佳改性工艺条件下复合改性的效果,并对环氧树脂的阻燃性能进行测试。
2 实 验
2.1 试剂与材料
氢氧化镁(美国雅宝公司,工业级),十二烷基磷酸酯(武汉远成共创科技有限公司,化学纯),KH550硅烷偶联剂(上海阿拉丁生化科技股份有限公司,化学纯),E-51环氧树脂(南通星辰合成材料有限公司,工业级),2-乙基-4-甲基咪唑(上海思言生物科技有限公司,分析纯),无水乙醇(天津永晟精细化工有限公司,分析纯)。
2.2 仪器设备
DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);GZX-9030 MBE数显鼓风干燥箱(上海博讯实业有限公司医疗设备厂);循环水式多用真空泵SHB-IIIT(上海豫康科教仪器设备有限公司);YP-2压片机(上海山岳科学仪器有限公司);JC2000C1型接触角测量仪(上海中晨数字技术有限公司);D/max-2500/pc型X射线衍射仪(日本理学公司,测试条件:Cu靶(λ=0.15406 nm),扫描速度为5°/min,范围为5°~80°);Nicolet 6700型傅里叶红外光谱仪(美国Thermo Fisher公司,采用KBr压片,红外波数范围为4000~400 cm-1);JSM-6610型扫描电子显微镜(上海铸金分析仪器有限公司);STA449F3型同步热分析仪(德国 NETZSCH公司,氮气环境下升温速率10 ℃/min,温度范围为30~800 ℃);JF-6型氧指数测定仪(南京炯雷仪器设备有限公司)。
2.3 实验方法
2.3.1 Mg(OH)2改性的制备
将Mg(OH)2置于干燥箱中于110 ℃下干燥10 h,冷却至室温备用。称取一定质量的KH550,滴加一定体积的90%乙醇水溶液,搅拌30 min,备用。再称取与KH550成一定比例的DDP溶解于一定体积的去离子水中。称取12 g Mg(OH)2加入去离子水中配成5%的料浆,在磁力搅拌器中加热搅拌10 min,依次滴入KH550和DDP溶液,在40 ℃下搅拌30 min。反应完成后冷却至室温并过滤,分别用水和乙醇进行洗涤5次,得滤饼于110 ℃下干燥10 h,自然冷却至室温。再将滤饼研磨至粉状,过200目筛网,得Mg(OH)2粉状物。
2.3.2 阻燃环氧树脂的制备
称取70 g EP,加入30 g改性或未改性的Mg(OH)2,室温下机械搅拌30 min,再加入5.6 g固化剂2-乙基-4-甲基咪唑,继续搅拌5 min,将上述混合物置于60 ℃的真空干燥箱中除气泡40 min,再倒入放有脱模材料的模具中,在70 ℃下固化1 h,升温到150 ℃后再固化4 h,即得到复合材料。
2.4 性能测试方法
2.4.1 活化指数测定方法
称取1 g改性前后Mg(OH)2粉体,放入盛有150 mL去离子水的250 mL分液漏斗中,剧烈震荡3 min,静置24 h,放出漏斗底部样品,过滤,滤饼于110 ℃下干燥10 h,冷却至室温后称重。由此计算得活化指数H为:
2.4.2 水接触角测定方法
用25 MPa压力将粉体样品压制成饼状,测定改性前后Mg(OH)2水的接触角。同一条件下测量3次,取平均值。
2.4.3 氧指数测定方法
根据ASTMD2863-2000标准测试氧指数,样品尺寸为130 mm×6.5 mm×3 mm,每组测5个样条。
3 结果与讨论
3.1 不同改性条件下的活化指数分析
3.1.1 复合改性剂DDP/KH550不同配比对活化指数的影响
在改性时间、改性温度和复合改性剂量分为30 min、40 ℃和3wt%的条件下,改变DDP和KH550的配比(见表1),观察不同改性剂配比对Mg(OH)2活化指数的影响。由图1可见,未改性的Mg(OH)2活化指数为0,随着DDP/KH550比例的增大,活化指数先增大后减小,当DDP/KH550之比为7∶3时,活化指数达到最大,为92.83%。
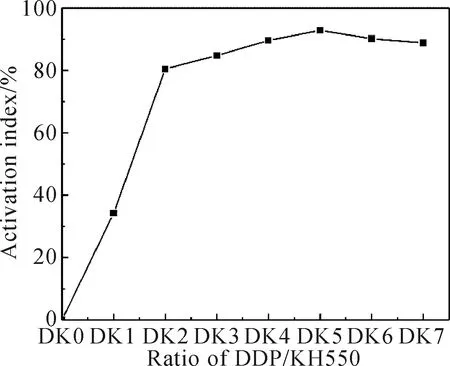
图1 不同配比复合改性剂对Mg(OH)2活化指数的影响Fig.1 The influence of different ratio of composite modifiers on Mg(OH)2 activation index
3.1.2 不同的改性剂量对活化指数的影响
在复合改性剂配比、改性时间和改性温度分别为7∶3、30 min和40 ℃恒定的条件下,改变改性剂量,观察Mg(OH)2的改性效果。由图2可见,随着复合改性剂总量的增加,活化指数呈先增大后减小趋势。复合改性剂用量为Mg(OH)2质量的3wt%时,活化指数达到最大为93.16%。再增加复合改性剂用量时,活化指数略有减小。这是因为改性剂量较小时,Mg(OH)2表面改性不完全,所以活化指数很小,当改性剂用量为3wt%时,Mg(OH)2表面已经完全被改性剂所包覆,改性效果较好,活化指数也最大。再继续增大改性剂含量时,由于改性剂之间的相互作用会影响Mg(OH)2的改性,使得活化指数变小。
3.1.3 反应时间对活化指数的影响
固定复合改性剂配比、改性剂用量和反应温度分别为7∶3、3wt%和40 ℃的条件下,观察反应时间对Mg(OH)2改性效果的影响。由图3可知,随着反应时间的增加,活化指数先增大后降低,反应时间为60 min时,改性效果达到最优。原因是改性时间较短时,改性剂没有完全与Mg(OH)2的表面反应,此时有一部分Mg(OH)2没有参加反应,所以活化指数较低。当改性时间为60 min时,活化指数达到最大,改性效果最优,而再延长改性时间则会由于剧烈搅拌使得作用在Mg(OH)2表面的改性剂部分脱落,从而影响改性效果。
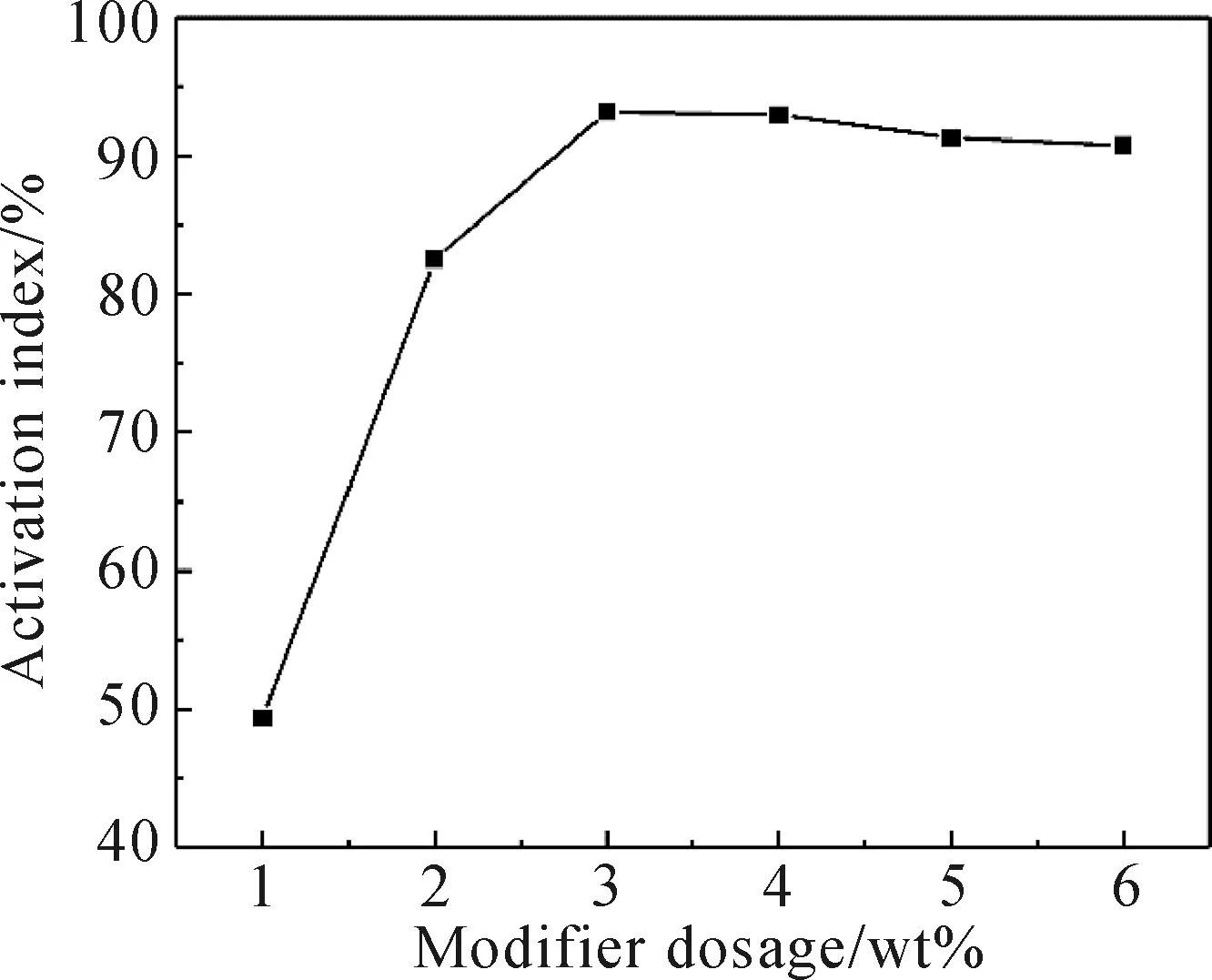
图2 复合改性剂用量对Mg(OH)2活化指数的影响Fig.2 The influence of the dosage of composite modifiers on Mg(OH)2 activation index
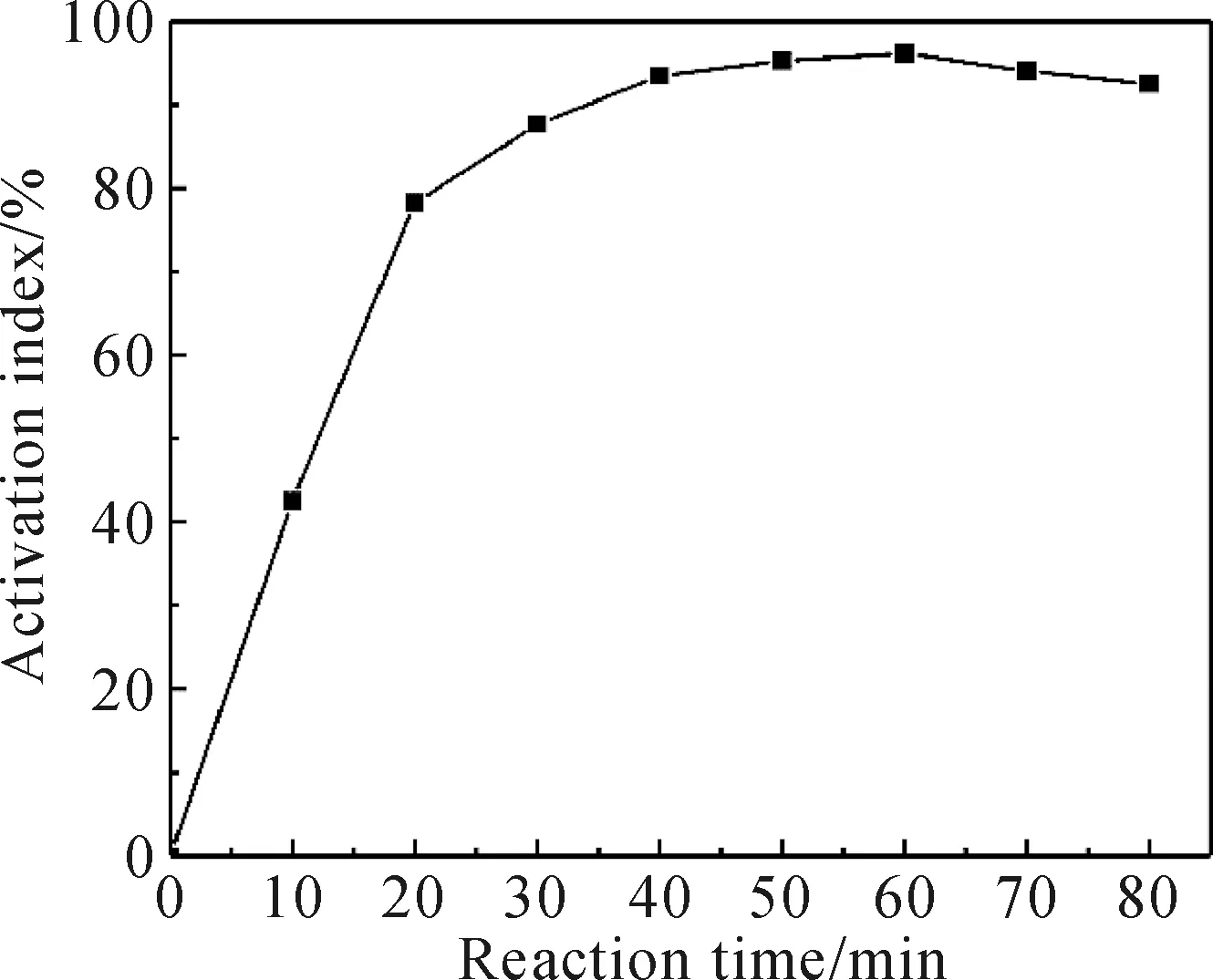
图3 反应时间对Mg(OH)2活化指数的影响Fig.3 The influence of reaction time on Mg(OH)2 activation index
3.1.4 反应温度对活化指数的影响
固定复合改性剂配比、改性剂量和反应时间分别为7∶3、3wt%和60 min的条件下,考察反应温度对改性效果的影响(图4)。从图4曲线可以得出,Mg(OH)2改性效果随着温度的升高先增大后减小。在反应温度为50 ℃时,活化指数达到最高,表明此时Mg(OH)2表面改性效果最好。温度低于50 ℃时,随着温度的升高,活化指数逐渐增大,说明反应处于吸热状态,温度越高越有利于反应进行,改性效果越好。当温度高于50 ℃时,反应速率小于解吸速率,Mg(OH)2的表面包覆量减小,改性效果降低。所以当温度为50 ℃时,活化指数最高,为99.04%。
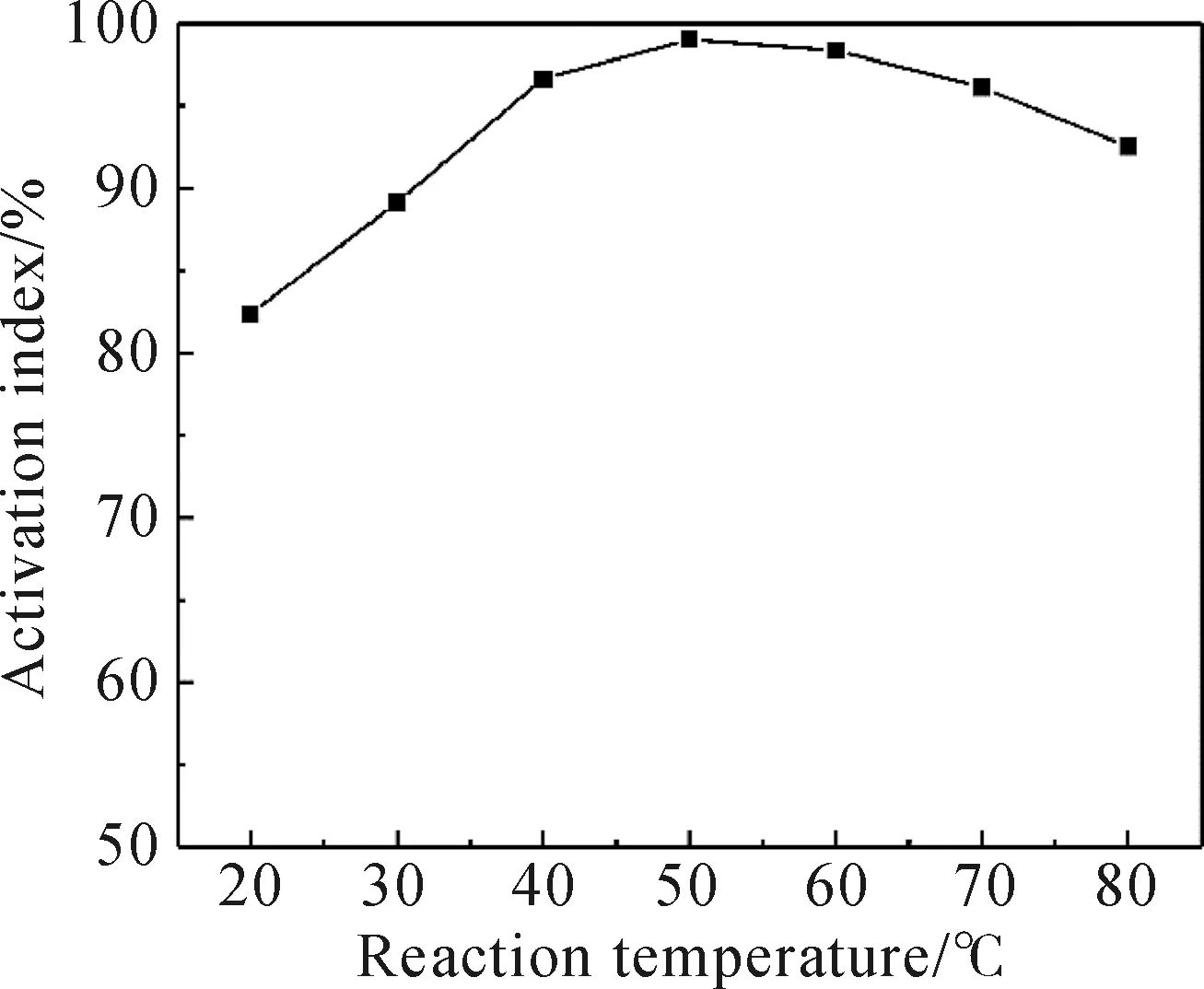
图4 反应温度对Mg(OH)2活化指数的影响Fig.4 The influence of reaction temperature on Mg(OH)2 activation index
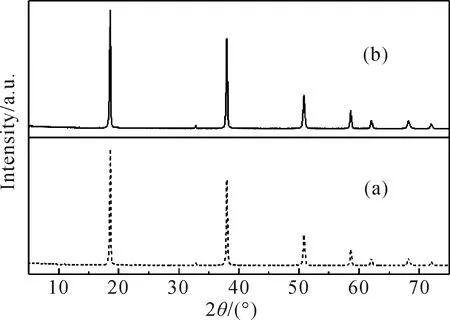
图5 改性前(a)后(b) Mg(OH)2的图谱Fig.5 XRD patterns of (a) unmodified magnesium hydroxide and (b) modified Mg(OH)2
3.2 物相分析
图5的(a)和(b)分别为改性前后的Mg(OH)2的XRD图谱,可以看出,未改性Mg(OH)2与改性Mg(OH)2两者对应的衍射曲线没有发生变化,改性之后的Mg(OH)2也没有出现新的衍射峰。说明改性后的Mg(OH)2与未改性的Mg(OH)2内部晶体结构一致,改性剂只是作用在Mg(OH)2的表面。
3.3 形貌和水接触角分析
图6的(a)和(b)分别为改性前后的Mg(OH)2样品的SEM照片。由图6(a)可以看出,许多六角片状的Mg(OH)2堆叠在一起,团聚现象严重,分散性极差。而图6(b)中复合改性剂改性后的Mg(OH)2,团聚现象得到明显改善,同时其分散性也有所提高。以上现象的变化是因为原始的Mg(OH)2表面能高,需要通过彼此吸附来降低表面能,导致出现Mg(OH)2团聚严重现象。而通过有机试剂改性后的Mg(OH)2,其表面能降低,从而使得Mg(OH)2团聚现象得到改善,分散性提高。
图7为改性前后Mg(OH)2的水接触角测试结果,未改性的Mg(OH)2(图7(a))的水接触角为9.05°,说明其具有很强的亲水性,表面极性大,极易团聚。改性之后Mg(OH)2的水接触角(图7(b))为113.92°,说明此时Mg(OH)2表面由亲水性变为疏水性,极性变小,分散性得到改善。

图6 改性前(a)后(b) Mg(OH)2的SEM照片Fig.6 SEM images of (a) unmodified Mg(OH)2 and (b) modified Mg(OH)2

图7 改性前(a)后(b) Mg(OH)2的水接触角Fig.7 Water contact angle images of (a) unmodified Mg(OH)2 and (b) modified Mg(OH)2
3.4 红外光谱分析
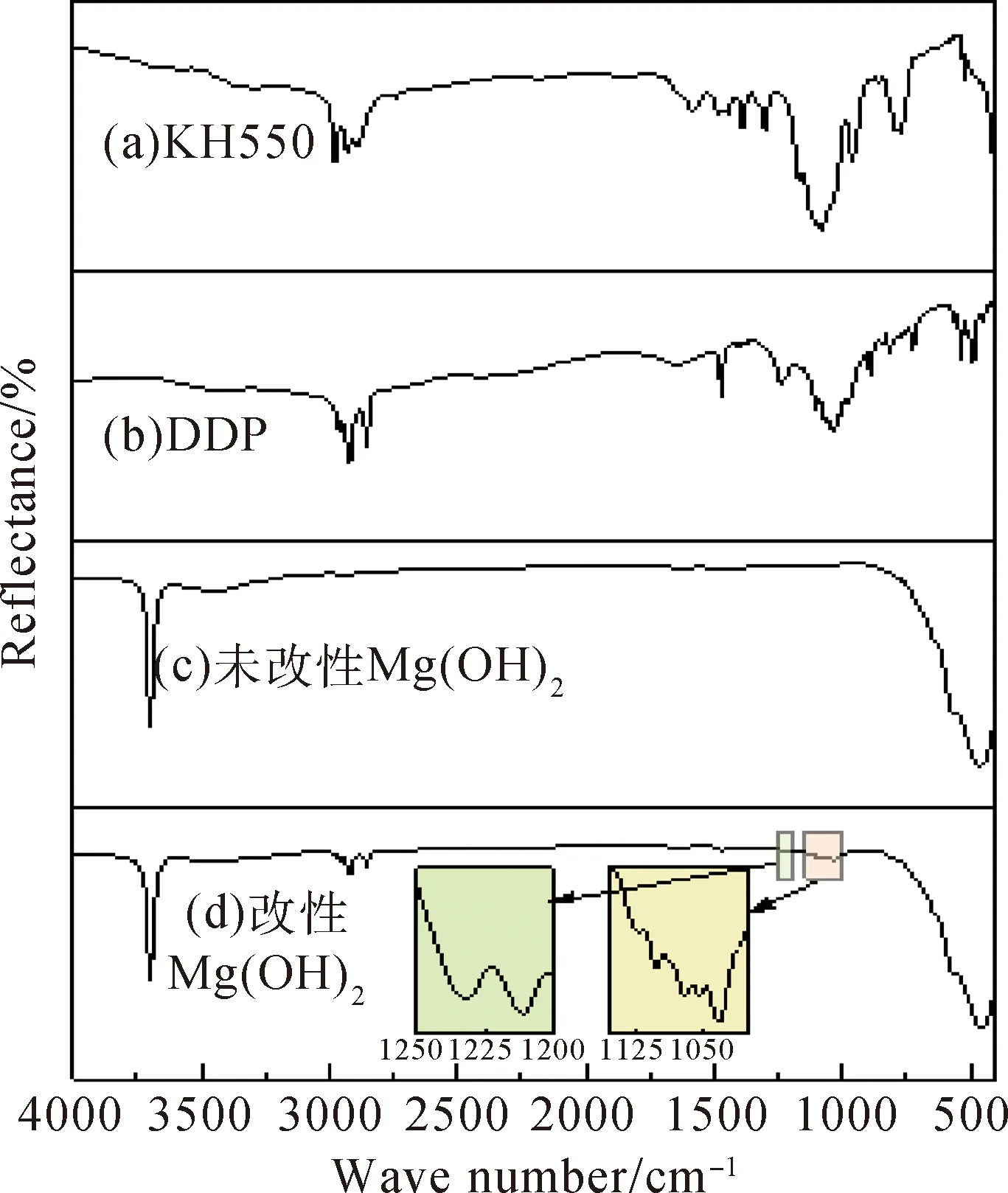
图8 红外光谱分析Fig.8 FT-IR spectra analyze
图8中的(a)、(b)、(c)、(d)曲线分别为KH550、DDP、未改性Mg(OH)2、改性Mg(OH)2的红外光谱。曲线(c)中,在3692.93 cm-1处的强峰是由Mg(OH)2的-OH振动吸收引起,Mg-O的吸收峰出现在459.42 cm-1处。曲线(d)中,除了与原始Mg(OH)2曲线基本吻合外,改性后的Mg(OH)2在2953.30 cm-1、2916.84 cm-1、2850.94 cm-1处出现了-CH3和-CH2的不对称和对称伸缩振动吸收峰,说明改性剂已通过物理或化学吸附作用在Mg(OH)2中,但无法确定KH550和DDP是同时作用还是其中一个与之发生作用。对曲线(d)进一步观察,1100.65 cm-1处出现的是Si-O-C中Si-O键伸缩振动峰,在1051.87 cm-1和1073.13 cm-1出现的吸收峰是KH550水解形成的Si-O-Si伸缩振动峰和生成的Si-O-Mg振动峰,这些特征峰与KH550特征峰相比,发生了微小的偏移,表明硅烷偶联剂KH550成功地与Mg(OH)2表面的-OH发生了化学反应。另外,由(b)和(d)曲线对比可知,改性后的Mg(OH)2,在1031.99 cm-1和1235.23 cm-1分别对应的吸收峰是P-O-C键和P=O键,同时在2402.00 cm-1处DDP的PO-OH中的-OH键消失,曲线(d)中3692.93 cm-1处的-OH振动吸收峰相比曲线(c)处的吸收峰而言明显减弱,表明Mg(OH)2的-OH与DDP中的P=O-OH发生了反应,形成了P-O-Mg键。
3.5 TGA-DSC分析
图9为改性前后Mg(OH)2的TGA曲线,从9(a)谱图看出,未改性Mg(OH)2在351.2 ℃时开始失重,在391.1 ℃时失重完全,失重率为31.43%。而改性后的Mg(OH)2起点和终点的分解温度分别为369.6 ℃和414.5 ℃,失重率为31.04%(图9(b)),表明经过改性的Mg(OH)2在较高温度下发生吸热降解,使得热稳定性明显高于原始Mg(OH)2,这可能是因为改性后的Mg(OH)2表面有机层受热炭化而引起,同时也有利于改善高分子材料的热稳定和阻燃性能。由图10的DSC曲线中可以看出,改性后Mg(OH)2(图10(b))的吸热峰明显比未改性的Mg(OH)2(图10(a))尖锐,这是经过复合改性剂改性后,Mg(OH)2分散性变好,颗粒分布变得更加均匀的结果。通过计算两者之间的吸热峰峰面积,改性后Mg(OH)2的吸热量为884.8 J/g,而未改性Mg(OH)2的吸热量为837.0 J/g,相比较,改性过的Mg(OH)2比未改性的Mg(OH)2吸热量增加了47.8 J/g,说明改性后的Mg(OH)2吸热焓增大,热稳定性提高,相应地阻燃性能也增强。
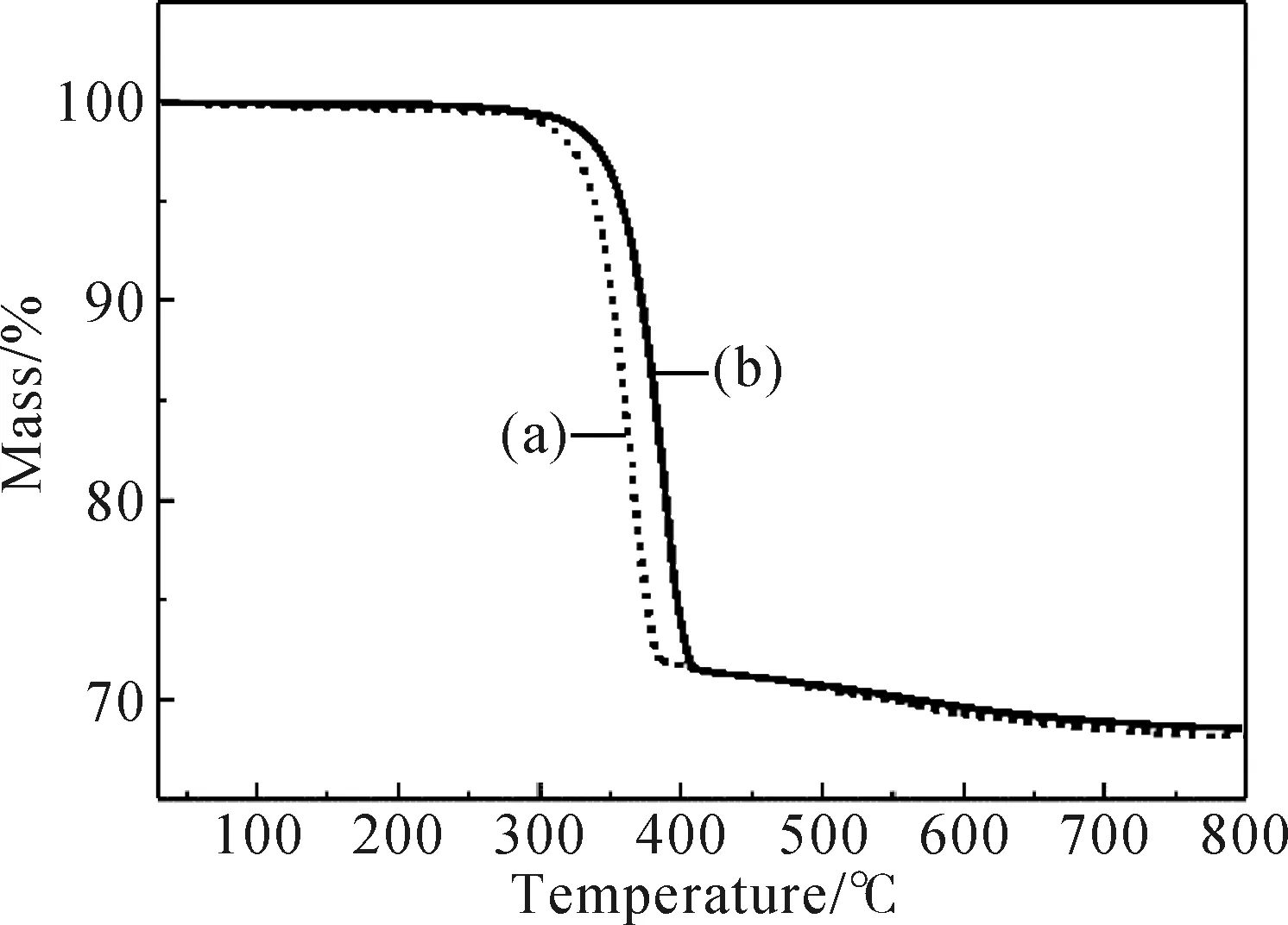
图9 改性前(a)后(b) Mg(OH)2的TGA曲线Fig.9 TGA curves of (a) unmodified Mg(OH)2 and (b) modified Mg(OH)2
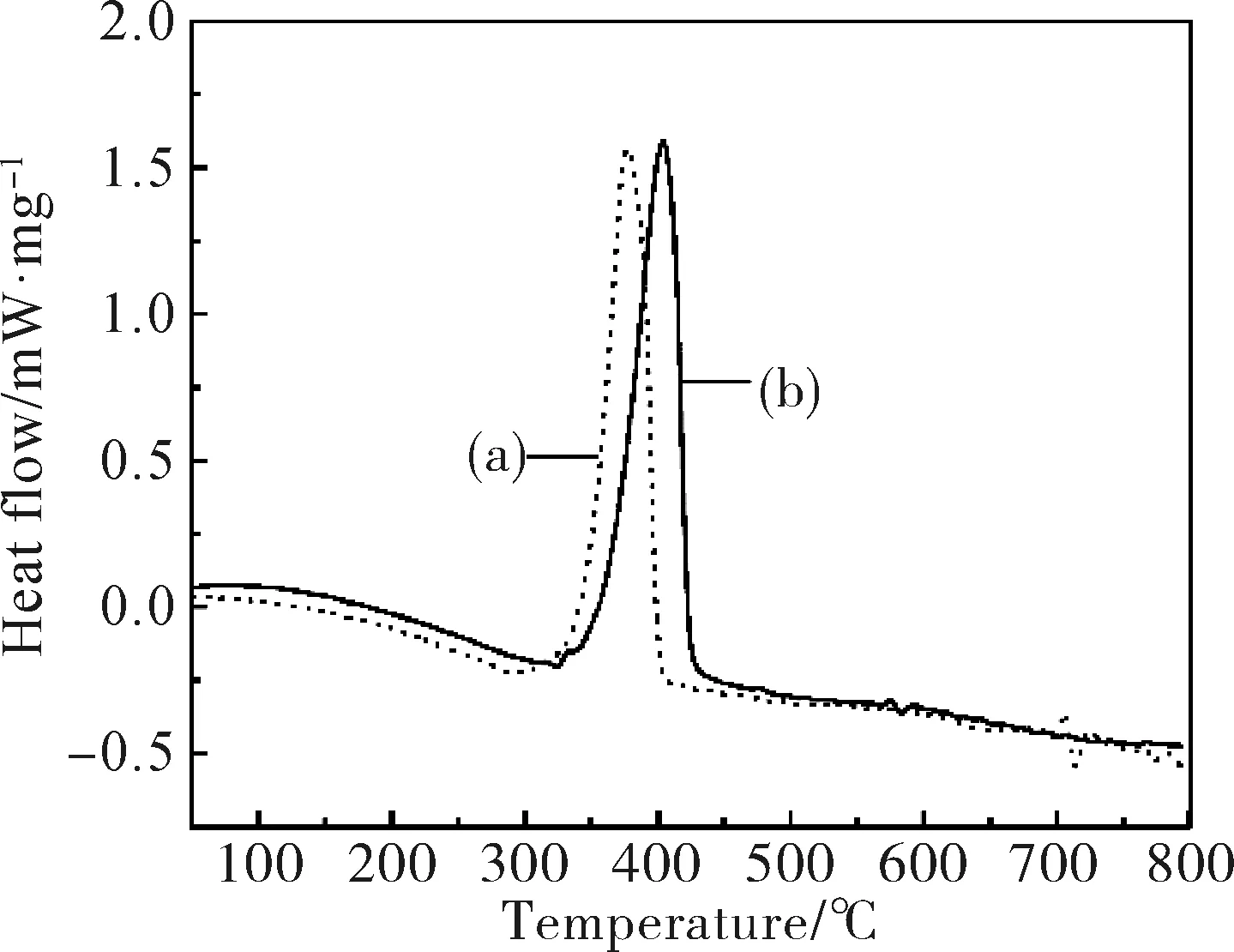
图10 改性前(a)后(b) Mg(OH)2的DSC曲线Fig.10 DSC curves of (a) unmodified Mg(OH)2 and (b) modified Mg(OH)2
3.6 改性前后Mg(OH)2在EP中的阻燃性能分析
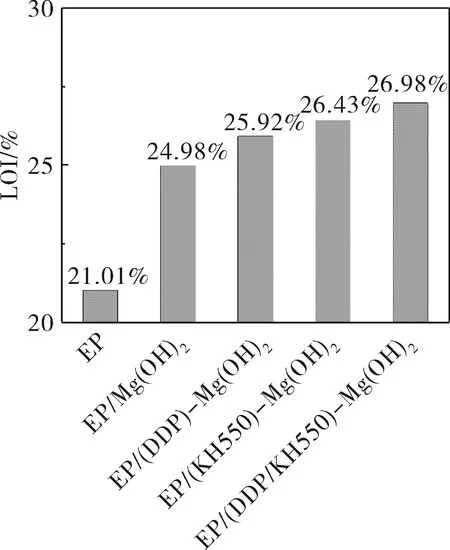
图11 不同改性条件下Mg(OH)2与EP复合材料的极限氧指数Fig.11 LOI of composites of Mg(OH)2under different modification conditions and EP
Mg(OH)2/EP复合材料制备配方见表2。通过氧指数测试可知(图11),纯EP的LOI值为21.01%,极易燃烧;添加30%未改性的Mg(OH)2后,EP的LOI值增加到24.98%,说明Mg(OH)2对其具有阻燃效果。当添加相同量DDP、KH550和DDP/KH550改性的Mg(OH)2后,EP的LOI值依次为25.92%、26.43%和26.98%,与添加未改性的Mg(OH)2相比,阻燃性能都有些提升。这是由于未改性的Mg(OH)2与EP的界面相容性差,在EP中分布不均匀,使得EP局部区域极易燃烧,LOI值较低;经KH550改性后,KH550上的氨基可以与环氧树脂的环氧基键合,加上KH550本身含有阻燃功能的N元素,致使EP/(KH550)-Mg(OH)2的LOI明显提升;经DDP改性的Mg(OH)2,其在EP中分散性及其之间的相容性都会得到改善,加上DDP本身含有阻燃功能的P元素,EP/(DDP)-Mg(OH)2的LOI值也会得到明显提高;而经KH550和DDP改性的Mg(OH)2,会综合两种改性剂的优势。因此,EP/(DDP/KH550)-Mg(OH)2的LOI值是最高的。

表2 阻燃环氧树脂的制备Table 2 Preparation of flame-retardant epoxy resin
3.7 Mg(OH)2改性机理研究
通过上述实验数据分析,进一步探讨复合改性剂对Mg(OH)2改性的反应机理。KH550在乙醇水溶液中发生一系列变化,它先水解生成活泼的硅醇(图12(a)),然后硅醇中的-OH之间缩合脱水成硅烷低聚物(图12(b))。再结合FT-IR结果,可以认为DDP/KH550对Mg(OH)2表面共同改性的机理为(图13):复合改性剂中KH550的Si-OH与Mg(OH)2表面上的-OH反应形成氢键,脱去水分子形成Si-O-Mg;通过水溶液溶解的DDP中P=O-OH与Mg(OH)2表面的-OH反应形成氢键,生成P-O-Mg键。完全反应后即形成表面带有非极性基团的Mg(OH)2。通过改性,Mg(OH)2表面的疏水性提高,分散性得到改善,能更好的分散在高分子材料中,实现其优异的阻燃性能。
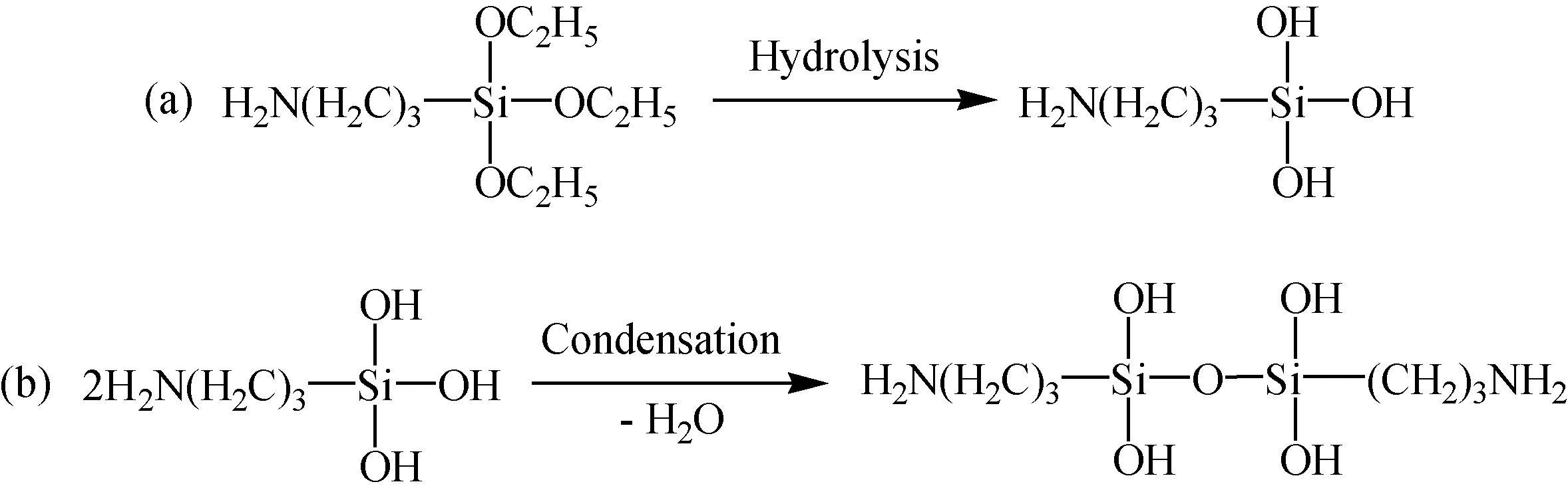
图12 KH550在乙醇水溶液中的作用机理Fig.12 Mechanism of KH550 in aqueous ethanol solution
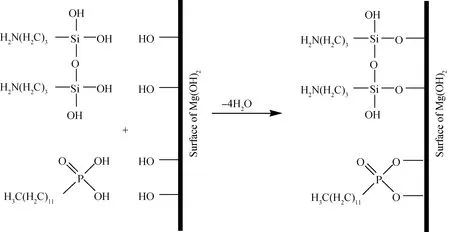
图13 DDP/KH550表面改性Mg(OH)2的机理Fig.13 The modification mechanism of DDP/KH550 on surface of Mg(OH)2
4 结 论
采用复合改性剂DDP/KH550对Mg(OH)2进行改性,当改性剂配比为7∶3、改性剂用量为3wt%、反应时间为60 min,反应温度为50 ℃时,改性效果最佳。
经活化指数和水接触角测试,得出改性之后的Mg(OH)2的活化指数最高可达99.04%、水接触角为113.92°,说明经复合改性后的Mg(OH)2表面极性降低,疏水性增强,利于其阻燃效果的提升。
XRD、SEM、FT-IR、TGA-DSC对改性前后Mg(OH)2的进行表征,结果表明复合改性剂既没有破坏Mg(OH)2的晶体结构,又作用于Mg(OH)2表面,使Mg(OH)2表面由亲水疏油性变为亲油疏水性,分散性得到了改善,能够更好的与EP结合。同时,改性后的Mg(OH)2热稳定性和阻燃性能也优于未改性氢氧化镁。
通过对Mg(OH)2复合改性,可使高分子材料与之更好的结合,发挥其优异的阻燃性能。因此,该方法为工业生产更优异的阻燃材料,提供了实验基础。
