抗肉桂醛益生菌的筛选、鉴定和益生特性评价
2019-10-18蒋溥王竞儒王庆奎谢体彪刘桐朱鹏锦王洋
蒋溥 王竞儒 王庆奎 谢体彪 刘桐 朱鹏锦 王洋


摘要:为了筛选适合添加于含肉桂醛饲料的水产益生菌,从饲喂肉桂醛的半滑舌鳎肠道中筛选5株芽孢杆菌,同时选用笔者所在实验室保存的35株潜在益生菌,以定性定量法筛选具有高水解酶活性且抗肉桂醛的菌株并鉴定。通过福林-酚法、3,5-二硝基水杨酸法定量测定各菌株的蛋白酶、淀粉酶和纤维素酶活性;进一步以生长抑制法确定各菌株耐受肉桂醛的能力,以16S rDNA序列鉴定优势菌株。结果表明,9种芽孢杆菌具有较强的益生特性,其中菌株 1-D 的蛋白酶活性最强,为(10.137±0.046) U/mL,菌株8-D的淀粉酶活性最强,为(5.739±0.018) U/mL,菌株 9-D 的纤维素酶活性最强,为(63.436±0.006) U/mL,且这9株菌分别属于枯草芽孢杆菌和地衣芽孢杆菌,最高能够耐受浓度为 2.5 μmol/mL 的肉桂醛。研究筛选的菌株,有作为益生菌应用于含肉桂醛饲料的潜力。
关键词:肉桂醛;芽孢杆菌;筛选鉴定;益生菌;益生特性
中图分类号: S182
文献标志码: A
文章編号:1002-1302(2019)15-0200-05
肉桂醛(三苯基丙稀醛)具有防腐杀菌[1-2]、抗炎[3]、抗癌[4]等作用,作为抗生素替代物,已被广泛应用于畜禽养殖中[5]。近年来,肉桂醛在水产饲料中的应用也取得了理想的效果。然而,由于肉桂醛对各类微生物具有广谱抑制能力[6],在对抗病原菌的同时,也会降低益生菌的数量[7],因此可能影响肠道菌群平衡。但也有报道认为,肉桂醛可促进有益菌的增殖,改善肠道形态结构,提高营养物质消化率及肉鸡的免疫力[8]。笔者所在实验室前期研究发现,饲料中添加了肉桂醛后改变了半滑舌鳎的肠道菌群结构,降低了部分益生菌的比例。
水产益生菌是通过人为筛选扩增,添加于水产饲料或水体中,以改善水产品健康状态的微生态制剂。目前,已知的水产益生菌主要有乳酸菌[7]、芽孢杆菌[9]、酵母菌[10]、光合细菌、放线菌等。芽孢杆菌作为目前应用范围最广的益生菌,其作用机制多种多样,包括分泌消化酶类、产生抗菌物质、与病原菌竞争营养和位点、影响免疫系统、调节过敏反应等。尤其是芽孢杆菌能够提高水产动物对饲料中碳水化合物[11]、蛋白质和脂肪[12]的利用率,显著改善水产动物的生长性能[13]。本研究拟从益生芽孢杆菌中筛选出具有高产消化酶活性,且对低浓度肉桂醛具有一定抗性的益生菌,为益生菌与肉桂醛的联合应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 芽孢杆菌菌种 芽孢杆菌菌株40株(其中5株分离自饲喂肉桂醛饲料的半滑舌鳎肠道,其余分离自各种生境),保藏于天津农学院水产学院天津市水产生态及养殖重点实验室。
1.1.2 试验试剂 肉桂醛[含量≥95%,酸值≤3 mg/g(以KOH计),相对密度1.047~1.051,折光率1.618~1.623],购于上海润捷化学试剂有限公司。
吐温80、乙酸乙酯、无水乙醇、酪氨酸、麦芽糖、葡萄糖均为分析纯,由国药集团化学试剂有限公司提供。
LB培养基配方(1 L溶液中):胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g。
1.1.3 主要仪器设备 SHP-250型微生物生化培养箱,上海三发科学仪器有限公司;SW-CJ-1D型净化工作台,苏州净化设备有限公司;MLS-3780高压蒸汽灭菌锅,日本Sanyo公司;HZQ-F160全温摇床,哈尔滨东联电子科技开发有限公司;UV-3000双光束分光光度计,日本岛津公司。
1.2 芽孢杆菌产酶活性的定性定量测定
1.2.1 酶活性的定性检测 (1)蛋白酶活性定性测定。配制产蛋白酶培养基(1 L):蛋白胨5.0 g,酵母浸粉25.0 g,磷酸氢二钾0.3 g,七水合硫酸镁0.5 g,氯化钠1.0 g,琼脂 20.0 g,加水800 mL,pH值6.8~7.2,121 ℃ 15 min;脱脂乳200 mL(按8.4 g定容至100 mL的比例配制,氮含量相当于原奶,代替酪蛋白)110 ℃ 20 min。以产蛋白酶培养基制备平板,在平板上点种0.5 μL芽孢杆菌菌液,37 ℃倒置培养48 h后,以游标卡尺测定透明圈直径和菌落直径。
(2)淀粉酶活性定性测定。配制产淀粉酶培养基(1 L):可溶性淀粉10 g,酵母浸粉25 g,磷酸氢二钾0.3 g,七水合硫酸镁0.5 g,氯化钠1 g,琼脂20 g,pH值自然。操作方法:以产蛋白酶培养基制备平板,在平板上点种0.5 μL芽孢杆菌菌液,37 ℃倒置培养48 h后加入稀释100倍的卢戈氏碘液,以游标卡尺测定透明圈直径和菌落直径。
(3)纤维素酶活性定性测定。配制产纤维素酶培养基(1 L):蛋白胨10 g,酵母浸粉10 g,羧甲基纤维素钠10 g,氯化钠 5 g,磷酸氢二钾1 g,琼脂20 g,pH值自然。以产蛋白酶培养基制备平板,在平板上点种0.5 μL芽孢杆菌菌液,37 ℃倒置培养36~48 h后倒入1 mg/mL刚果红染色剂染色1 h,之后用1 mol/L氯化钠溶液浸泡15 min,以游标卡尺测定透明圈直径和菌落直径。
1.2.2 酶活性的定量检测 菌株在LB培养基中(37 ℃)培养12 h后,对培养液进行离心(8 000 r/min、1 min),取其上清液,通过福林-酚法[14]对蛋白酶进行定量检测,通过3,5-二硝基水杨酸(DNS)法[15]对淀粉酶进行定量检测。通过DNS法[16]对纤维素酶进行定量检测。
1.3 高产酶活芽孢杆菌抗肉桂醛特性
收集各菌株的对数期菌体(培养8 h为对数期菌体),分别接种至LB液体培养基中摇匀,使得最初活菌数约为 107 CFU/mL(1%接种量)。
配制1 mmol/mL肉桂醛(摩尔质量为132.16 g/mol)溶液:称取纯度为100%的肉桂醛1.321 6 g,加入10 mL吐温的乳化体系[17](吐温80、乙酸乙酯、无水乙醇质量分别为 1.321 6、0.660 8、0.660 8 g),乳化均匀。配制系列肉桂醛稀释溶液,浓度分别为1、10、25、50 μmol/mL。同时以相同方法制备不含肉桂醛的溶液,作为溶剂对照。
将上述菌液用LB培养基使活菌数稀释到约为 106 CFU/mL,无菌操作下(全程在超净台中)加入96孔细胞培养板,每孔90 μL。加入浓度分别为1、10、25、50 μmol/mL的肉桂醛溶液10 μL,使菌液中肉桂醛的浓度分别为0.1、1、2.5、5 μmol/mL,另外设置阴性对照组(仅菌液+不含肉桂醛的溶液)、阳性对照组(仅LB培养基+不含有肉桂醛的溶液),每株菌设置3个平行。
将96孔板小心平放至37 ℃培养箱中。培养12 h,取出用酶标仪测定D600 nm。根据D600 nm下降情况,判断菌株对肉桂醛的耐受浓度。
1.4 高产酶活芽孢杆菌的鉴定
通过筛选获得高酶活菌株,测定16S rDNA的序列,確定其分类地位。
2 结果与分析
2.1 酶活性的定性测定
从实验室保存的益生菌资源中,筛选蛋白酶活性高的芽孢杆菌菌株。由表1可知,所测试的40株芽孢杆菌中,22株菌在蛋白酶培养基上产生了明显的溶解圈,其中6株菌的蛋白酶溶解圈直径与菌落直径比值达到了1.5~2.5,其余16株菌的蛋白酶溶解圈直径与菌落直径比值为1.0~1.5。蛋白酶活性最高的3株芽孢杆菌编号分别为3-D、34-D和 14-D。菌株3-D的溶解圈直径与菌落直径比值最大,达230±0.20。据报道,芽孢杆菌蛋白酶溶解圈直径与菌落直径比值达到2.00~3.00[18],即表明菌株产蛋白酶的能力较强,提示菌株3-D属于高蛋白酶活性菌株。在应用于水产养殖时,芽孢杆菌可直接分泌蛋白酶,提高饲料的降解和吸收,并起到净水肥水的功效[19]。因此,本研究筛选得到的高蛋白酶活性菌株,应用于水产养殖可能有利于降低饵料系数,改善养殖水质。
淀粉是水产饲料中重要的能量物质之一,因此具有高淀粉酶活性的菌株,有利于提高水产动物对饲料中淀粉的利用效率。由表2可知38株潜在益生芽孢杆菌的淀粉酶活性,其中13株菌的淀粉酶溶解圈直径与菌落直径比值为1.5~25,其余25株菌的淀粉酶溶解圈直径与菌落直径比值为 0.9~1.5。淀粉酶活性最高的3株编号分别为 7-D、8-D和5-D。菌株7-D的溶解圈直径与菌落直径比值最大,为2.05。与其他文献中报道的高产淀粉酶芽孢杆菌活性相似[20]。产淀粉酶益生菌对中华绒螯蟹生长性能和肠道消化酶活性有不同程度的促进作用,中、低剂量活菌不仅能显著提高水产动物的增质量率、肠道淀粉酶和蛋白酶活性,还能提高水产动物的免疫力和抗病力,这可能与菌株所发挥的其他益生功能有关[21]。
表3中列出了所有芽孢杆菌中纤维素酶活性较高的32株菌,其中15株菌的纤维素酶溶解圈直径与菌落直径比值在 2~4间,17株菌的纤维素酶溶解圈直径与菌落直径比值在 1~2 间。纤维素酶活性最高的3株芽孢杆菌分别为 6-D、1-D 和9-D。菌株6-D的溶解圈直径与菌落直径比值达到了3.88±0.30,显著高于其他文献中报道的数值 2.277±0.109 8[22],表明本研究的菌株属于高产纤维素的菌株。纤维素酶可特异性地降解纤维素,从而提高禽类对饲料中粗纤维的消化率[23]。在基础日粮中添加0.05%、0.10%、0.20%纤维素酶,鲤鱼的增质量率较对照组分别提高了32.97%、39.11%和37.70%,饵料系数分别降低了 8.28%、8.88%和8.88%, 与对照组差异显著 (P<0.05)[24], 说明纤维素酶能
促进水产动物肠道蠕动,刺激内源消化酶分泌,提高水产动物对营养物质的消化率,提升水产动物的健康状态,在水产养殖中有广阔的应用前景。
2.2 酶活性的定量测定
综合蛋白酶、淀粉酶和纤维素酶定性结果,选取酶活性较高的9株菌(1-D,2-D,3-D,4-D,5-D,6-D,7-D,8-D,9-D),定量测定其酶活性。由图1可知,其中菌株1-D和2-D的酶活性最强,依次为(10.137±0.046)、(9.66±0.022) U/mL。其余菌株活性为(6.028±0.018)~(0.396±0.006) U/mL。其他文献中报道,枯草芽孢杆菌BY7的蛋白酶活性可达到43.28 U/mL[19]。可见本研究中的菌株蛋白酶活性并不高,可能与菌株培养基的差异有关。蛋白质是水产动物饲料中最重要的成分之一,然而饲料中蛋白质的利用率却很低,造成了极大的浪费。且未被消化利用的蛋白质随着粪便排放到水体中,造成了水质劣化,危害了水产动物的健康[25]。有许多研究发现,产蛋白酶的益生菌有利于提高水产动物对饲料中干物质、粗蛋白和粗脂肪的表观消化率[26],从而降低养殖成本,并且改善水质,符合健康生态养殖的理念。
由图2可知9株芽孢杆菌在LB培养基中的胞外淀粉酶活性,其中菌株8-D和4-D酶活性最强,依次为(5.739±0.018)、(5.416±0.009) U/mL。其余菌株活性为(4.823±0.027)~(1.163±0.001) U/mL。有报道发现,高产淀粉酶的芽孢杆菌在淀粉摇瓶发酵培养基中培养24 h后,胞外淀粉酶活性可达到2.01 U/mL[15]。可见本研究中菌株8-D和 4-D 酶活性较高。补充产胞外淀粉酶的芽孢杆菌,可以提高水产品消化道的淀粉酶活性,促进鱼体生长[27]。因此,本研究中菌株8-D和4-D可能具有促进水产动物生长的功效。
由图3可知,其中菌株9-D和5-D酶活性最强,依次为(63.436±0.006)、(61.887±0.002) U/mL。其余菌株活力为(30.225±0.005)~(17.272±0.003) U/mL。与其他报道相比,本研究的芽孢杆菌纤维素酶活性属于中等水平。据报道,高产纤维素的枯草芽孢杆菌Pab02纤维素酶活性高达 358.751 U/mL[28]。纤维素在水产动物饲料中的比例并不高,但对水产动物的营养和肠道调节作用不容忽视。益生菌在合成蛋白酶、淀粉酶的同时,还能产生纤维素酶,有利于降解饲料原料中的纤维素,促进水生动物对纤维素来源糖类物质的吸收利用。同时改善纤维素的状态,可能有利于肠道菌群平衡。
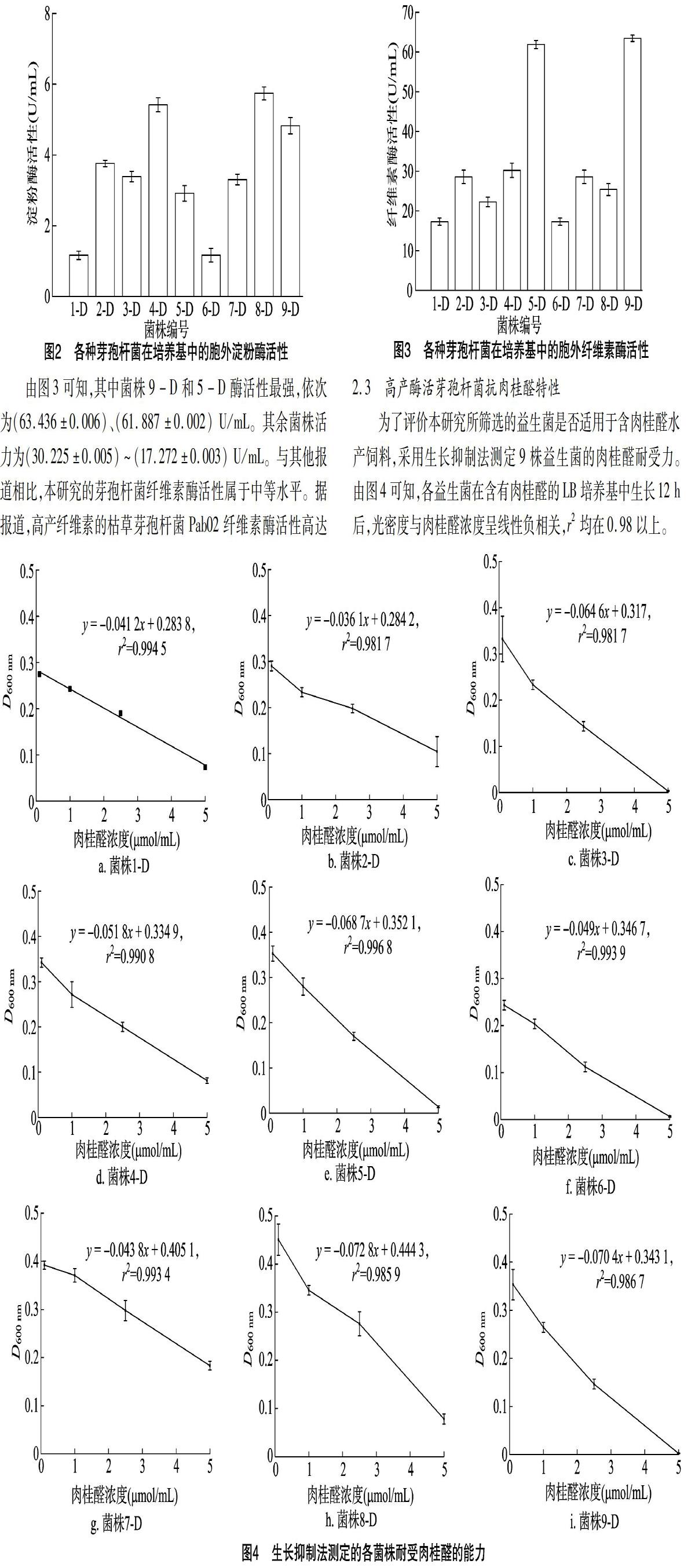
2.3 高產酶活芽孢杆菌抗肉桂醛特性
为了评价本研究所筛选的益生菌是否适用于含肉桂醛水产饲料,采用生长抑制法测定9株益生菌的肉桂醛耐受力。由图4可知,各益生菌在含有肉桂醛的LB培养基中生长12 h后,光密度与肉桂醛浓度呈线性负相关,r2均在0.98以上。
建立光照度与肉桂醛浓度的线性方程,计算各菌株在肉桂醛含量为2.5 μmol/mL(330.4 μg/mL)时的敏感性,菌株 9-D对肉桂醛最敏感,在2.5 μmol/mL浓度下D600 nm降低了51.30%,相比之下,菌株7-D在同样浓度的肉桂醛处理下最不敏感,菌体浓度仅下降了27.03%(其他芽孢杆菌D600 nm下降率分别为1-D 36.29%、2-D 31.76%、3-D 58.09%、5-D 48.78%、6-D 49.66%、8-D 40.96%、9-D 5130%)。另根据方程推算半数抑制浓度(D600 nm降低到不含肉桂醛时的50%),各菌株对肉桂醛的半数抑制浓度从高到低依次为8-D 0.222 2 μmol/mL、7-D 0.202 6 μmol/mL、5-D 0.176 1 μmol/mL、9-D 0.171 6 μmol/mL、4-D 0.167 5 μmol/mL、3-D 0.158 5 μmol/mL、2-D 0.142 1 μmol/mL、1-D 0.141 9 μmol/mL、6-D 0.123 4 μmol/mL。肉桂醛对多种细菌有抑制作用,但对不同种的菌抑制效果不同。据报道,肉桂醛能抑制人肺癌细胞系A-549细胞增殖,且呈剂量依赖性,IC50值为 2.72 μmol/mL[29]。还有报道显示,肉桂醛100%杀灭滋养体和感染性幼虫的剂量分别为50和8 mg/L,半数有效浓度分别为105.3 μmol/mL和13.64 μmol/mL;使用剂量在50 mg/L时可完全抑制小瓜虫包囊孵化[30]。因此在水产品养殖过程中,肉桂醛的使用量一般为10~1 000 mg/kg,本研究中的菌株对肉桂醛的抗性较强,推测将其添加于含肉桂醛的饲料中,可保持较好的活性,从而进入消化道发挥益生作用。
2.4 高产酶活且耐受肉桂醛芽孢杆菌的鉴定
通过测定各菌株的16S rDNA序列,并在美国国立生物技术信息中心(NCBI)数据库中进行比对,鉴定菌株2-D、5-D、6-D、7-D、8-D为枯草芽孢杆菌,菌株1-D、3-D、9-D 为地衣芽孢杆菌,菌株4-D为解淀粉芽孢杆菌。
3 结论
肉桂醛是从中草药肉桂中提取的一种脂溶性活性物质,具有较强的抗菌作用,是水产养殖中抗生素的理想替代品之一,不过肉桂醛可能会影响肠道内的益生菌数量。本研究筛选的芽孢杆菌对肉桂醛有一定的耐受力,同时具有较强的产胞外蛋白酶、淀粉酶、纤维素酶的活性,有作为益生菌应用于含肉桂醛饲料中,与肉桂醛互补,共同提高水产动物生长性能和抗病性的潜力。
参考文献:
[1]Viazis S,Akhtar M,Feirtag J,et al. Reduction of Escherichia coli O157:H7 viability on leafy green vegetables by treatment with a bacteriophage mixture and trans-cinnamaldehyde[J]. Food Microbiology,2011,28(1):149-157.
[2]Amalaradjou M A,Narayanan A,Baskaran S A,et al. Antibiofilm effect of trans-cinnamaldehyde on uropathogenic Escherichia coli[J]. Journal of Urology,2010,184(1):358-363.
[3]Tung Y T,Yen P L,Lin C Y,et al. Anti-inflammatory activities of essential oils and their constituents from different provenances of indigenous cinnamon (Cinnamomum osmophloeum) leaves[J]. Pharmaceutical Biology,2010,48(10):1130-1136.
[4]Cabello C M,Bair I W,Lamore S D,et al. The cinnamon-derived Michael acceptor cinnamic aldehyde impairs melanoma cell proliferation,invasiveness,and tumor growth[J]. Free Radical Biology and Medicine,2009,46(2):220-231.
[5]Upadhyaya I,Upadhyay A,Kollanoorjohny A,et al. In-feed supplementation of trans-cinnamaldehyde reduces egg-borne transmission of Salmonella enteritidis in layer chickens[J]. Applied & Environmental Microbiology,2015,81(9):2985-2994.
[6]Toranzo A E,Magarios B,Romalde J L. A review of the main bacterial fish diseases in mariculture systems[J]. Aquaculture,2005,246(1/2/3/4):37-61.
[7]Gatesoupe F J. Updating the importance of lactic acid bacteria in fish farming:natural occurrence and probiotic treatments[J]. Journal of Molecular Microbiology and Biotechnology,2008,14(1/2/3):107-114.
[8]劉 洋,臧素敏,李同洲,等. 肉桂醛对肉鸡肠道菌群、肠道结构及营养物质消化率的影响[J]. 中国畜牧杂志,2013,49(13):65-68.
[9]Hong H A,Duc L H,Cutting S M. The use of bacterial spore formers as probiotics[J]. FEMS Microbiology Reviews,2005,29(4):813-835.
[10]Vine N G,Leukes W D,Kaiser H. Probiotics in marine larviculture[J]. FEMS Microbiology Reviews,2006,30(3):404-427.
[11]Turnbaugh P J,Ley R E,Mahowald M A,et al. An obesity-associated gut microbiome with increased capacity for energy harvest[J]. Nature,2006,444(7122):1027-1031.
[12]Semova I,Carten J D,Stombaugh J,et al. Microbiota regulate intestinal absorption and metabolism of fatty acids in the zebrafish[J]. Cell Host & Microbe,2012,12(3):277-288.
[13]Sun Y Z,Yang H L,Ma R L,et al. Probiotic applications of two dominant gut Bacillus strains with antagonistic activity improved the growth performance and immune responses of grouper Epinephelus coioides[J]. Fish & Shellfish Immunology,2010,29(5):803-809.
[14]魏宜琴,赵学兰. 胃蛋白酶活力测定法的探讨[J]. 中国生化药物杂志,1991(2):74-76.
[15]陈 号,陆 雯,虞 婷,等. 淀粉酶高产菌株的诱变选育[J]. 农业科学研究,2010,31(1):26-28.
[16]张 海,冯成利,房兴莉. 饲料添加剂中纤维素酶活力的标准测定方法[J]. 质量指南,1995(4):37-38.
[17]张永帅. 肉桂醛微乳制备及其对革兰氏阳性菌抑菌机理研究[D]. 新乡:河南科技学院,2015.
[18]牛春华,高 岩,李玉秋,等. 紫外诱变选育高产蛋白酶枯草芽孢杆菌[J]. 中国酿造,2011,30(12):67-69.
[19]王晓云. 高产蛋白酶枯草牙孢杆菌的筛选与诱变选育研究[D]. 泰安:山东农业大学,2015.
[20]杨 慧,王振华,潘康成,等. 芽孢杆菌产淀粉酶活性的研究[J]. 现代农业科技,2007,2(2):90,93.
[21]郝向举. 中华绒螯蟹(Eriocheir sinensis)肠道益生芽孢杆菌(Bacillus)的筛选、生长特性及其应用效果研究[D]. 苏州:苏州大学,2010.
[22]吴敏峰. 产纤维素酶兼性厌氧芽孢杆菌的分离筛选及在动物生产上的初步应用[D]. 雅安:四川农业大学,2007.
[23]李 旺,孙二刚,刘永磊,等. 添加纤维素酶产生菌对鸡饲料养分消化率的影响[J]. 饲料博览,2013,5(5):1-4.
[24]王仁华. 浅谈纤维素酶在水产动物生产中的应用[J]. 饲料广角,2016,17:40-41.
[25]苗淑彦,王际英,张利民,等. 水产动物残饵及粪便对养殖水环境的影响[J]. 饲料研究,2009,2(2):64-67.
[26]曲 艺,吴志新,杨 丽,等. 饲料中添加芽孢杆菌对草鱼表观消化率及消化酶活性的影响[J]. 华中农业大学学报,2012,31(1):106-111.
[27]陈鹏飞,谭 斌. 芽孢杆菌对苗王云鲫淀粉酶活性的影响[C]//三峡地区特色渔业发展论坛,2012:287-292.
[28]祝 小,耿秀蓉,潘康成,等. 枯草芽孢杆菌Pab02产纤维素酶活性的研究[J]. 饲料研究,2007,1(1):61-63.
[29]宋晓兵. 肉桂醛对肺癌细胞A549具有体外抑制作用[J]. 中国卫生标准管理,2014,5(6):30-32.
[30]梁靖涵,张其中,付耀武,等. 肉桂活性成分肉桂醛杀灭离体多子小瓜虫效果[J]. 水产学报,2014,38(3):457-463.仲崇虎,王梦杰,魏 星,等. 磺胺二甲嘧啶对脊尾白虾抗氧化酶活性的影响[J]. 江苏农业科学,2019,47(15):205-207.
