miRNA-133 b在胃癌中的表达及预后价值分析
2019-10-18周晓红李永明李莎滕欣丽
周晓红,李永明,李莎,滕欣丽
1佳木斯市肿瘤医院肿瘤科,黑龙江佳木斯154007
2佳木斯大学解剖教研室,黑龙江佳木斯154007
胃癌是全球第四大常见恶性肿瘤,也是全球肿瘤相关死亡的第二大常见原因,每年约有70万人死于胃癌[1]。尽管胃癌的早期诊断率不断提高,但仍有部分患者属于进展期胃癌患者[2]。目前,进展期胃癌仍然被认为是致命性的恶性肿瘤,且其预后难以被准确地评估。因此,探寻用于胃癌个体化治疗和预后评价的分子生物标志物具有重要意义。微小RNA(microRNA,miRNA)是一类在动植物中广泛存在的内源性非编码小分子RNA,长度为18~25个核苷酸,miRNA与信使RNA(messenger RNA,mRNA)的 3'非翻译区相结合,导致mRNA降解或转录后翻译抑制,从而调控靶基因的表达[3-4]。miRNA参与肿瘤的多种生物学过程,包括增殖、分化、侵袭和凋亡等,作为原癌基因或抑癌基因在多种类型肿瘤的发生和发展中发挥着重要的作用[5]。尽管在胃癌中已观察到多种miRNA的异常表达,但尚未确定关于胃癌的确切发病机制[6]。miRNA-133b最初被认为是心肌特异性miRNA,可以调控成肌细胞的分化、肌源性相关疾病的发生和骨骼肌的发育[7],然而,有研究表明,miRNA-133b也表达于除心肌以外的组织中,尤其是其在非肌源性相关疾病(如心力衰竭、心脏肥大、帕金森病)中发挥着重要的作用;另外,miRNA-133b在多种肿瘤(如头部肿瘤、颈部肿瘤、口腔肿瘤、食管鳞状细胞癌、非小细胞肺癌和结直肠癌)中的表达下调[8]。目前,关于miRNA-133b在胃癌中的表达情况与胃癌发生、发展关系的研究较少见。本研究探讨了miRNA-133b在人胃癌细胞MKN-1中的表达情况及其对人胃癌细胞增殖和凋亡的影响,并分析了其在胃癌组织中的表达情况与胃癌患者临床特征和预后的关系,现报道如下。
1 资料与方法
1.1 一般资料
选取2013年1月至2015年6月佳木斯市肿瘤医院收治的胃癌患者。纳入标准:①经肿瘤细胞学或组织学证实为胃癌;②行胃癌根治手术;③术前未接受过放疗、化疗等抗肿瘤治疗;④未合并远处转移;⑤临床资料完整。排除标准:①合并精神类疾病;②合并心、肺等其他脏器功能障碍;③合并自身免疫系统疾病;④存在严重的营养不良。根据纳入和排除标准,本研究共纳入80例胃癌患者,其中男45例,女35例;年龄为26~69岁,平均年龄为(58.31±10.0)岁。收集80例同一胃癌患者经手术切除的胃癌组织标本、癌旁组织(2cm<距肿瘤切缘<5cm)标本和正常胃黏膜上皮组织(距肿瘤切缘≥5cm)标本,标本均在外科手术室获得,所取组织均经病理科医师复核。将所有样品快速冷冻于液氮中,并保存于-80℃的温度下,以待后续检测。收集患者的吸烟史、肿瘤直径、浸润深度、临床分期(参照第7版美国癌症联合会标准[9]进行分期)等临床资料。
1.2 细胞、试剂和仪器
人胃癌细胞MKN-1、人正常胃黏膜细胞GES-1均购自上海研生实业有限公司。RPMI 1640培养基购自美国Gibco公司;胰蛋白酶、青霉素-链霉素、胎牛血清均购自浙江天杭生物科技股份有限公司;miRNA-133b模拟物(miRNA-133b mimics)、miRNA-133b阴性对照(negative control,NC)及转染试剂、miRNA-133b及内参U6的上下游引物均购自上海吉凯基因化学技术有限公司;CCK-8试剂盒购自上海甄准生物科技有限公司;Trizol试剂、实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒和逆转录试剂盒均购自日本Takara公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒、B细胞淋巴瘤/白血病-2(B cell lymphoma/leukemia-2,Bcl-2)、B细胞淋巴瘤/白血病-2相关X蛋白(B-cell lymphoma/leukemia-2 associated X protein,BAX)、cleaved胱天蛋白酶3(cleavedcysteinyl aspartate specific proteinase 3,cleaved caspase 3)单克隆抗体和辣根过氧化物标记的羊抗鼠免疫球蛋白G(immunoglobulin G,IgG)(二抗)均购自美国Abcam公司;酶标仪和PCR仪购自美国Bio-Rad公司;二氧化碳(CO2)培养箱购自美国SIM公司;LipofectamineTM2000转染试剂盒购自上海恒斐生物科技有限公司。
1.3 实验方法
1.3.1 细胞培养将人胃癌细胞MKN-1、人正常胃黏膜细胞GES-1培养于含10%胎牛血清、1%青霉素和1%链霉素的RPMI 1640培养基中,置于37℃、5%CO2饱和湿度的细胞培养箱中进行常规培养。
1.3.2 细胞转染及分组转染前24 h,用胰蛋白酶将处于对数生长期的人胃癌细胞MKN-1进行消化,以细胞培养液进行重悬并进行细胞计数,以2×105/m2的密度接种于12孔细胞培养板中,待细胞融合度达80%左右时,参照LipofectamineTM2000转染试剂盒说明书中的方法将miRNA-133b mimics及miRNA-133b NC分别转染至人胃癌细胞MKN-1,并分别作为miRNA-133b mimics组和miRNA-133b NC组,将仅加入转染试剂LipofectamineTM2000的人胃癌细胞MKN-1作为对照组。将人胃癌细胞MKN-1转染miRNA-133b mimics和miRNA-133b NC后继续培养48 h,采用qRT-PCR法检测各组细胞中miRNA-133b的相对表达量,并验证转染效率;继续培养72 h,提取细胞总蛋白,用于后续实验。
1.3.3 qRT-PCR法检测miRNA-133 b的相对表达量转染后,采用Trizol试剂按照说明书的步骤从待测的3种组织或细胞中提取总RNA。采用酶标仪检测其浓度及质量,采用qRT-PCR反转录试剂盒将其反转录成cDNA,进行PCR。在PCR仪中进行反应扩增,PCR的反应条件:95℃30 s;95℃5 s,60℃34 s,共进行40个循环。qRT-PCR引物序列:miRNA-133b上游引物为5'-TTTGGTCCCTTCAACCA-3',下游引物为5'-CTCAACTGGTGTCGTGGA-3';U6的上游引物为5'-CTCGCTTCGGCAGCACA-3',下游引物为5'-AACGCTTCACGAATTTGCGT-3'。以ABI7500实时定量PCR系统进行实验,建立PCR产物的熔解曲线,以U6为内参基因,采用2-△△CT法分析,进行半定量比较。计算各组织和细胞中miRNA-133b的相对表达量。
1.3.4 CCK-8法检测胃癌细胞的增殖情况取处于对数生长期的miRNA-133b mimics组、miRNA-133b NC组和对照组的人胃癌MKN-1细胞,制成细胞悬液,将细胞接种于96孔板中,每孔100 μl,接种待测细胞悬液,将培养板置于37℃、5%CO2的培养箱中预培养24 h。培养24 h后,于每孔中加入CCK-8溶液10 μl,将培养板在培养箱内继续孵育1~4 h。使用酶标仪检测各孔450 nm波长处的吸光度(A)值,并计算3组人胃癌细胞MKN-1的增殖情况。实验重复3次。
1.3.5 蛋白质印迹法(Westernblot)检测凋亡相关蛋白的相对表达量转染后继续培养人胃癌细胞MKN-1,培养72 h后,取 miRNA-133b mimics组、miRNA-133b NC组和对照组处于对数生长期的人胃癌细胞MKN-1,按照蛋白提取试剂盒说明书提取细胞总蛋白,采用BCA试剂盒检测Bcl-2、BAX、cleaved caspase 3的浓度,采用Western blot法检测各蛋白的表达情况。将上述3种蛋白与Loading buffer充分混合,100℃沸水中煮沸5 min致蛋白变性,每孔取50 μl蛋白样品加入到十二烷基硫酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)凝胶上样孔中进行电泳和转膜,5%脱脂奶粉37℃封闭1 h。加入稀释后的一抗(稀释浓度为1∶2000),4℃孵育过夜。TBST洗膜后加入辣根过氧化物酶标记的二抗(羊抗鼠IgG,稀释浓度为1∶5000),37℃孵育1 h,充分洗膜后采用电化学发光(electrochemiluminescence,ECL)试剂盒曝光成像,以自动凝胶成像系统采集图像,以β-actin作为内参,计算各蛋白的相对表达量。实验重复3次。
1.4 随访
所有患者的随访资料均保存完整,包括地址和联系方式,随访方式为门诊复查、电话随访,随访截止日期为2018年5月。观察终点为胃癌患者死亡,定义为确诊胃癌至因胃癌死亡的时间段。
1.5 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,多组间两两比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;等级资料的比较采用秩和检验;采用Kaplan-Meier法绘制生存曲线,生存情况的比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 不同细胞及组织中miRNA-133 b的相对表达量
qRT-PCR检测结果显示,miRNA-133b在人胃癌细胞MKN-1中的相对表达量为(0.34±0.10),明显低于人正常胃黏膜细胞GES-1的(0.99±0.09),差异有统计学意义(t=11.834,P<0.01)。miRNA-133b在胃癌组织、癌旁组织和胃黏膜上皮组织中的相对表达量比较,差异有统计学意义(P<0.01)。miRNA-133b在胃癌组织中的相对表达量低于癌旁组织和胃黏膜上皮组织,差异均有统计学意义(P<0.05)。miRNA-133b在癌旁组织中的相对表达量低于胃黏膜上皮组织,差异有统计学意义(P<0.05)(表1)。
2.2 转染后人胃癌细胞MKN-1中miRNA-133 b的相对表达量
转染后,miRNA-133b mimics组、miRNA-133bNC组和对照组人胃癌细胞MKN-1中miRNA-133b的相对表达量比较,差异有统计学意义(P<0.01)。miRNA-133b NC组人胃癌细胞MKN-1中miRNA-133b的相对表达量与对照组比较,差异无统计学意义(P>0.05)。miRNA-133b mimics组人胃癌细胞MKN-1中miRNA-133b的相对表达量高于miRNA-133b NC组和对照组,差异均有统计学意义(P<0.05)。(表2)
表1 不同组织中miRNA-133 b相对表达量的比较(±s)

表1 不同组织中miRNA-133 b相对表达量的比较(±s)
注:a与胃癌组织比较,P<0.05;b与癌旁组织比较,P<0.05
组织类型miRNA-133b胃癌组织(n=80)癌旁组织(n=80)胃黏膜上皮组织(n=80)F值P值0.39±0.10 0.73±0.13a 1.09±0.12a b 899.712<0.01
表2 转染后不同组别人胃癌细胞MKN-1中miRNA-133 b相对表达量的比较(±s)

表2 转染后不同组别人胃癌细胞MKN-1中miRNA-133 b相对表达量的比较(±s)
注:*与miRNA-133b mimics组比较,P<0.05
组别miRNA-133b对照组miRNA-133b NC组miRNA-133b mimics组F值P值1.02±0.08*1.01±0.09*2.39±0.31 102.570<0.01
2.3 上调miRNA-133 b表达对人胃癌细胞MKN-1增殖能力的影响
转染后,miRNA-133b mimics组、miRNA-133b NC组和对照组人胃癌细胞MKN-1的相对细胞存活比例比较,差异有统计学意义(P<0.01)。miRNA-133b mimics组人胃癌细胞MKN-1的相对细胞存活比例低于miRNA-133b NC组和对照组,差异均有统计学意义(P<0.05)。miRNA-133b NC组和对照组人胃癌细胞MKN-1的相对细胞存活比例比较,差异无统计学意义(P>0.05)。(表3)
表3 不同组别人胃癌细胞MKN-1相对细胞存活比例的比较(%,±s)

表3 不同组别人胃癌细胞MKN-1相对细胞存活比例的比较(%,±s)
注:a与对照组比较,P<0.05;b与miRNA-133b NC组比较,P<0.05
组别相对细胞存活比例对照组miRNA-133b NC组miRNA-133b mimics组F值P值1.03±0.13 0.99±0.08 0.62±0.10a b 27.613<0.01
2.4 上调miRNA-133 b表达对人胃癌细胞MKN-1中凋亡相关蛋白表达情况的影响
Western blot法检测结果显示,转染后,对照组、miRNA-133b NC组和miRNA-133b mimics组人胃癌细胞MKN-1中Bcl-2、BAX和cleaved caspase 3的相对表达量比较,差异均有统计学意义(P<0.01)。miRNA-133b mimics组人胃癌细胞MKN-1中Bcl-2蛋白的相对表达量低于对照组和miRNA-133b NC组,BAX和cleaved caspase 3的相对表达量均高于对照组和miRNA-133b NC组,差异均有统计学意义(P<0.05)。(表4)
表4 不同组别人胃癌细胞MKN-1中凋亡相关蛋白相对表达量的比较(±s)

表4 不同组别人胃癌细胞MKN-1中凋亡相关蛋白相对表达量的比较(±s)
注:*与miRNA-133b mimics组比较,P<0.05
1.00±0.13*0.98±0.11*0.42±0.09 43.83 0.000 0.99±0.08*0.98±0.09*4.32±0.43 291.312 0.000 1.02±0.10*1.01±0.11*3.41±0.50 98.05 0.000对照组miRNA-133b NC组miRNA-133b mimics组F值P值组别Bcl-2 BAX cleaved caspase 3
2.5 胃癌组织中miRNA-133 b表达情况与胃癌患者临床特征的关系
以胃癌患者胃癌组织中miRNA-133b相对表达量的中位数(0.247)为临界值,将80例胃癌患者分为 miRNA-133b高表达(miRNA-133b>0.247)患者27例和miRNA-133b低表达(miRNA-133b≤0.247)患者53例。不同肿瘤直径、分化程度、浸润深度、淋巴结转移数量和TNM分期胃癌患者胃癌组织中miRNA-133b的表达情况比较,差异均有统计学意义(P<0.01),不同性别、年龄、吸烟史胃癌患者胃癌组织中miRNA-133b的表达情况比较,差异均无统计学意义(P>0.05)。(表5)
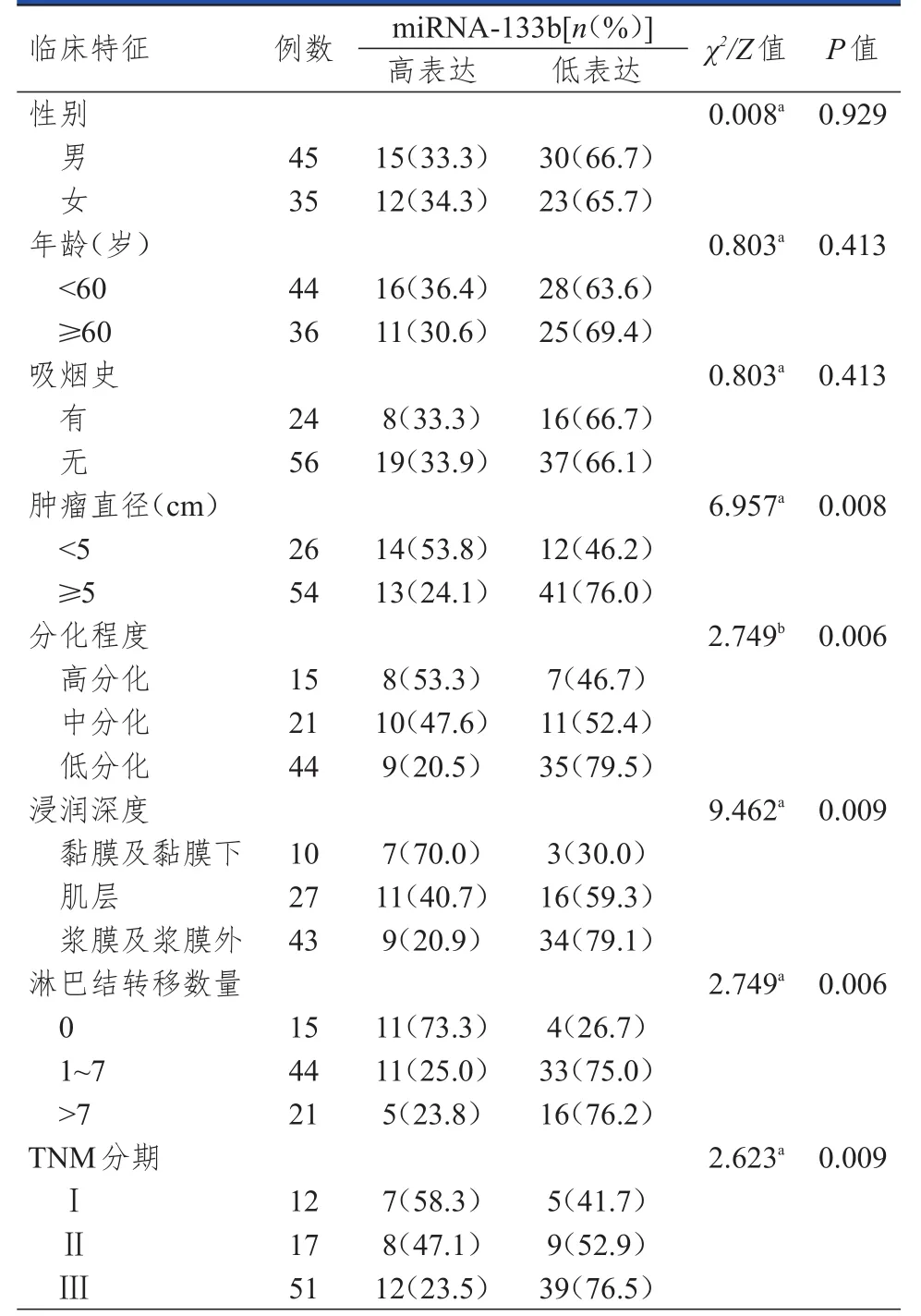
表5 不同临床特征胃癌患者胃癌组织中miRNA-133 b的表达情况比较(n=80)
2.6 miRNA-133 b表达与胃癌患者预后的关系
miRNA-133b高表达胃癌患者的中位生存时间为39.1个月,长于miRNA-133b低表达胃癌患者的29.6个月,差异有统计学意义(χ2=2.514,P<0.05)。(图1)
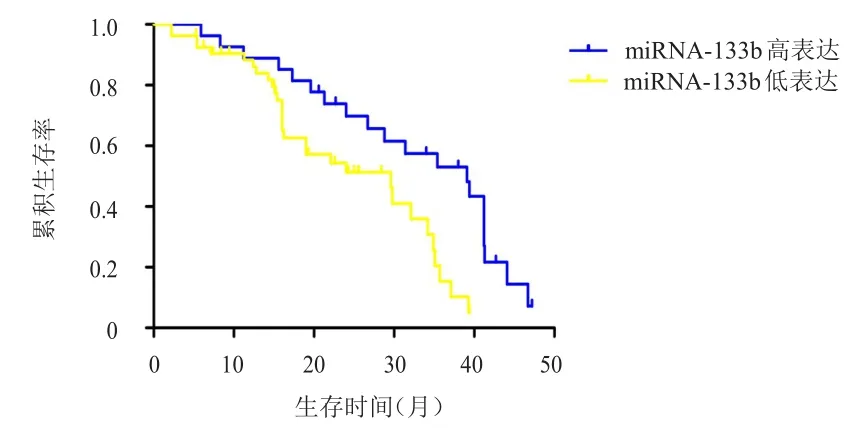
图1 miRNA-133 b高表达(n=27)和低表达(n=53)胃癌患者的生存曲线
3 讨论
miRNA的异常表达参与胃癌等恶性肿瘤的发生与发展,部分miRNA作为促肿瘤因子促进肿瘤的生长,部分miRNA发挥抑制肿瘤的作用。miRNA-21、miRNA-106a等在胃癌中常过表达并促进胃癌的进展,而let-7、miRNA-101、miRNA-148和miRNA-133b等常在胃癌的发展过程中持续低表达[4],尽管miRNA-133b最初被认为是肌肉特异性miRNA,但后来被证明可以作为包括胃癌在内的各种类型肿瘤的肿瘤抑制因子[10]。
本研究探讨了miRNA-133b在胃癌中的表达情况及其与胃癌细胞增殖和凋亡的关系,结果发现,人胃癌细胞和胃癌组织样本与人正常胃黏膜上皮细胞和胃黏膜上皮组织相比,miRNA-133b的相对表达量均降低(P<0.05);转染后,与miRNA-133b NC组和对照组相比,miRNA-133b mimics组人胃癌细胞MKN-1中miRNA-133b以及BAX、cleaved caspase 3的相对表达量较高,Bcl-2蛋白的相对表达量和人胃癌细胞MKN-1的相对细胞存活比例均较低(P<0.05)。说明上调miRNA-133b的表达可以抑制人胃癌细胞MKN-1的增殖能力,并抑制Bcl-2的表达,促进BAX、cleaved caspase 3的表达。miRNA-133b对胃癌细胞增殖的调控可能与多嘧啶束结合蛋白1(polypyrimidine tract-binding protein 1,PTBP1)有关,PTBP1是miRNA-133b的下游调控基因之一,miRNA-133b表达的上调可抑制PTBP1的表达,而PTBP1可调控肿瘤细胞的Warburg效应[11]。丙酮酸激酶(pyruvate kinase,PK)是糖酵解过程中的关键酶,其中,活性最强的丙酮酸激酶M2型(pyruvate kinase M2,PKM2)是糖酵解过程中的限速酶[12],而PKM2的表达又受到PTBP1的调控,miRNA-133b过表达可通过调控PTBP1的表达进而影响PKM2的表达和转化,干扰胃癌细胞的糖酵解,影响胃癌细胞的增殖能力[13]。在非小细胞肺癌中,miRNA-133b可通过激活caspase 3和caspase 7依赖的凋亡途径和诱导细胞停滞于S期从而降低肺癌细胞的存活率[14]。本研究发现,转染后,cleaved caspase 3的表达水平升高,提示miRNA-133b对caspase 3依赖的凋亡途径的调控可能是其影响胃癌恶性程度的重要机制之一,寻找miRNA-133b的凋亡相关下游靶点有助于揭示miRNA-133b对胃癌细胞凋亡的调控机制。
鉴于miRNA-133b在胃癌细胞增殖和凋亡方面的调控作用,本研究对miRNA-133b的表达与胃癌患者预后的关系进行了探究,结果显示,miRNA-133b高表达患者的中位生存时间长于miRNA-133b低表达患者(P<0.05),说明miRNA-133b表达的下调与胃癌患者的预后不良可能有关,miRNA-133b具有成为评估胃癌预后的分子标志物的潜力。有研究发现,miRNA-133b与结直肠癌的TNM分期、远处转移情况可能有关[15]。本研究发现,miRNA-133b的表达与胃癌的肿瘤直径、分化程度、肿瘤浸润深度、淋巴结转移数量和TNM分期可能有关,其中,miRNA-133b的表达与淋巴结转移数量可能有关,提示miRNA-133b可能对上皮-间充质转化、肿瘤干细胞表型的形成等肿瘤转移相关生物学过程具有调控作用。目前,miRNA-133b与肿瘤转移的相关基础研究较少,还需更多的分子生物学证据进一步证实。
综上所述,miRNA-133b在胃癌细胞及组织中的表达下调,而上调miRNA-133b的表达可抑制胃癌细胞的增殖,并能够影响凋亡相关蛋白的表达;miRNA-133b表达下调可能与胃癌患者的预后不良有关,其具有成为胃癌预后预测的分子标志物的潜力。miRNA-133b在细胞能量代谢和细胞凋亡中发挥着重要的调控作用,在后续的研究中,可通过生物信息学及荧光素酶报告基因实验,寻找与细胞能量代谢和凋亡相关的miRNA-133b下游靶点,从而揭示miRNA-133b调控胃癌细胞能量代谢及凋亡过程的具体机制。另外,长链非编码RNA的研究已广泛开展,与miRNA-133b相关的长链非编码RNA的筛查可能能够为寻找胃癌预后预测的分子标志物提供新的方向。
