轴向叩击应力对内固定和外固定治疗胫骨骨折影响的有限元分析
2019-10-17陈志达肖棋姚小涛丁真奇黄国锋宋超
陈志达 肖棋 姚小涛 丁真奇 黄国锋 宋超
胫骨骨折在全身四肢骨骨折中发生率最高,由于胫骨位置表浅,易形成开放性骨折,导致胫骨延迟愈合或不愈合[1,2]。骨折愈合是一个极其复杂的过程,受病人年龄、内分泌、骨折端血运和应力刺激等体内外诸多因素的影响。其中应力刺激被认为是影响骨折愈合最主要的因素之一。Wolf等[3]指出骨的结构和功能受应力环境影响。骨组织对外界应力刺激可形成载荷反应,该载荷反应性能促使骨组织按照应力的作用方向进行修复重建。具体表现为在外界载荷的影响下,增强位于骨结构压力侧的骨形成过程,而加速位于骨结构张力侧的骨吸收过程。许多学者也指出合理的应力能促进骨痂生长,加速骨折愈合,反之过早或过大的应力刺激都会造成骨折断端再移位和畸形[4,5]。Goodship[6]及Leung 等[7]研究指出高频率(10~30 Hz)、低振动应力刺激可加速骨愈合。Hsieh 等[8]则认为低频率(0.5~2.5 Hz)应力刺激就能促进骨组织愈合,但目前刺激骨折愈合的最佳应力及频率仍不明确。故本文通过计算机仿真方法同时建立胫骨横行骨折钢板内固定与外固定架固定骨愈合三维有限元模型,模拟不同频率及应力条件下对骨折愈合的影响,探寻促进胫骨骨折愈合的最佳理论参数。
材料与方法
一、材料
健康成年雌性高腿山羊1只(年龄为2岁,体重为30 kg),由厦门大学实验动物中心提供,先摄胫腓骨X线片排除下肢畸形、肿瘤等骨质破坏,再行胫骨CT 扫描。建模设备:64 排螺旋CT 机(西门子公司,德国),Windows 7操作系统计算机工作站,建模软件Mimics V16.0(Materialise 公司,比利时),Abaqus 6.13软件(Dassault Systèmes公司,法国)。
二、实验方法
采用对比观察有限元分析,利用螺旋CT扫描山羊下肢,扫描范围从踝关节至膝关节上方,扫描厚度为0.65 mm,共获取三维薄层CT 图像422 层。将CT扫描所得的数据以DICOM 格式导入到Mimics 三维建模软件,通过蒙板编辑、区域增长和空腔填充等对选择的部位进行分割、填充,得到胫骨几何模型图。CAD 模块模拟出胫骨中段1.5 mm 间隙横行骨折模型,钢板组的钢板长度为130 mm,螺钉长度为25 mm,螺丝钉直径为3.5 mm,骨折近端及远端各3枚螺钉,螺钉间距10 mm;外固定架组的连杆长度为150 mm,螺钉长度为65 mm,螺钉直径4.5 mm,骨折近端及远端各3 枚外固定螺钉,外固定螺钉间距为16 mm。然后再利用CAD设计出基于原始数据简化内固定和外固定模型。因螺钉的螺纹不干扰模型固定[9],故将螺钉简化为圆柱状,螺钉与内固定和外固定之间以节点刚性绑定连接,模拟置钉建立胫骨内固定和外固定的几何模型,并模拟出骨折端的低弹性模量肉芽组织(图1)。然后采用Mimics 的Remesh模块对模型进行面网格划分、表面优化等处理,最后导入Abaqus软件进一步网格化处理生成钢板内固定胫骨骨折的三维有限元体网格模型,并分别生成四面体单元。
在Abaqus软件中,将胫骨近端各方向约束定为0,胫骨远端施加轴向应力,设置胫骨远端轴向加载参数(频率:0.5 Hz、1 Hz、1.5 Hz、2 Hz、2.5 Hz、3 Hz,载荷:100 N、150 N、200 N、250 N、300 N,两两参数组合施加)。
依据Gómez-Benito等[10]提出的理论仅将偏应变作为影响组织分化的因素,而不考虑流体流速的影响,愈合组织模拟材料为连续、均质、各向同性的线弹性材料,各组织材料参数见表1。
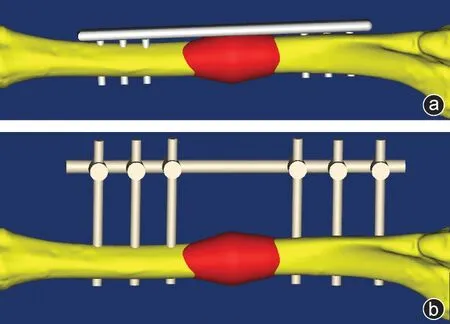
图1 内固定(a)和外固定模型(b)
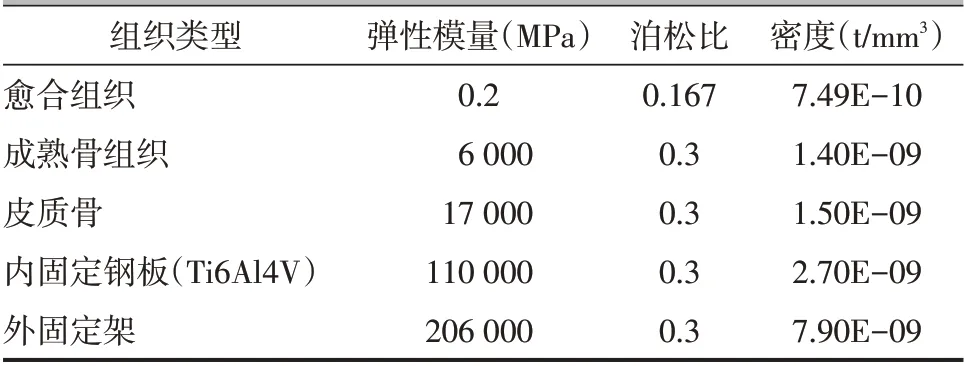
表1 各材料参数赋值
不同时间点骨折愈合组织成分转化的运算中,采用“消减系数”法,即愈合组织转化过程中低剪切应变组织将被消除并转化为成熟骨组织,消减系数为最大压缩主应变的5%,转化后重新定义愈合组织的材料性质及单元数[13]。整个迭代运算过程如图2 所示。根据以往文献报道,将迭代过程简化为1周1次,直至愈合组织转化单元数极少时终止。
结 果
一、建立有限元模型
内固定模型四面体单元数(内固定为51 821个,愈合组织为49 504个,胫骨为196 756个);外固定模型四面体单元数(外固定为81 502 个,愈合组织为50 491个,胫骨为195 525个),如图3所示。
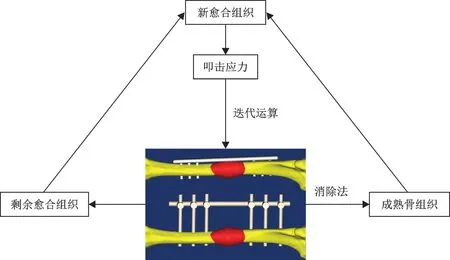
图2 愈合组织转化的迭代运算技术路线图
二、不同应力、频率组合条件下骨折端愈合组织转化为成熟骨组织所需时间
不同应力、频率组合条件下骨折端愈合组织转化为成熟骨组织所需时间各不相同,不同时间点转为成熟骨组织单元数亦不相同,最后骨折端愈合组织全部转化为成熟骨组织,无论钢板内固定还是外固定,都是在200 N、1 Hz时所需时间最短,只需7周,其他组合需8~12周不等(图4)。其中200 N、1 Hz时骨折愈合模式图如图5,红色代表初始愈合组织,黄色代表最终转化的成熟骨组织。

图3 内固定模型(a)和外固定模型(b)三维有限元模型
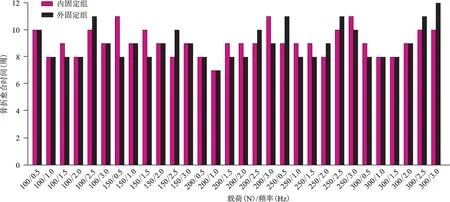
图4 内固定和外固定组不同载荷、频率组合下骨折愈合时间

图5 200 N、1 Hz组合参数下内固定和外固定组骨折愈合模式图
三、不同应力、频率组合下各周愈合组织内部应变、应力、位移、内外固定应力、变形变化情况
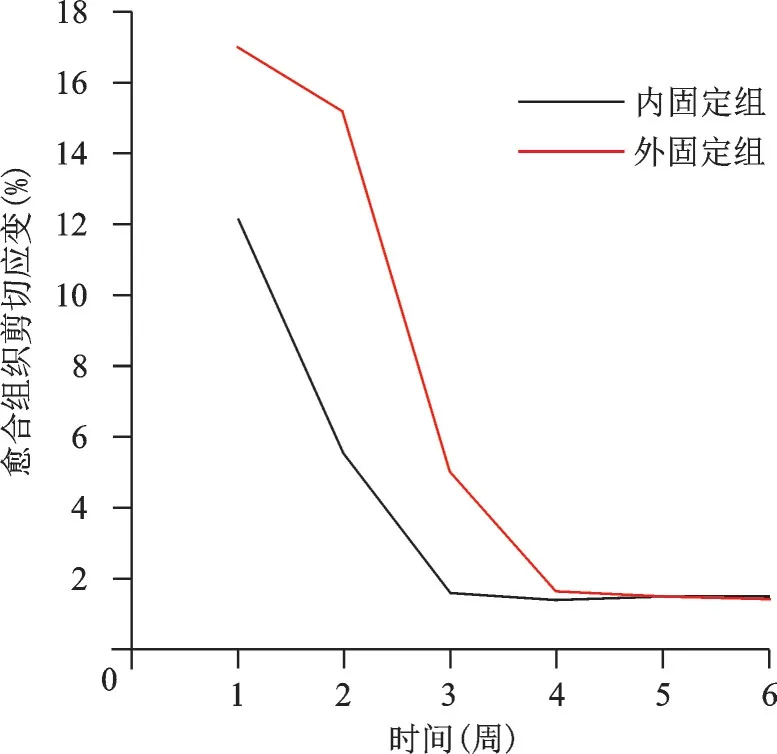
图6 200 N、1 Hz组合参数下内、外固定组骨折端愈合组织各周剪切应变变化趋势图
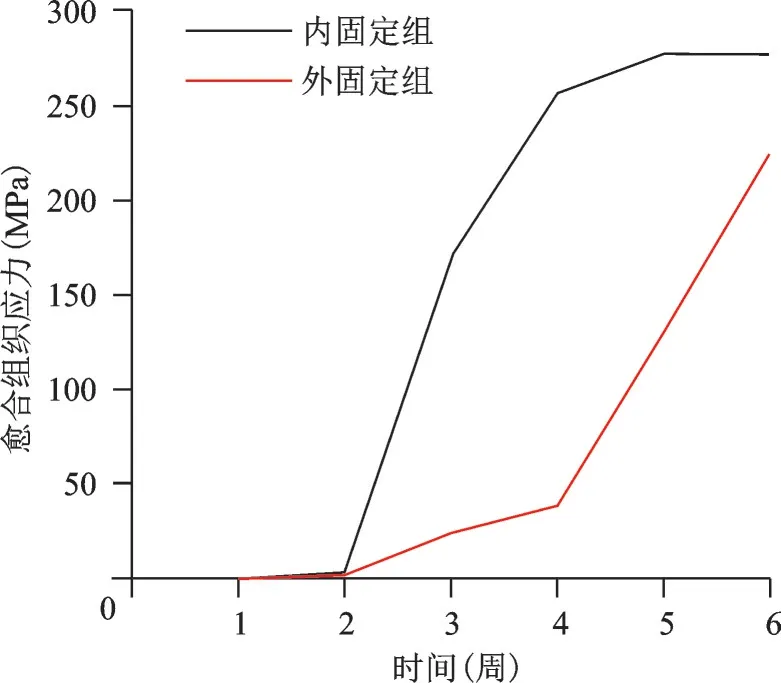
图7 200 N、1 Hz组合参数下内、外固定组骨折端愈合组织应力变化趋势图
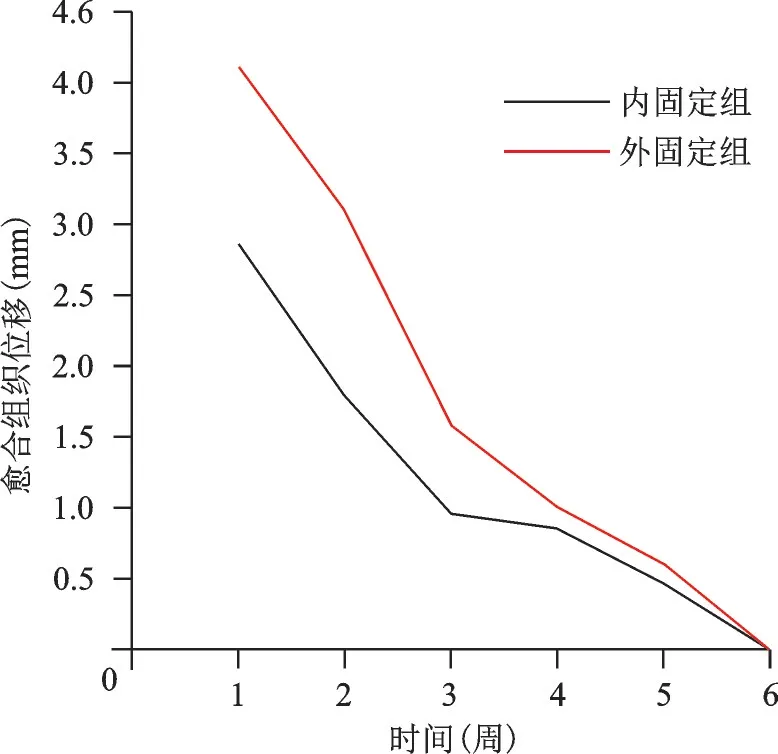
图8 200 N、1 Hz组合参数下内、外固定组骨折端愈合组织位移变化趋势图
不同应力、频率组合下,内、外固定组各周愈合组织剪切应变、应力、位移、承受应力、变形变化趋势各异。以200 N、1 Hz 组合为例描述其变化趋势图及应力云图(图6~12)。从趋势图及应力云图可以看出随着骨折端逐渐愈合,骨折端能承受的应力逐渐增大,在骨折愈合后达到最大值趋于稳定,骨折端愈合后的刚度提高、微动逐渐降低趋于零。在骨折愈合初期,内固定和外固定对骨折端愈合组织有较高的应力遮挡作用,承受应力最大,内、外固定产生形变最大,随着骨折愈合,内、外承受应力逐渐降低,轴向外力逐渐由内、外转移到愈合的骨痂上。内固定和外固定趋势图的差异可能是由于内、外固定自身稳定性差异造成,但最终愈合终点无明显差异。
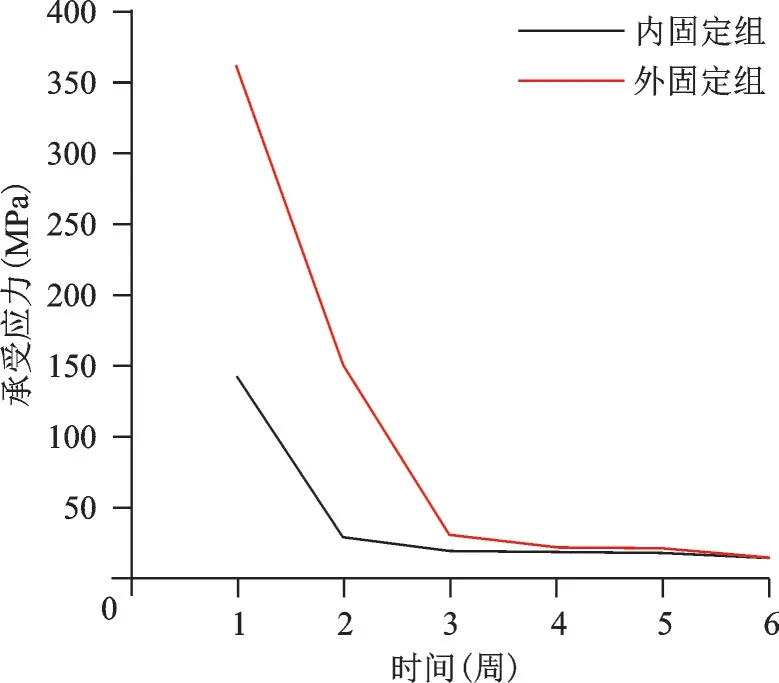
图9 200 N、1 Hz组合参数下内、外固定组承受应力变化趋势图
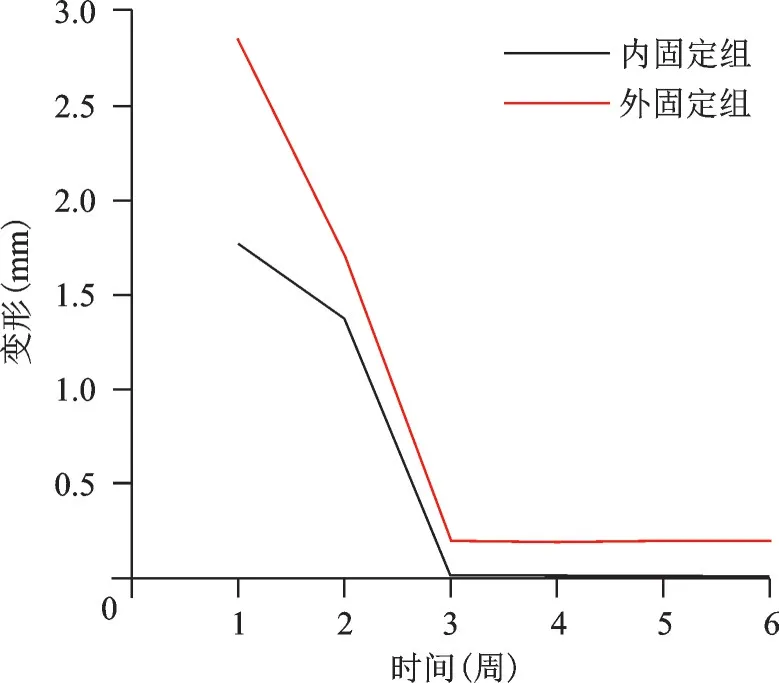
图10 200 N、1 Hz组合参数下内、外固定组变形变化趋势图
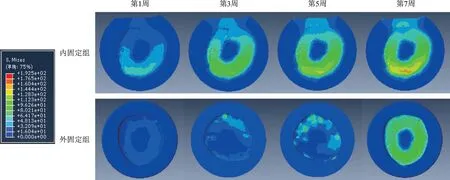
图11 200 N、1 Hz组合参数下内、外固定组愈合组织横截面应力云图
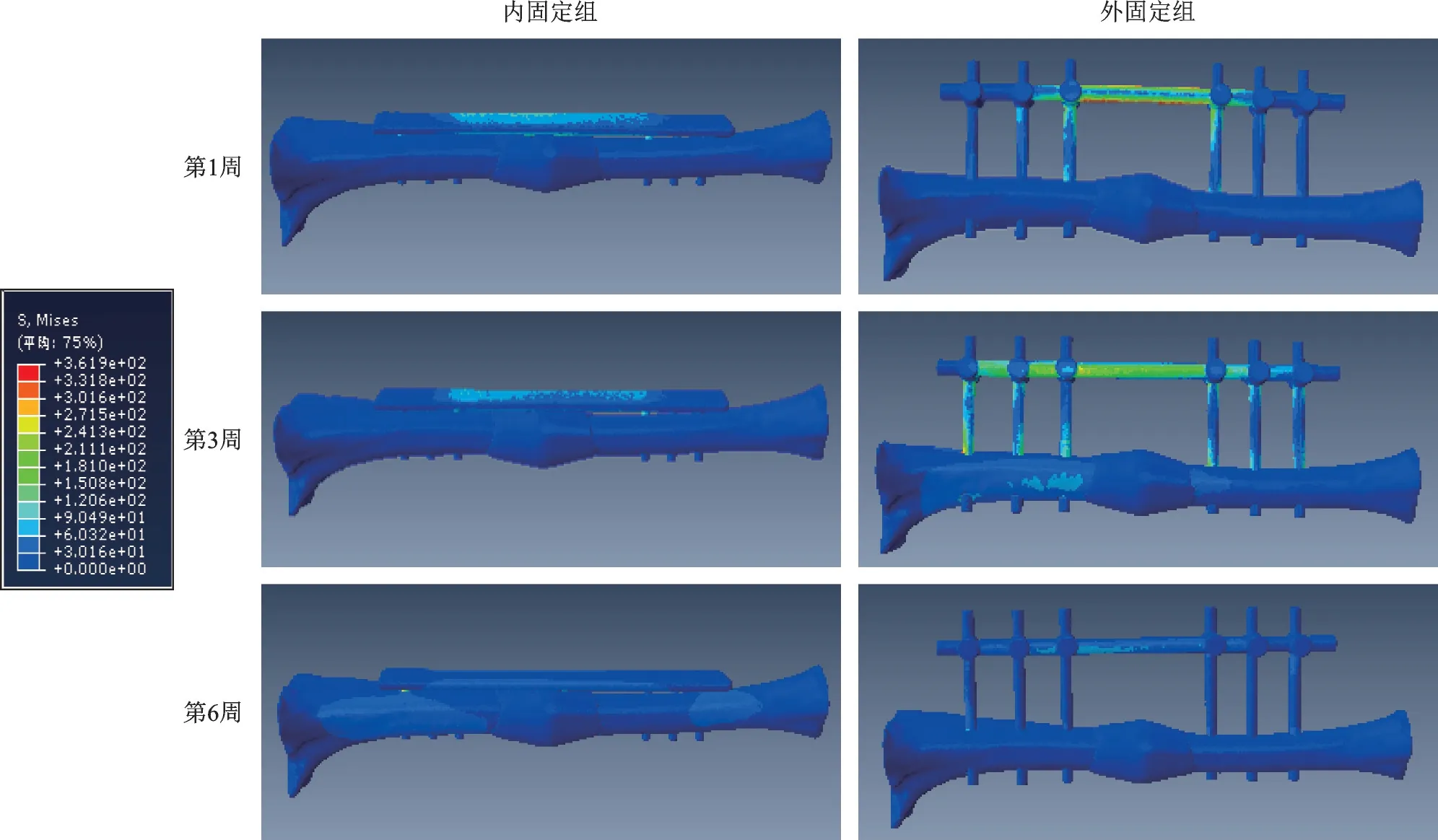
图12 200 N、1 Hz组合参数下内、外固定组承受应力变化云图
讨 论
胫骨骨折愈合是一个极其复杂的组织修复调控过程,受体内外诸多因素影响,其中力学环境是影响骨折愈合过程及组织增殖分化重要因素。近年来,有限元法被广泛运用到骨折内外固定应力分析及骨折愈合过程仿真模拟。Carter 等[14]通过骨折组织分化模型研究应力载荷对骨痂骨化作用,并指出骨折间隙中流体静压应力和应变对骨折愈合微观调控的影响。Prendergast等[15]和Lacroix等[16]认为结缔组织是由间隙流体和固体组成,流体速度和偏应变对骨折愈合起关键作用。Andreykiv 等[17]采用有限元模拟不同载荷频率对骨折愈合影响,指出不同载荷刺激能使骨折端形成不同骨痂。Comiskey等[13]也采用有限元方法模拟骨折愈合,研究认为外部应力引起骨折端产生的压缩应变是最主要影响组织分化的因素,低应变组织将被消除,每次迭代运算后低于最大主应变的5%的组织将会被消除并转化为骨痂组织,近似于活体骨折转化过程。
本研究建立山羊胫骨中段横行骨折内固定和外固定三维有限元模型,单一研究轴向应力刺激下骨折愈合过程。在不同应力、频率组合下采用有限元方法,模拟骨折端从肉芽组织转化为成熟骨组织过程。Weyts 等[18]研究指出在外界应力作用下7 d 能使肉芽组织分化为成骨细胞,本研究以每周为单位进行迭代运算,依据Comiskey 等[13]提出的“消减”理论,低应变组织将会被消除并转化为成熟骨组织。在实验过程中,用计算机仿真三维有限元方法模拟骨折愈合过程中需要进行各方面的简化及假设。①人体下肢在日常活动中,主要以承受轴向应力为主且在实验中容易获得,轴向应力最具意义[19],故本研究以轴向应力进行刺激。②一个合适的骨折端缝隙能更好地模拟骨折愈合,Wehner等[20]通过敏感性分析指出增加骨痂模型的直径对骨折愈合影响甚微。本研究建立1.5 mm 的骨折间隙。③生物体是多孔双相材料属性,以往研究表明在轴向应力作用下流体速度及孔隙压力均不能作为单一变量预测骨折愈合过程,且Isaksson 等[21]指出偏应变是影响组织分化的主要因素,可把偏应变当作单变量模拟生理载荷下骨折愈合情况。故本实验中的材料属性简化为各项同性线弹性体,将偏应变作为一种替代流体力学刺激是适当的。
在有限元迭代运算中,不同应力、频率组的轴向刺激下骨折愈合需7~12 周。从骨折愈合模式图可以看出,在骨折愈合4周内,成熟骨组织生成最快且最多,这些特点与临床骨折愈合规律基本吻合。不论是内固定组还是外固定组,在200 N、1 Hz组合参数下,骨折愈合所需时间最短,均只需7 周,其作为外在因素更有利于骨折端组织迁移、分化转化为骨组织。有研究[22,23]指出生理载荷下,小于3 Hz 的外部刺激更有益于促进骨折愈合与骨组织再生。喻鑫罡等[24]则认为1 Hz 频率能有效促进骨痂生长和矿化,效果最佳。Kenwright 等[25]研究表明200 N 外界应力能增加骨化速度和骨折部位的强度,更能促进骨折愈合。Lacroix 等[16]建立胫骨骨折的三维有限元模型,结果发现低负荷应力(300 N)状态下骨愈合良好,而高负荷(500 N)下骨愈合较差,与我们的结果大致相符。本研究中内固定组和外固定组结果相同,这与临床实际有所不同,可能是由于内固定和外固定部件对模型的影响甚微,但我们认为促进骨折愈合需要适宜的外部应力、频率刺激。本研究中最优组合(200 N、1 Hz)的剪切应变、应力、位移、变形变化的趋势图及应力云图可以看出随着骨折端逐渐愈合,骨折端能承受的应力逐渐增大,在骨折愈合后达到最大值趋于稳定,而骨折端剪切应变逐渐降低,这与以往研究报道结果相似[11,26],其结果的细微差别可能由定义细胞分化的速率和材料属性不同引起。从趋势图及云图看出,在骨折愈合初期,固定材料对骨折断端愈合组织有较高的应力遮挡作用,承受应力最大,内固定产生变形最大,起到坚强固定骨折端,有利促进骨折愈合作用;随着骨折愈合,固定材料的承受应力逐渐降低,轴向外力逐渐转移到愈合的骨痂上。以上变化趋势与临床实践相符,更进一步说明200 N、1 Hz组合参数更有利于骨折愈合。
有限元研究方法使用理想化的运算,结果是近似解,且用较简单问题替代实际复杂结构。本研究对一些问题做了简化及假设,所以为确保提出的研究方法及实验结果更加可靠、规范,同一材料属性参数、复杂的骨折类型、不同固定方式、不同方向应力刺激、软组织、考虑腓骨影响和骨折愈合后需再进一步研究,也需更深入的临床试验,才能够使仿真模型更加可靠,结果更接近临床实际情况。尽管存在一些局限,但作为临床前实验研究,这种有限元方式可以为预测骨折愈合提供一种可行方法。
