食管黏膜病变经内镜黏膜下剥离术术后食管狭窄发生风险的观察
2019-10-17孙仁虎吴大鹏张其德韩树堂于大海
孙仁虎,吴大鹏,张其德,韩树堂,于大海
内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)是由内镜下黏膜切除术延伸而来的一项标准微创诊治技术,目前已被广泛用于治疗消化道良性肿瘤及、早癌及癌前病变,与内镜下黏膜切除术比较,其可整块切除较大病变(>2 cm),且可控制其形状、大小,并可行病理组织学检查,探查切缘是否存留癌细胞,针对溃疡性病变也可切除[1]。以往报道也证实针对浅表的早期食管癌及癌前病变,ESD技术具有较高的治愈率,其疗效与外科手术相当,因操作时间短、创伤轻微、恢复快、不改变胃肠道结构等优势而被广泛应用[2]。而多项研究表明,ESD技术虽可完全整切除较大食管黏膜病变(包括环周食管黏膜病变),但大范围病变切除会出现相关并发症,尤其是食管狭窄,其发生率高达5%~18%[3-4]。目前关于食管黏膜环周缺损范围对ESD术后食管狭窄的影响存在争议,大部分报道侧重于研究黏膜环周缺损范围小于管腔环周1/2或大于管腔环周3/4时术后食管狭窄发生情况,针对缺损范围为1/2~3/4环周者ESD术后食管狭窄发生情况及其危险因素鲜有系统随访报道,关于黏膜环周缺损范围是否为术后食管狭窄的危险因素,尚未形成统一认识[5]。因此,本文针对此方面展开相关研究,探讨食管不同黏膜环周缺损范围者ESD术后食管狭窄的危险因素,旨在为该病临床诊治提供参考依据,报道如下。
1 资料与方法
1.1 一般资料
纳入2017年9月至2019年1月于我院收治的86例因食管黏膜病变(早期食管癌及癌前病变)择期拟行ESD手术的患者为对象,开展回顾性分析,获我院医学伦理委员会批准。86例患者中,男52例,女34例,年龄18~85岁,平均年龄(65.49±7.18)岁。
1.2 纳入、排除标准
1.2.1 纳入标准 ①非食管黏膜环周切除;②术后病理示肿瘤侵犯深度未超过黏膜下层上1/3(即深度距黏膜肌层下缘小于200 μm),属高级别或低级别上皮内瘤变、高分化或中分化鳞癌;③年龄≥18岁,均首次接受ESD手术治疗,无相关禁忌症;④知情同意。
1.2.2 排除标准 ①伴严重心、肝、肺、肾及血液系统等原发性疾病;②伴精神疾患或严重精神障碍者;③恶性肿瘤;④凝血障碍性疾病;⑤伴十二指肠、胃多发性病灶;⑥既往存在食管放疗史、外科手术史;⑦术后病理示基底切缘、侧切缘病变残留,或伴脉管转移;⑧妊娠或哺乳期妇女。
1.3 方法
1.3.1 研究方法 收集患者一般资料,统计性别、年龄、既往史(高血压、糖尿病、吸烟史、饮酒史、家族史)、病变位置、病变形态、病理类型、组织浸润深度、病变纵向长度、操作时间,分析黏膜环周缺损范围(<1/2环周、1/2~3/4环周、3/4~<1环周)及ESD手术并发症,观察ESD术后食管狭窄发生情况,并采用多因素Logistic回归分析法分析术后食管狭窄的独立影响因素,评价食管黏膜环周缺损范围对ESD术后食管狭窄的预测价值。
1.3.2 ESD手术方法 所有患者均接受ESD手术治疗。术前行常规检查,包括心电图、血液等,伴糖尿病、高血压者待病情基本稳定时进行手术。所有病例行咽部麻醉,手术时取患者侧卧位,行常规GIF-H260J胃镜(日本Olympus公司生产)检查。胃镜前端行ND201-11802透明帽安置,按病灶具体状况并结合术者习惯合理选择刀具(包括KD-611 IT刀、KD-650Q Dual刀、KD-620LR Hook刀),行病灶外缘标记。于黏膜下多点注射亚甲蓝混合液+生理盐水+肾上腺素,充分抬举病灶,借助IT刀、Hook刀或Dual刀,顺着标记点外0.5 cm处环周予以切开处理,逐步剥离病灶下方黏膜下层。剥离完毕后,创面可见小血管行APC凝固处理,或行ESD专用热止血钳处理。术毕回收、展开病变黏膜,采用大头钉将其固定于软木板上,明确病灶组织完整后送检,探查两侧、底部切缘有无肿瘤组织。术后行胃黏膜保护剂、质子泵抑制剂常规剂量治疗4周。术后1~3个月复查胃镜,予以食管卢戈液染色检查,观察创面溃疡愈合状况,创面边缘予以多点组织活检,若提示肿瘤性病变,则再次行ESD手术治疗;若未发现肿瘤性病变,则继续随访。
1.4 观察指标
观察ESD术后食管狭窄发生情况,并统计患者一般资料,包括年龄、性别、既往史、病变位置、病变形态、病理类型、组织浸润深度、黏膜环周缺损范围等,分析ESD术后食管狭窄的危险因素,并评价食管黏膜环周缺损范围对ESD术后食管狭窄的预测价值。术后食管狭窄判定标准[6]:患者出现吞咽困难,或一个标准胃镜(直径为9.8 mm)难以通过狭窄处,则判定为食管狭窄。术后食管狭窄程度分级[6]:①Ⅰ级:食管直径处于0.6~1.0 cm之间,可进半流质饮食;②Ⅱ级:食管直径处于0.3~0.5 cm之间,进流质饮食;③Ⅲ级:食管直径低于0.3 cm,进流质饮食相对困难。
1.5 统计学方法
2 结果
2.1 ESD术后食管狭窄发生情况分析
入组患者共86例,ESD术后随访周期为3个月,无失访病例。86例患者中,术后食管狭窄11例,占12.79%,其中食管Ⅰ级狭窄7例(63.64%),Ⅱ级狭窄3例(27.27%),Ⅲ级狭窄1例(9.09%),均纳入食管狭窄组;其余75例术后未发生食管狭窄,占87.21%,纳入非食管狭窄组。
2.2 影响食管黏膜病变患者ESD术后食管狭窄的单因素分析
单因素分析结果显示,食管黏膜病变患者ESD术后食管狭窄与黏膜环周缺损范围、组织浸润深度有明显相关性(P<0.05),见表1。

表1 影响食管黏膜病变患者ESD术后食管狭窄的单因素分析
注:#取校正检验卡方值;M1指肿瘤限于上皮层,M2指肿瘤浸润达黏膜固有层,M3指肿瘤浸润达黏膜肌层,SM1指肿瘤浸润深度大于黏膜下层上1/3(即深度距黏膜肌层下缘小于200 μm)
2.3 食管黏膜病变患者ESD术后食管狭窄的多因素Logistic回归分析
以食管黏膜病变患者ESD术后出现食管狭窄为因变量,以上述存在差异的单因素为自变量,纳入Logistic回归分析模型,行量化赋值,见表2。结果显示,黏膜环周缺损范围是食管黏膜病变患者ESD术后食管狭窄的独立影响因素(P<0.05),见表3。

表2 量化赋值表

表3 食管黏膜病变患者ESD术后食管狭窄的多因素Logistic回归分析
2.4 食管黏膜环周缺损范围对ESD术后食管狭窄的预测价值
食管狭窄组黏膜环周缺损平均范围为(75.40±10.52)%,显著高于非食管狭窄组的(54.20±9.57)%,差异有统计学意义(t=6.779,P=0.000)。经ROC曲线处理,结果显示食管黏膜环周缺损范围对ESD术后食管狭窄有一定预测价值,曲线下面积为0.728(标准误0.080,P<0.001,95%CI=0.572~0.885),预测ESD术后食管狭窄最佳截断值为71.00%(即黏膜环周缺损范围为管腔环周的71.00%),敏感度0.867,特异性0.813,见图1。
2.5 典型病例图片
男,53岁,图2A内镜下见食管黏膜环5/6病变,表现为卢戈氏碘液染色后,食管黏膜病变处呈近环周不染区,图2B为ESD术后创面,可见食管黏膜近环周缺损,仅保留条形正常黏膜,图2C为食管ESD术后送检标本,病灶完整切除。图2D为食管ESD术后狭窄,表现为食管ESD处瘢痕挛缩,管腔狭窄,直径约0.3 cm,内镜无法通过。
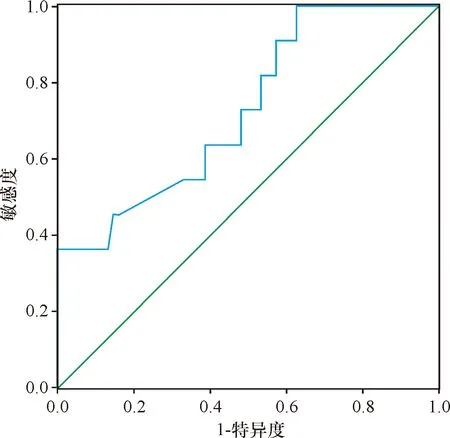
图1 食管黏膜环周缺损范围预测术后食管狭窄的ROC图
3 讨论
ESD术是治疗消化道良性肿瘤、早癌及癌前病变的重要手段,有研究表明,较大的食管黏膜病变(包括环周食管黏膜病变)可通过ESD技术实现有效切除,创伤小、恢复快、基本不改变胃肠道结构,且基本不会产生病灶残留及复发问题[7]。但食管黏膜病变患者接受ESD术治疗,术后容易出现出血、穿孔、食管狭窄等并发症。既往报道显示ESD术后食管狭窄发生率高达11.60%[8]。董会娟等[9]发现食管早癌患者ESD术后食管狭窄发生率为13.20%。本研究结果显示,86例患者中,术后食管狭窄发生率为12.79%,与上述报道相接近。但也有报道认为早期食管癌患者ESD术后食管狭窄发生率高达44.83%,与本结论存在较大偏差,可能与样本量大小、肿瘤浸润深度等因素有关[10]。分析ESD术后导致食管狭窄可能的机制,主要与黏膜愈合延迟、黏膜下层炎症反应和纤维化及固有肌层萎缩有关[11]。动物实验表明,ESD术后食管狭窄与黏膜下层纤维化增生、固有肌层改变密切相关[12]。 陈萌等[13]也发现创面愈合过程中固有肌层萎缩纤维化与ESD术后食管狭窄有关。笔者认为,ESD术中固有肌层损伤可能加重后期固有肌层纤维化,故术中应尽可能避免损伤固有肌层,降低术后食管狭窄发生率。
本研究结果显示,黏膜环周缺损范围是食管黏膜病变患者ESD术后食管狭窄的独立影响因素,与庄耘等[14]报道一致。范秀琴等[15]也认为环周缺损范围是ESD术后食管狭窄的独立影响因素。既往报道认为黏膜环周缺损范围≥管腔环周3/4时,术后食管狭窄高达76%~100%;黏膜环周缺损范围为管腔环周的1/2~3/4时,术后狭窄率为5%~28%,而黏膜环周缺损范围<管腔环周1/2时,ESD术后食管狭窄率极低,提示黏膜环周缺损范围与食管黏膜病变患者ESD术后食管狭窄有关[16]。本研究结果显示,食管黏膜环周缺损范围对ESD术后食管狭窄有一定预测价值,曲线下面积为0.728,预测ESD术后食管狭窄最佳截断值为71.00%(即黏膜环周缺损范围为管腔环周的71.00%),此时敏感度、特异性分别为86.70%、81.30%,进一步证实ESD术后食管狭窄与黏膜环周缺损范围密切相关。分析其原因,黏膜环周缺损会引起急性炎症反应,导致医源性深溃疡,诱发食管局部黏膜下纤维结缔组织增生,引起胶原大量沉积,导致食管壁纤维化,最终形成食管狭窄,且黏膜环周缺损累及范围越大,ESD术后食管狭窄发生风险可能越高。
本研究结果显示,食管黏膜病变患者ESD术后食管狭窄与组织浸润深度有明显相关性,与唐健等[17]报道相符。杨志豪等[18]也发现组织浸润深度为M2是食管早癌及癌前病变患者ESD术后食管狭窄的危险因素。组织浸润深度越深,环周缺损范围可能越大,形成纤维化厚度越深,加剧纤维化程度,ESD术后食管狭窄程度可能越重。但本研究发现,组织浸润深度并非是食管黏膜病变患者ESD术后食管狭窄的独立危险因素,可能与研究对象的选择、样本量大小等因素有关。另有报道发现ESD术后食管狭窄的发生与黏膜剥离纵径长度呈正相关,手术时在保证病变完全切除前提下应尽可能缩小黏膜剥离纵径长度;同时,ESD术后食管狭窄的发生还与局部过深的热损伤、活动性出血的凝烧时间较长、病变部位有关,其中食管上段病变狭窄比例较高,主要与食管上段本身较食管其他部位管腔小有关[19-21]。而本文鉴于样本量较少,尚未探讨或发现上述因素与ESD术后食管狭窄的关系,有待今后扩大样本量进一步分析。
鉴于黏膜环周缺损范围是ESD术后食管狭窄的危险因素,笔者认为,应根据不同黏膜环周缺损范围进行预防性治疗。当黏膜环周缺损范围低于管腔环周1/2时,因ESD术后食管狭窄率极低,故无需术后食管狭窄相关预防治疗;若其范围为管腔环周的1/2~3/4时,口服激素(如泼尼松等)或行内镜下球囊扩张,但后者创伤大、并发症多(包括出血、穿孔等),故口服激素预防术后食管狭窄更易被患者接受;若其范围大于管腔环周3/4时,通常预防性口服激素,或予以支架置入或球囊扩张等治疗。
综上,早期食管黏膜病变患者ESD术后食管狭窄与食管黏膜环周缺损范围有关,且食管黏膜环周缺损范围对术后食管狭窄具有重要的预测价值,临床应引起足够重视。但本文因样本量偏小,观察时间较短,未深入探讨术后食管狭窄的防治,故今后需进一步深入探讨。
