单次高剂量放疗对小鼠心脏的病理学改变及机制探讨
2019-10-17王升晔封巍程国平陈梦圆陈明
王升晔 封巍 程国平 陈梦圆 陈明
大分割放疗如立体定向放射治疗(stereotactic body radiotherapy,SBRT)等使肿瘤受到较大生物有效剂量放疗时,也增加了临近及放疗区域内正常器官的放射损伤。胸部肿瘤的大分割放疗主要引起心、肺等器官的损伤。胸部放疗引起的心脏疾病有很多,包括心肌病变或纤维化、心包炎症、心脏瓣膜损伤、冠状动脉事件、心脏传导问题甚至发生猝死[1-3]。放射治疗的射线能引起一系列炎症级联应激事件,从而导致细胞核等结构的相关损伤。已有的实验研究表明,心脏受到辐照后,心肌炎症和内皮细胞损伤以及毛细血管密度减低等可以在心脏功能性损伤前就发生[4-6]。也有研究发现,在无症状表现的确诊有心脏疾病的乳腺癌放疗患者中,放疗后6个月出现区域性的心脏灌注缺失。上述研究结果显示,早期的心脏微血管损伤有导致严重心功能损伤的可能性。目前,放疗学家们逐渐关注到放疗引起的心脏疾病所带来的风险,而放疗相关心脏疾病的发生机制及与心脏微血管损伤、动脉粥样硬化等的关系还未明确。本研究旨在探讨小鼠心脏受到大分割单次16Gy放疗后,其心脏病理学结构改变和可能机制,现报道如下。
1 材料和方法
1.1 实验动物 由浙江中医药大学提供20只8~10周的SPF级C57BL/6J家系的雄性小鼠,体重约(20±2)g,所有小鼠在同一天入组,采用随机区组法被分为对照组1、对照组2,放疗组1、放疗组2:对照组1、放疗组1小鼠入组12周时被处死,对照组2、放疗组2小鼠入组30周时被处死。5只小鼠为一组,在温控约22℃、相对湿度约70%的动物饲养房内分笼饲养,每天进行照明与黑暗交替,每12h更替一次,即20:00~8:00熄灯,用标准的水和食物给予喂养。实验操作中严格遵照浙江中医药大学的动物实验室相关规章制度,依照动物伦理学的要求对待所有实验小鼠。
1.2 实验试剂 抗体:Anti-CD34(ab81289,上海艾博抗贸易有限公司,免疫组化稀释比1∶400);Anti-Von Willebrand Factor(ab9378,上海艾博抗贸易有限公司,免疫组化稀释比1∶100)。其他辅助试剂:10%的中性福尔马林缓冲液,苏木精液,HRP标记的抗兔二抗,pH值为7.4~7.6的磷酸缓冲盐溶液,pH值为9.0的乙二胺四乙酸修复液。
1.3 方法
1.3.1 放疗步骤 清醒状态下未行麻醉的实验小鼠每组5只仰卧位并排于板上,用可调节夹具固定和限制小鼠的胸部和躯干,并用纸胶进一步将小鼠固定在板上。用单次剂量为16Gy的6MVX线照射放疗组小鼠的胸部包括心脏区域,照射范围为10.6mm×15mm。为保证小鼠的心脏能够全部受到辐照,放疗区域将少于1/3的肺组织也包括在内。放疗组1、2均在入组第1天完成单次照射。
1.3.2 样本采集 按实验设计对入组的小鼠观察12周和30周,之后对其麻醉并用颈椎脱臼法处死,立即尸解其心脏。将心脏组织在0.1mol/L磷酸缓冲液中漂洗2次,切取小块心脏组织,大小为1cm3左右,经固定、水洗、脱水、透明、浸蜡包埋等步骤制作标本包埋块。经石蜡包埋、制作蜡块并常规切片,进行HE染色及免疫组化染色检测。
1.3.3 免疫组化检测 采用二步法的免疫组化方法。石蜡切片经二甲苯脱蜡、梯度乙醇溶液脱水后,用抗原高压热修复,加入一抗后在室温下孵育1h,加入二抗于室温下30min,3,3’-二氨基联苯胺四盐酸盐显色,苏木精液复染后,经过脱水、透明、封片,用显微镜观察。阳性对照按照产品说明书采用已知为阳性表达的组织,阴性对照用磷酸缓冲盐溶液替代。
1.3.4 微血管密度(microvascular density,MVD)计算方法 参照Weidner的计算方法[7],首先在低倍镜视野下(×100倍)选择MVD最高的3个热点视野,然后在高倍镜下(×100倍)计数3个视野内的微血管数量,取3者的平均值作为一个心脏标本的MVD值。无论管腔存在与否,单个阳性染色细胞或细胞团均可作为一个微血管,而管腔截面比8个红细胞大的血管则不能算为微血管。经CD34+或vWF标记的免疫组化染色后组织切片也行MVD计数,此时将棕黄染色的内皮细胞或内皮细胞簇作为一条微血管。
1.3.5 心外膜厚度的测量 取每只小鼠左心室壁(包括壁膜间隔成分)的心脏组织,经包埋蜡块、切片及HE染色后,在低倍镜下(×100倍)选取每个心脏标本心外膜的不同部位,然后在高倍镜下(×400倍)对每个心脏标本行12次外膜厚度测量,计算平均值作为该心脏标本的心外膜厚度。每组小鼠再取平均值作为该组的心外膜厚度。
1.4 统计学处理 采用SPSS20.0统计软件,符合正态分布的计量资料以表示,两组比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 放疗结果 放疗组2中的1只小鼠在放疗后29周4天时发生猝死。其余小鼠在规定的相应时间被处死。
2.2 12周时两组小鼠心脏MVD计数比较 见图1-3、表 1。

表1 12周时两组小鼠心脏MVD计数比较
由图1-3和表1可见,小鼠经单次大分割放疗后12周时,心外膜和心肌上的巨噬细胞含铁血黄素有所增加,弹性纤维被破坏,呈现为杂乱无序,并可见肿胀的内皮细胞和横纹肌细胞。放疗组1小鼠心脏HE染色下MVD较对照组1明显减少(P<0.01);CD34+和vWF标记的MVD明显增加(均P<0.01)。
2.3 30周时两组小鼠心脏MVD计数比较 见图4-6、表 2。
由图4-6和表2可见,小鼠经单次大分割放疗后30周时,心外膜和心肌上的巨噬细胞及其含铁血黄素有进一步的增加,更多的弹性纤维被破坏甚至断裂,杂乱无序的表象更为明显,肿胀的内皮细胞和横纹肌细胞在镜下随处可见。放疗组2小鼠心脏HE染色下MVD较对照组2明显减少(P<0.01);CD34+和vWF标记的MVD明显增加(均P<0.01)。
2.4 12周和30周时两组小鼠心外膜厚度比较 12周时放疗组1小鼠心外膜厚度为20.6μm,对照组1为 9.4μm;30周时放疗组2小鼠心外膜厚度为22.2μm,对照组2为10.2μm。随着时间的延长,放疗组2心外膜较对照组2明显增厚,见图7。
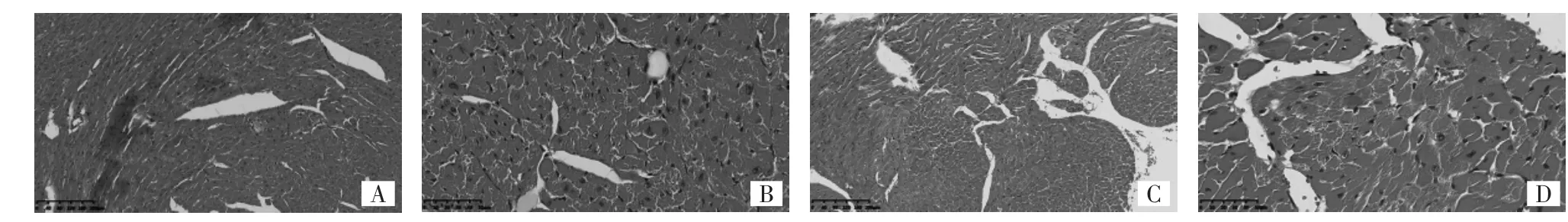
图 1 12 周时小鼠心肌组织 HE 染色图(A:对照组 1,×100;B:对照组 1,×400;C:放疗组 1,×100;D:放疗组 1,×400)

图2 12周时小鼠心肌组织CD34+标记的免疫组化染色图(A:对照组 1,×400;B:放疗组 1,×400)

图3 12周时小鼠心肌组织vWF标记的免疫组化染色图(A:对照组1,×400;B:放疗组 1,×400)

表2 30周时两组小鼠心脏MVD计数比较

图 4 30 周时小鼠心肌组织 HE 染色图(A:对照组 2,×100;B:对照组 2,×400;C:放疗组 2,×100;D:放疗组 2,×400)
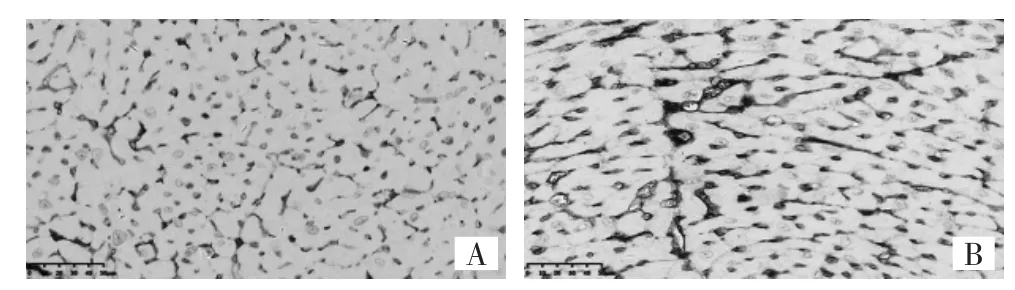
图5 30周时小鼠心肌组织CD34+标记的免疫组化染色图(A:对照组 2,×400;B:放疗组 2,×400)

图6 30周时小鼠心肌组织vWF标记的免疫组化染色图(A:对照组2,×400;B:放疗组 2,×400)

图7 30周时小鼠心外膜染色图(A:放疗组2;B:对照组2;HE染色,×400,箭头示心外膜)
3 讨论
近年来,放疗学家们对于放疗所造成的细胞毒 性及其辐射损伤日益关注。辐射损伤造成小鼠相关脏器组织的病理生理学改变的研究也时有报道。心脏作为对辐射较为敏感的靶器官,其大体结构和微血管结构存在着放射剂量和时间上的相关性和依赖性。大分割剂量的放疗可能造成较严重的心脏损伤,且可能放疗后早期就发生,损伤随着时间的推移而进展。从放疗后12周和30周处死的小鼠心脏标本来看,放疗组小鼠的心外膜较对照组显著增厚;提示放疗组小鼠心脏纤维广泛增厚。接受单次16Gy胸部放疗的小鼠在放疗后早期,即12周时,内皮细胞的丢失大于细胞的增殖,MVD呈下降趋势,30周时MVD出现进一步下降。
CD34+分子是一种黏附分子,属于钙黏蛋白家族。它可以在哺乳动物包括人类的造血祖或干细胞的表面有选择地表达。它以受体-配体相结合的方式起作用,是参与细胞间信号递呈、免疫应答、炎症发生和凝血反应等多个病理生理过程的主要分子[8]。血管性假血友病因子(von Willebrand Factor,vWF)由血管巨核细胞及内皮细胞生成和分泌,参与止血过程。缺乏vWF可造成血管性假血友病。在内皮细胞受到损伤或刺激时,血浆vWF的数量出现增高[9]。当出现持续进展的血管渗漏,微血管结构受到损害,CD34+和vWF的表达增多,提示内皮细胞受损[10-12]。多个研究认为,受到剂量较高的放疗时心脏组织中能发现心肌白蛋白沉积,这与淀粉样变性相关,提示血管的渗漏[13-14]。淀粉样变性由异常原纤维或胞外不溶性物沉积而成,也可能由错误折叠的蛋白质汇聚形成,其重要的临床特点是会导致心脏衰竭[15],由此我们推断这可能是导致个别小鼠在随访后期出现猝死的潜在原因。
多个研究提示,尽管经辐射后小鼠的血管结构和功能已经受到了较大程度的损伤,但其心功能的改变在早期是较小的,并不是进展性的。由此推断小鼠心肌的重组、重构在一定程度上可能代偿了部分血管结构改变和功能损伤[16]。个别小鼠在放疗后不到30周时死亡,最可靠的方法是可以用尸检来明确其真正死因。除了之前提及的淀粉样变是可能的原因外,另一个可能原因是心肌的这种代偿机制在较高剂量辐照下并非能较长时期保持。离体的实验结果提示,受到早期炎症反应激发后,心肌细胞相应发出明显信号[17],该过程可直接产生大量的巨噬细胞。心肌细胞与巨噬细胞之间的这种相互反应,使心肌收缩力出现下降从而使心脏舒张期和收缩期的充盈程度均下降。心肌收缩力的减退可以用心肌细胞减少和胶原黏着增加来部分解释[18]。内质网膜上的Ca2+-ATP酶可以代偿损伤心肌的部分功能,以尽可能保持正常的舒张和收缩能力。
本研究提示小鼠心脏接受单次16Gy放疗后,观察12周和30周后处死,放疗组小鼠心外膜较对照组有明显增厚;MVD逐渐下降,提示内皮细胞的减少,同时用CD34+和vWF标记的MVD逐渐增加,也相应提示内皮细胞损伤。限制性心包炎可以造成炎症细胞和含铁巨噬细胞的增多,常常伴有心外膜增厚;这种限制性的心肌重塑可能造成舒张期和收缩期心脏大血管和心肌表面的淀粉样变沉积,从而可能加重血管渗漏。这个机制或许能部分解释小鼠猝死的原因。
本研究是对单次大分割放疗后的小鼠心脏的病理学研究,因样本量和实验条件的限制,仅对其病理改变行HE、免疫组化等较基本的病理学研究,为人体心脏放射损伤的机制提供了部分依据。未来的研究可以建立高血压或者动脉粥样硬化的小鼠模型,并对其心脏进行不同放疗分割剂量的照射,来进一步观察建模小鼠在不同放疗分割剂量下的心脏病理改变。