二甲双胍对LPS诱导小鼠急性肺损伤的保护作用
2019-10-17王贵佐张叶钦王少纯张永红
王贵佐,韩 冬*,张 薇,张叶钦,王少纯,张永红
(1陕西省人民医院呼吸与危重症医学科,西安 710068;2西安交通大学第二附属医院呼吸与危重医学科;*通讯作者,E-mail:sesory@yeah.net)
急性肺损伤(acute lung injury,ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是指由心源性以外的各种肺内、外致病因素导致的急性、进行性呼吸衰竭,其主要病理特征为肺泡上皮细胞及毛细血管内皮细胞损伤,通透性增高,富含蛋白质的液体大量渗出,造成弥漫性肺泡及肺间质水肿,进而透明膜形成,甚至出现肺间质纤维化[1]。目前研究发现ALI/ARDS的发病机制包括炎症反应/抗炎反应、氧化反应/抗氧化反应的失衡,其发病率及病死率极高,尚无有效的治疗药物[2]。因此,开发新的治疗药物对于ALI/ARDS的治疗具有重要的临床实践意义。
腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是一种丝氨酸/苏氨酸蛋白激酶,AMPK可促进ATP的产生,抑制分解,是广泛参与人体糖、蛋白质和脂肪代谢的重要蛋白激酶。AMPK常见的激动剂有二甲双胍及AICAR等[3],研究发现,激活腺苷酸活化蛋白激酶可对急性肺损伤动物模型发挥保护作用[4],其作用机制尚待研究。对糖尿病小鼠模型研究发现,激活AMPK可以上调PGC1α的表达,增强抗氧化能力,减轻糖尿病肾病损害[5]。然而激活AMPK对急性肺损伤的保护作用是否通过上调PGC1α尚不明确。
在本研究中,通过LPS诱导的小鼠急性肺损伤模型,评估二甲双胍激活AMPK信号通路对急性肺损伤发挥保护作用及可能的机制,为急性肺损伤治疗提供新的思路与方法。
1 材料与方法
1.1 实验动物与主要试剂
6-8周龄雄性SPF级BALB/c小鼠(动物生产许可证SYXK(陕)2016-006),体质量20-25 g,由陕西省人民医院实验中心提供。二甲双胍(格华止,国药准字H20023371),由上海施贵宝制药有限公司提供。脂多糖[Lipopolysaccharide(LPS),Escherichia coli 055:B5]购于Sigma-Aldrich。兔抗鼠AMPK、p-AMPK一抗购于美国Cell Signaling Technology公司,兔抗鼠PGC1α抗体来源于美国Novus Biological,HRP偶联的羊抗兔抗体由美国Sigma-Aldrich提供,髓过氧化物酶(MPO)检测试剂盒购于南京建成生物工程研究所。RIPA裂解液由武汉博士德生物工程有限公司提供。
1.2 模型制作和实验分组
6-8周龄雄性BALB/c小鼠15只随机分为:对照组,气管内滴注无菌PBS 60 μl,作用24 h;LPS模型组(LPS),气管插管,气道内滴注1 mg/ml LPS 60 μl,作用24 h;二甲双胍组(Met+LPS),在气管插管气道滴注LPS前30 min,腹腔注射二甲双胍(250 mg/kg),再气管内滴注1 mg/ml LPS 60 μl,作用24 h。小鼠均在陕西省人民医院实验中心SPF级动物房饲养,气道给药24 h后处死小鼠。
1.3 支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)及肺组织样本采集
造模后24 h,腹腔注射10%水合氯醛0.8 ml/100 g处死小鼠,用4 ℃预冷无菌PBS 0.7 ml支气管肺泡灌洗,重复灌洗3次,支气管肺泡灌洗液的回收率达80%。BALF在4 ℃,1 000g,离心10 min。分别收集上清和沉淀,BALF上清液在-80 ℃保存备用。细胞沉淀用无菌PBS重新重悬,利用细胞计数板进行细胞计数。取细胞沉淀涂片,瑞氏染色,计数中性粒细胞。分离右肺组织并在-80 ℃保存。
1.4 肺组织病理学检查
取出分离后的左肺组织利用10%中性缓冲甲醛液固定,石蜡包埋,切片(5 μm),苏木精-伊红(HE)染色,观察肺组织病理学变化。
1.5 髓过氧化物酶(MPO)活性检测
MPO活性是中性粒细胞功能标志和启动标志,肺组织内中性粒细胞大量聚集可导致MPO活性明显升高。称取一定重量的肺组织,加入5倍体积4 ℃预冷的生理盐水,利用超声法制作组织匀浆,利用南京建成生物工程研究所提供的MPO检测试剂盒在460 nm波长处进行比色测定,从而得出MPO的活力,其活力高低反映炎症的严重程度。
1.6 免疫印迹法检测PGC1α、AMPK及p-AMPK
精密称取各组小鼠肺组织,根据RIPA裂解液使用说明书制备肺组织匀浆,肺组织与RIPA裂解液的比例为1 mg ∶7.5 μl,用玻璃匀浆器上下、旋转充分碾磨。在冰上裂解1 h后,14 000g离心20 min,取上清,利用Western blot检测各组小鼠肺组织PGC1α(1 ∶800)表达、AMPK(1 ∶500)及p-AMPK(1 ∶500)变化,PGC1α表达应用GAPDH(1 ∶5 000)作为内参校正。
1.7 统计学分析

2 结果
2.1 二甲双胍对肺组织病理改变的影响
LPS模型组内皮细胞和上皮细胞被严重破坏,肺水肿、肺出血及以中性粒细胞为主的炎症细胞在肺组织内大量浸润,肺部正常的组织形态结构消失;二甲双胍治疗组显著抑制LPS诱发的肺组织上述改变;对照组未见小鼠肺组织内明显的炎症反应(见图1)。
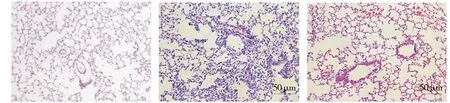
A.对照组 B.LPS组 C.Met+LPS组图1 二甲双胍对LPS诱导小鼠急性肺损伤病理改变的影响 (HE染色,×200)Figure 1 Effect of metformin on pathological changes of LPS-induced acute lung injury in mice (HE staining,×200)
2.2 二甲双胍对小鼠肺组织浸润炎症细胞数的影响
与对照组相比,气道内滴注LPS后24 h,BALF 中的炎症细胞总数显著升高(P<0.01),与之相对应的是肺组织内中性粒细胞数同样显著升高(P<0.01),而应用二甲双胍预处理后,以中性粒细胞为主的炎症细胞总数在肺组织内的浸润显著减轻(见图2)。

与对照组比较,*P<0.01;与LPS模型组比较,#P<0.01图2 二甲双胍对小鼠支气管肺泡灌洗液内浸润炎症细胞数的影响 (n=4)Figure 2 Effect of metformin on inflammatory cell numbers in BALF of mice (n=4)
2.3 二甲双胍对MPO活性的影响
与对照组相比,LPS模型组肺组织内代表中性粒细胞聚集数目的MPO活性显著升高(P<0.01,见图3),给予二甲双胍预处理后,MPO活性显著下降。提示AMPK激动剂二甲双胍预处理可显著减轻LPS诱导小鼠急性肺损伤炎症反应程度。
2.4 二甲双胍对肺组织内PGC1α表达的影响
进一步探讨AMPK激动剂二甲双胍对过氧化物酶体增殖活化受体γ共激活因子-1α(peroxisome proliferator-activated receptor γ coactivator 1α,PGC1α)表达的影响。Western blot结果显示,与对照组比较,LPS模型组小鼠肺组织内PGC1α的表达明显减少,应用二甲双胍提前干预处理后,肺组织内PGC1α表达较前显增加(见图4)。提示二甲双胍可诱导PGC1α的表达。

与对照组比较,*P<0.01;与LPS模型组比较,#P<0.01图3 二甲双胍对肺组织内MPO活性的影响 (n=4)Figure 3 Effect of metformin on MPO activity in lung tissues (n=4)
2.5 二甲双胍对急性肺损伤小鼠肺组织AMPK磷酸化水平的影响
AMPK是二甲双胍的主要分子靶点。因此本研究中探讨二甲双胍在LPS诱导的急性肺损伤模型中,对AMPK磷酸化水平的影响。Western blot结果显示,与对照组比较,LPS模型组小鼠肺组织内P-AMPK的水平明显下降,应用二甲双胍提前干预处理后,肺组织内P-AMPK水平较前显著增加(见图5)。提示二甲双胍可显著增加肺组织内p-AMPK水平。
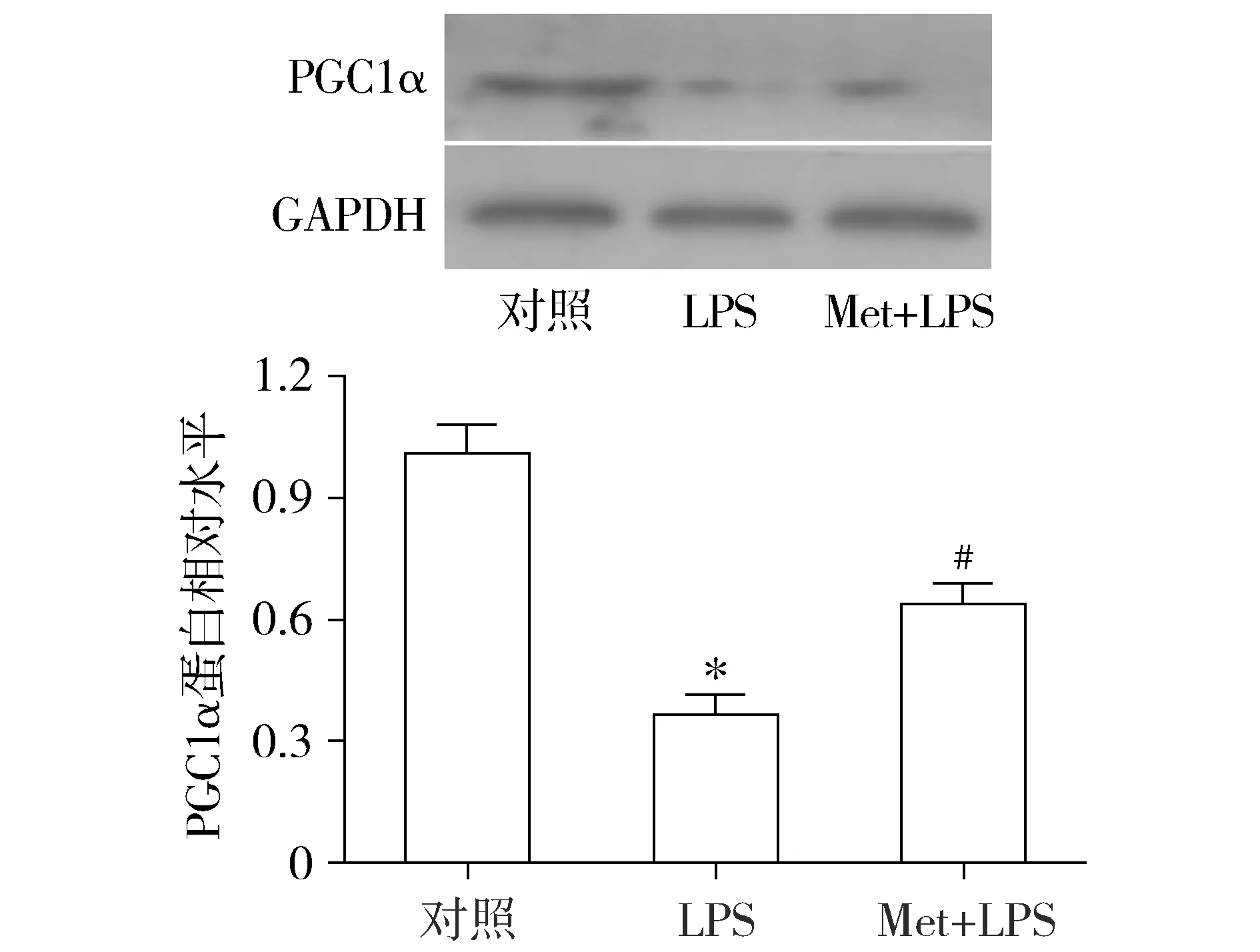
与对照组比较,*P<0.01;与LPS模型组比较,#P<0.05图4 Western blot检测二甲双胍对肺组织内PGC1α表达的影响 (n=3)Figure 4 Effect of metformin on the expression of PGC1α in lung tissue by Western blot (n=3)

与对照组比较,*P<0.01;与LPS模型组比较,#P<0.01图5 Western blot检测二甲双胍对肺组织内AMPK磷酸化水平的影响 (n=3)Figure 5 Effect of metformin on phosphorylation of AMPK in lung tissue by Western blot (n=3)
3 讨论
本研究提示二甲双胍通过激活AMPK对LPS诱导的小鼠急性肺损伤发挥保护作用,同时研究显示这种保护作用伴随PGC1α表达的增加。这为研究激活AMPK对急性肺损伤的保护作用提供了新的可能机制,为急性肺损伤治疗提供新的策略。
二甲双胍是AMPK的有效激动剂。目前主要用于2型糖尿病的治疗,在临床中应用已有50余年,具有良好的安全性和性价比。临床研究发现应用二甲双胍治疗的糖尿病患者血清中,C反应蛋白和炎症因子的水平显著下降[6,7],这提示二甲双胍在降低血糖的同时也抑制了患者体内异常的炎症反应,提示AMPK激动剂除具有降糖作用外,可能还具有抗炎的作用。研究发现配体激活AMPK在多种细胞类型中具有抗炎和免疫抑制作用,因此在多种疾病的治疗中具有潜在价值[8-10]。研究发现AICAR和berberine通过激活AMPK信号通路对LPS诱导急性肺损伤小鼠发挥保护作用[11]。Tsaknis等[12]研究发现二甲双胍可通过降低肺泡微血管通透性从而对机械通气诱导的小鼠肺损伤发挥保护作用。然而激活AMPK对上述疾病保护作用的具体机制尚待研究。本研究同样提示二甲双胍通过激活AMPK从而对LPS诱导小鼠急性肺损伤发挥保护作用。这种保护作用表现在以中性粒细胞为主的炎症细胞在肺组织内浸润显著减少,脂质过氧化产物MDA含量明显下降,这提示二甲双胍通过激活AMPK从而对LPS诱导小鼠急性肺损伤发挥保护作用。
本研究进一步探索了激活AMPK对急性肺损伤发挥保护作用的机制。过氧化物酶体增殖活化受体γ共激活因子-1α(peroxisome proliferator-activated receptor γ coactivator 1α,PGC1α)是生物体重要共激活转录因子,研究发现沉默PGC1α可导致抗氧化防御体系的酶(SOD1和SOD2等)表达下降,抗氧化应激的能力减弱,而过表达PGC1α可上调上述抗氧化酶的表达,增强抗氧化能力,对动物模型发挥保护作用,提示PGC1α在抗氧化应激方面发挥重要作用。对骨骼肌、弗里德的共济失调(Friedreich’s ataxia)和糖尿病小鼠模型研究发现,激活AMPK,可上调PGC1α的表达,增强抗氧化能力,对上述动物模型发挥保护作用[5,13-15],提示PGC1α可能是AMPK下游靶蛋白。Guan等[16]研究发现,雷公藤红素通过激活AMPK上调PGC1α表达,减轻氧化应激,从而对糖尿病大鼠骨骼肌起保护作用,上述研究均提示PGC1α可能成为疾病作用新的靶点。然而激活AMPK能否通过上调PGC1α表达从而对LPS诱导急性肺损伤小鼠发挥保护作用尚未可知。本研究显示二甲双胍通过激活AMPK对小鼠急性肺损伤发挥保护作用,这种保护作用伴随PGC1α表达的上调,提示激活AMPK对LPS诱导小鼠急性肺损伤的保护作用可能与PGC1α上调有关。本研究为急性肺损伤/急性呼吸窘迫综合征提供新的治疗思路。
