胰岛素对大鼠牙周膜细胞增殖及其炎性因子表达的影响
2019-10-16王方郝欢萌逯宜
王方 郝欢萌 逯宜
[摘要]目的:研究胰岛素对大鼠牙周膜细胞增殖及其炎性因子表达的影响。方法:分离培养原代大鼠牙周膜细胞,在体外高糖培养液培养,分别加入浓度为0nmol/L、25nmol/L、50nmol/L和100nmol/L的胰島素,0nmol/L浓度为对照组,其余均为实验组,用不同浓度的胰岛素处理细胞后,MTT法检测大鼠牙周膜细胞增殖水平变化;根据MTT实验结果,选取25nmol/L浓度胰岛素处理组为实验组,进行炎性因子表达差异研究,实时定量RT-PCR检测不同浓度胰岛素处理后炎性因子IL-1β、PGE2、TNF-α、IFN-γ、IL-10的表达;ELISA法检测IL-1β、PGE2、TNF-α、IFN-γ、IL-10含量;通过上述实验验证胰岛素对牙周膜细胞增殖及对牙周膜细胞炎性因子表达的影响。结果:与对照组相比,随着胰岛素浓度的增高,抑制作用越明显;在mRNA水平和蛋白水平,胰岛素处理的实验组牙周膜细胞,其炎性因子表达量均明显增高(P<0.05)。结论:胰岛素会抑制大鼠牙周膜细胞的增殖,且对牙周膜细胞的炎性因子表达有促进作用。
[关键词]牙周膜细胞;胰岛素;增殖;炎性因子;抑制作用
[中图分类号]R329.2+8 [文献标志码]A [文章编号]1008-6455(2019)10-0092-04
Abstract: Objective To study the effect of insulin on the proliferation of rat periodontal ligament cells and the expression of inflammatory factors. Methods Primary rat periodontal ligament cells were isolated and cultured in high glucose medium in vitro. The concentration of insulin was 0nmol/L, 25nmol/L, 50nmol/L and 100nmol/L. The control group was 0nmol/L. The rest were experimental groups. After treated with different concentrations of insulin, the proliferation level of rat periodontal ligament cells was detected by MTT assay. According to MTT test results, 25nmol/L insulin treatment group was selected as the experimental group, the difference of expression of inflammatory factors was studied. After treated with different concentrations of insulin, the proliferation level of rat periodontal ligament cells was detected by MTT test, and the expression of inflammatory factors IL-1β, PGE2, TNF-α, IFN-γ and IL-10 was detected by real-time quantitative RT-PCR. The contents of IL-1β, PGE2, TNF-α, IFN-γ and IL-10 were measured by ELISA. The effects of insulin on the proliferation of periodontal ligament cells and the expression of inflammatory factors in periodontal ligament cells were verified by the above experiments. Results Compared with the control group, the inhibition was more obvious with the increase of insulin concentration, and the expression of inflammatory factors in periodontal ligament cells treated with insulin increased significantly at the level of protein and mRNA (P<0.05). Conclusion Insulin can inhibit the proliferation of rat periodontal ligament cells and promote the expression of inflammatory factors in periodontal ligament cells.
Key words: periodontal ligament cells; insulin; cell proliferation; inflammatory factors; inhibitory action
牙周膜细胞(periodontal ligament cell,PDLC)是牙周组织的重要组成部分,是具有多向分化潜能的一类细胞,在生物体内发挥着多种不可替代的生物学功能[1],也是参与牙周组织再生过程的主要细胞类型之一[2-3]。因此对牙周膜细胞的生物学行为研究是近年来牙周组织健康,牙周组织再生的热点研究领域[4]。本文以大鼠原代牙周膜细胞为研究对象,在体外对其施加不同浓度胰岛素,研究胰岛素水平对大鼠PDLC细胞增殖及其炎性因子表达的影响。
1 材料和方法
1.1 材料:DMEM培养液(Gibco,美国)、胎牛血清(Gibco,美国)、PBS(Invitrogen,美国)、2mM谷氨酰胺、100U/ml青霉素(Amersham,美國)、原代培养器具盒(眼科剪、眼科镊、手术刀)、PrimeScript? RT Master Mix (Perfect Real Time)(Takara,中国)、SYBR Green Real-Time PCR Master Mixes(Thermo Fisher,美国)。
1.2 仪器:光学显微镜(Leica SE,日本)、实时定量PCR仪(ABI7500,美国)、多孔板酶标仪(Bio-Tech,美国)。
1.3 方法
1.3.1 大鼠原代牙周膜细胞获取及培养:配置含20%胎牛血清、100mg/L青-链双抗的高糖DMEM培养基,常规组织块法获取大鼠原代牙周膜细胞。1周后观察,有细胞爬出,每3d换液1次。待原代细胞生长至80%融合时,0.25%胰蛋白酶37℃消化,以1:3比例传代培养。
1.3.2 细胞分组和处理:取生长状态良好的第二代大鼠牙周膜细胞,消化细胞制成的细胞悬液,分别接种在96/24孔板中,每孔接种细胞密度分别为1×104/孔、1×105/孔,每组设3个重复孔。用10% FBS的DMEM培养基培养1d后,分别加入浓度为0nmol/L、25nmol/L、50nmol/L和100nmol/L的胰岛素进行处理,隔天换液,维持培养液中胰岛素浓度。对照组培养液不添加胰岛素,换液频率与实验组保持一致。
1.3.3 MTT检测细胞增殖:在相同培养条件下,分别在0d、12h、1d、2d、3d、5d、7d的培养时间点,取上述96孔板中培养的细胞,在每孔加入配制好的MTT(5mg/ml)20?l,放入细胞培养箱中孵育4h,吸弃培养基后加入DMSO 100?l,避光震荡15min,充分溶解晶状物,用酶标仪检测各孔在490nm处的吸光度OD值,绘制不同时间点实验组和对照组牙周膜细胞的生长曲线。
1.3.4 实时定量PCR检测原代细胞炎性因子mRNA的表达:根据MTT实验结果选取25nmol/L浓度胰岛素培养的牙周膜细胞,在培养第3天收集实验组和对照组细胞总RNA,按照Takara micro RNA逆转录试剂盒说明书逆转为cDNA,以GAPDH为内参进行实时定量PCR实验测定。炎性因子IL-1β、PGE2、TNF-α、IFN-γ、IL-10实时定量PCR引物序列如表1。
实时定量PCR检测反应体系(20μl):5×SYBR Green Real-Time PCR Master Mixes 4μl,10μmol/L的上、下游引物各0.2μl,cDNA模板2μl,ddH2O 13.6μl。反应条件:94℃ 5 min;94℃ 45s,55℃ 45s,72℃ 2min,35个循环;72℃ 10min。实验结果以GAPDH为内参,对各组实验结果进行归一化处理,采用相对定量法,表达量用GAPDH的倍数表示,用2-ΔΔCt法计算。
1.3.5 ELISA法检测细胞培养液中炎性因子的表达:采用ELISA试剂盒(96T,武汉华美生物) 分别对培养第7天培养液中的IL-1β、PGE2、TNF-α、IFN-γ、IL-10含量进行检测,实验步骤和操作方法严格按照试剂盒说明书进行,最后用酶标仪测定各炎性因子在细胞培养液中的浓度,绘制标准曲线,并根据标准曲线读取稀释后样本中各细胞因子的浓度,然后再按稀释倍数计算其实际浓度。
1.4 统计学分析:使用SPSS 13.0统计软件进行数据分析,行t检验,P<0.05时认为差异具有统计学意义。
2 结果
2.1 大鼠原代牙周膜细胞培养:组织块法培养1周后,用20倍显微镜观察细胞生长状况,大鼠原代牙周膜细胞呈长梭形,生长状态良好。见图1。
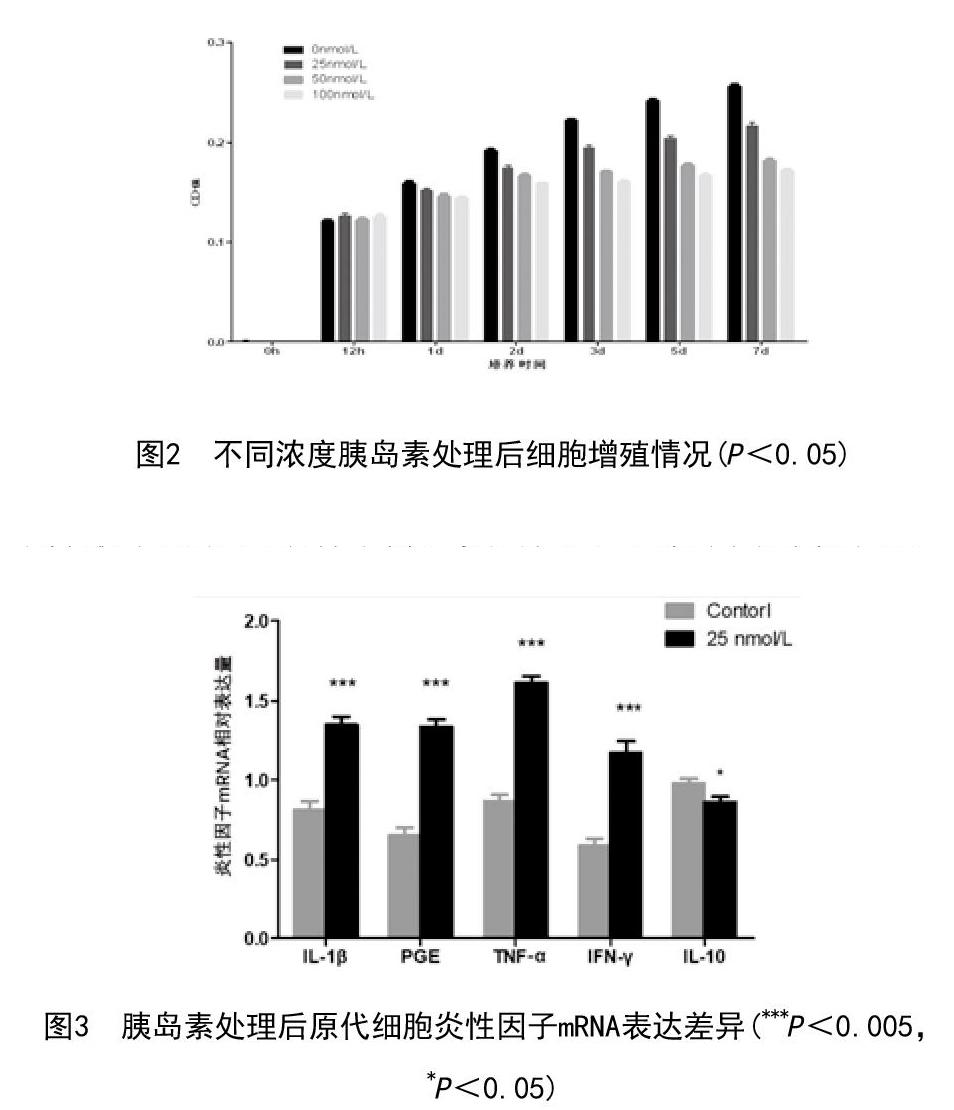
2.2 MTT检测细胞增殖:培养0d、12h、1d、2d、3d、5d、7d的牙周膜细胞MTT实验结果显示:在不添加胰岛素干扰时,牙周膜细胞的增殖状况良好,0~4d增殖速度较快,4~7d增殖趋于平稳,给予低浓度胰岛素干扰时(25nmol/L),细胞增殖速度较对照组明显降低(P<0.05),给予高浓度胰岛素时(50nmol/L、100nmol/L),细胞增殖受到明显抑制。在培养的第2天增殖曲线就已趋于平缓。见图2。
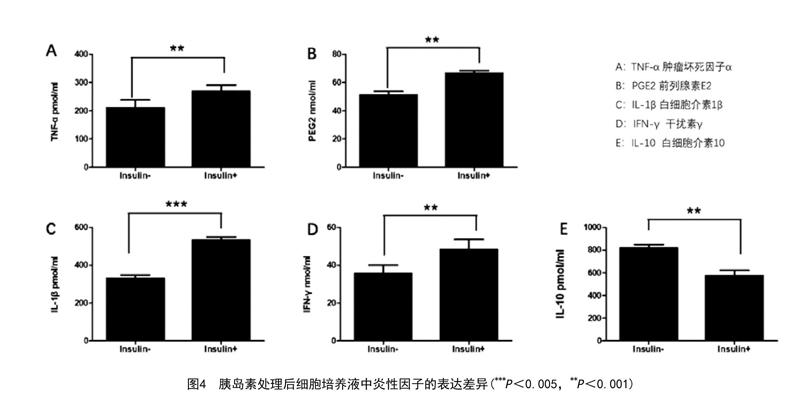
2.3 实时定量PCR检测原代细胞炎性因子mRNA的表达:MTT实验结果表明低浓度胰岛素干扰时(25nmol/L),细胞增殖速度较对照组明显降低,而高浓度胰岛素时(50nmol/L、100nmol/L),细胞增殖受到明显抑制,为了避免多重因素对实验结果的干扰和影响,对炎性因子表达的研究选取低浓度胰岛素(25nmol/L)刺激条件。与对照组相较,细胞培养液中炎性因子IL-1β、PGE2、TNF-α、IFN-γ在胰岛素刺激下表达量均有不同程度的升高(P<0.05),与实时定量结果相符。而IL-10在细胞培养液中的表达略有下降。实时定量PCR检测结果见图3。
2.4 ELISA检测细胞培养液中炎性因子的表达:低浓度胰岛素(25nmol/L)实验组与对照组相较,细胞培养液中炎性因子IL-1β、PGE2、TNF-α、IFN-γ在胰岛素刺激下表达量均有不同程度升高(P<0.005),与实时定量结果相符。而IL-10在细胞培养液中的表达略有下降(P<0.001)。见图4。
3 讨论
慢性牙周炎(chronic periodontitis,CP)是临床上最为常见的牙周组织慢性炎症性疾病,与牙周炎相关的炎性细胞因子多达数十种[5-8]。牙周膜细胞是牙周组织的重要组成部分,其生理活动在牙周健康维持方面有不可替代的作用和生物学意义[9]。有研究发现,IL-1β、PGE2均与牙周病免疫破坏密切相关,如参与刺激骨吸收,诱导蛋白酶产生,抑制胶原、非胶原的合成[10-11]。也有证据表明牙周炎模型大鼠的IL-1β、PGE2水平均明显高于健康大鼠,在牙周炎的发展过程中,其浓度随着牙周炎症程度的加重而相应增高[12],IL-1β、PGE2在一定程度上又可以促进炎症发展。国内学者研究结果显示IL-10的水平与牙周炎呈负相关,提示IL-10在牙周炎症组织中可能是一种抗炎因子[13]。此外Carey、Yeganegi等人的研究也证实IL-10浓度升高可抑制免疫活性细胞表达及分泌炎症细胞因子,从而抑制炎症反应[14-15]。
炎症是糖尿病和牙周炎的共同病理基础[16],糖尿病患者体内的胰岛素水平紊乱,在一定程度上加重了患者患牙周炎/慢性牙周炎的风险[17],与此同时,牙周组织细胞炎性因子的表达,使二型糖尿病患者的血糖水平得不到有效的控制[18]。在体内,牙周组织周围炎性因子的来源一部分是牙周感染过程中产生的,随牙周破损溃烂进入到体内循环,进一步引起全身性的炎症反应和免疫应答,在一定程度上能够促使糖尿病患者产生胰岛素抵抗症状[19]。文献研究同时证实牙周感染可反作用于血糖控制,导致牙周病和糖尿病两者之间出现恶性循环[20]。但胰岛素浓度水平的高低对牙周细胞本身是否存在影响尚未见报道。结合上述已有的文献研究,本文将研究目标锁定在体外胰岛素水平对牙周膜细胞生理活动的影响,主要以牙周膜细胞及其炎性因子表达水平为表征手段,观察在正常培养条件下,不同浓度胰岛素对牙周膜细胞增殖和炎性因子表达水平的影响。相较于体内复杂环境,体外环境对细胞的影响是相对独立和有针对性的,在实验设计上尽可能少的引入能够对实验结果产生影响的因素,因此,笔者的实验结果仅在一定胰岛素浓度范围内观察了牙周膜细胞生理活动的影响,在实验限定条件下反映胰岛素与牙周膜细胞之间的单向作用關系。
与对照组相比,在0~100nmol/L浓度范围内,随着胰岛素浓度的增高,胰岛素对细胞增殖的抑制作用越明显;MTT实验结果表明低浓度胰岛素干扰时(25nmol/L),细胞增殖速度较对照组明显降低,而高浓度胰岛素时(50nmol/L、100nmol/L),细胞增殖受到明显抑制,为了避免多重因素对实验结果的干扰和影响,对炎性因子表达的研究选取低浓度胰岛素(25nmol/L)刺激条件。在mRNA水平和蛋白水平,胰岛素处理的实验组牙周膜细胞,其炎性因子IL-1β、PGE2、TNF-α、IFN-γ表达量均明显增高,对抗炎细胞因子IL-10的表达无显著影响,与对照组相比在mRNA水平无明显差异,在蛋白水平略有下降。因此,笔者得出以下结论:胰岛素浓度小于100nmol/L时,胰岛素浓度的增高会抑制大鼠牙周膜细胞的增殖,低浓度胰岛素(25nmol/L)对牙周膜细胞的促炎性因子表达有促进作用。
[参考文献]
[1]Sugimori T,Yamaguchi M,Shimizu M,et al.Micro-osteoperforations accelerate orthodontic tooth movement by stimulating periodontal ligament cell cycles[J].Am J Orthod Dentofacial Orthop,2018,154(6):788-796.
[2]Brett PM,Zygogianni P,Griffiths GS,et al.Functional gene polymorphisms in aggressive and chronic periodontitis[J].J Dent Res,2005,84(12):1149-1153.
[3]Farag A,Vaquette C,Theodoropoulos C,et al.Decellularized periodontal ligament cell sheets with recellularization potential[J].J Dent Res,2014,93(12):1313-1319.
[4]Kobayashi E,Fujioka-Kobayashi M,Sculean A,et al.Effects of platelet rich plasma (PRP) on human gingival fibroblast,osteoblast and periodontal ligament cell behaviour[J].BMC Oral Health,2017,17(1):91.
[5]Jing L,Kim S,Sun L,et al.IL-37-and IL-35/IL-37-producing plasma cells in chronic periodontitis[J].J Dent Res,2019,1337618963.
[6]Taxman DJ,Lei Y,Zhang S,et al.ASC-dependent RIP2 kinase regulates reduced PGE2 production in chronic periodontitis[J].J Dent Res,2012,91(9):877-882.
[7]姜阳,何权敏,刘清蒙.外周血TNF-α、IL-6、IL-10和HMGB-1与慢性牙周炎伴口臭的相关性研究[J].牙体牙髓牙周病学杂志,2017,27(5):261-265.
[8]Hammouda O,Seif MSr,Brinkley B,et al.Gingival matrix collagen in chronic periodontitis[J].J Dent Res,1980,59(1):17-22.
[9]Tian BM,Wu RX,Bi CS,et al.Human platelet lysate supports the formation of robust human periodontal ligament cell sheets[J].J Tissue Eng Regen Med,2018,12(4):961-972.
[10]Rhodin K,Divaris K,North KE,et al.Chronic periodontitis genome-wide association studies:gene-centric and gene set enrichment analyses[J].J Dent Res,2014,93(9):882-890.
[11]Chai L,Song YQ,Zee KY,et al.SNPs of Fc-gamma receptor genes and chronic periodontitis[J].J Dent Res,2010,89(7):705-710.
[12]Sanchez GA,Miozza VA,Delgado A,et al.Salivary IL-1beta and PGE2 as biomarkers of periodontal status,before and after periodontal treatment[J].J Clin Periodontol,2013,40(12):1112-1117.
[13]王鳳,王祥柱,谢晓莉.2型糖尿病对牙周炎患者龈沟液中IL-1β、IFN-γ、IL-10、PGE2含量的影响[J].牙体牙髓牙周病学杂志,2017,27(5):271-275.
[14]Carey AJ,Tan CK,Ulett GC.Infection-induced IL-10 and JAK-STAT:A review of the molecular circuitry controlling immune hyperactivity in response to pathogenic microbes[J].JAKSTAT,2012,1(3):159-167.
[15]Yeganegi M,Leung CG,Martins A,et al.Lactobacillus rhamnosus GR-1-induced IL-10 production in human placental trophoblast cells involves activation of JAK/STAT and MAPK pathways[J].Reprod Sci,2010,17(11):1043-1051.
[16]吴莹莹.胰岛素对高糖环境下人牙周膜细胞促炎因子和OPG/RANKL表达的影响及PI3K-Akt通路作用的研究[D].北京:军医进修学院,2011.
[17]Akazawa H.Periodontitis and diabetes mellitus: be true to your teeth[J].Int Heart J,2018,59(4):680-682.
[18]王丹.慢性牙周炎对OLETF大鼠肾脏病变的影响及其机制的探讨[D].广州:南方医科大学,2013.
[19]Jeong S,Park Y,Cho Y,et al.Diagnostic utilities of procalcitonin and C-reactive protein for the prediction of bacteremia determined by blood culture[J].Clin Chim Acta,2012,413(21-22):1731-1736.
[20]Lazar MA.How obesity causes diabetes:not a tall tale[J].Science,2005,307(5708):373-375.
[收稿日期]2019-07-12
本文引用格式:王方,郝欢萌,逯宜.胰岛素对大鼠牙周膜细胞增殖及其炎性因子表达的影响[J].中国美容医学,2019,28(10):92-95.
