小儿急性髓系白血病M2a成熟粒细胞浆中出现柴捆状奥氏小体1例报告
2019-10-16周百灵雷庆龄杜廷义夏世梅世淑兰奎莉越
周百灵,雷庆龄,杜廷义,夏世梅,世淑兰,胥 冀,奎莉越△
(昆明市儿童医院:1.检验科;2.血液肿瘤科,云南昆明 657900)
Auer小体又称奥氏小体,其出现在形态学上标志着该细胞是起源于白血病细胞克隆[1],在急性髓系白血病(AML)中具有高度特异性,是AML一个具有诊断意义的形态学特征[2]。奥氏小体常见于原始阶段细胞中,在成熟阶段出现奥氏小体是比较少见的。柴捆细胞的出现往往提示急性早幼粒细胞白血病(APL)[3],而在AML(非APL)中发现成熟粒细胞浆中出现柴捆状奥氏小体的病例十分少见,现结合相关文献复习以提高对其的认识。
1 病例资料
患儿,男性,13岁,因反复发热伴进行性面色苍白,乏力20余天。于2016年5月17日在外院行血常规示白细胞计数72.09×109/L,血红蛋白89 g/L。为进一步诊治于2016年5月19日入本院,入院时面色苍白,颈部淋巴结肿大,肝脾无肿大。血常规:白细胞计数为24.5×109/L,血红蛋白75 g/L,血小板计数为31×109/L,原始细胞比率为40%。骨髓涂片示骨髓有核细胞增生明显活跃,分类原始粒细胞占76%,此类细胞呈圆形或椭圆形,胞浆量中等呈淡蓝色,少部分浆中可见一条奥氏小体,核圆形,易见凹陷,核染色质粗颗粒状,核仁1~4个(图1A)。组化染色POX部分阳性。综合考虑为AML-M2a。骨髓细胞免疫分型结果提示为急性髓系白血病(AML,非M3)免疫表型,主要表达CD34+,CD117+,CD33+,未见明显的单核/红系/巨核系列分化标记物表达。白血病中30个融合基因筛查均为阴性,其中PML-RARa融合基因也为阴性。基因突变检测中检测到FLT3-ITD突变。染色体核型分析:46,XY,del(16)(q12),见图2。患儿明确诊断后,按照CCCG-AML-2015方案进行化疗,诱导化疗药物为阿糖胞苷、依托泊苷及柔红霉素,对患者化疗后第21天及第29天行骨髓细胞学检查及MRD进行疗效评估。两个时间段均检出较高比例的原始粒细胞,同时在中性晚幼粒及杆状核粒细胞浆中可见较多Auer小体,甚至部分为柴捆状(图1B、C)。第21天流式检测结果表明CD34+肿瘤细胞占有核细胞总数约22.1%,其免疫表型为CD34+、CD117+、CD33-、HLA-DR+部分。回顾分析时发现患儿初诊骨髓片中其成熟中性粒细胞浆中偶见柴捆状奥氏小体(图1A)。此时患儿一般情况较差,家属要求放弃治疗出院,后电话回访患儿已死亡。

注:A为AML-M2a患儿初诊成熟粒细胞浆中出现多量奥氏小体细胞形态学特征;B为患儿化疗第21天骨髓细胞形态学;C为化疗第28天骨髓细胞形态学
图1患者诊疗过程中的骨髓细胞学(瑞士吉姆萨×100)
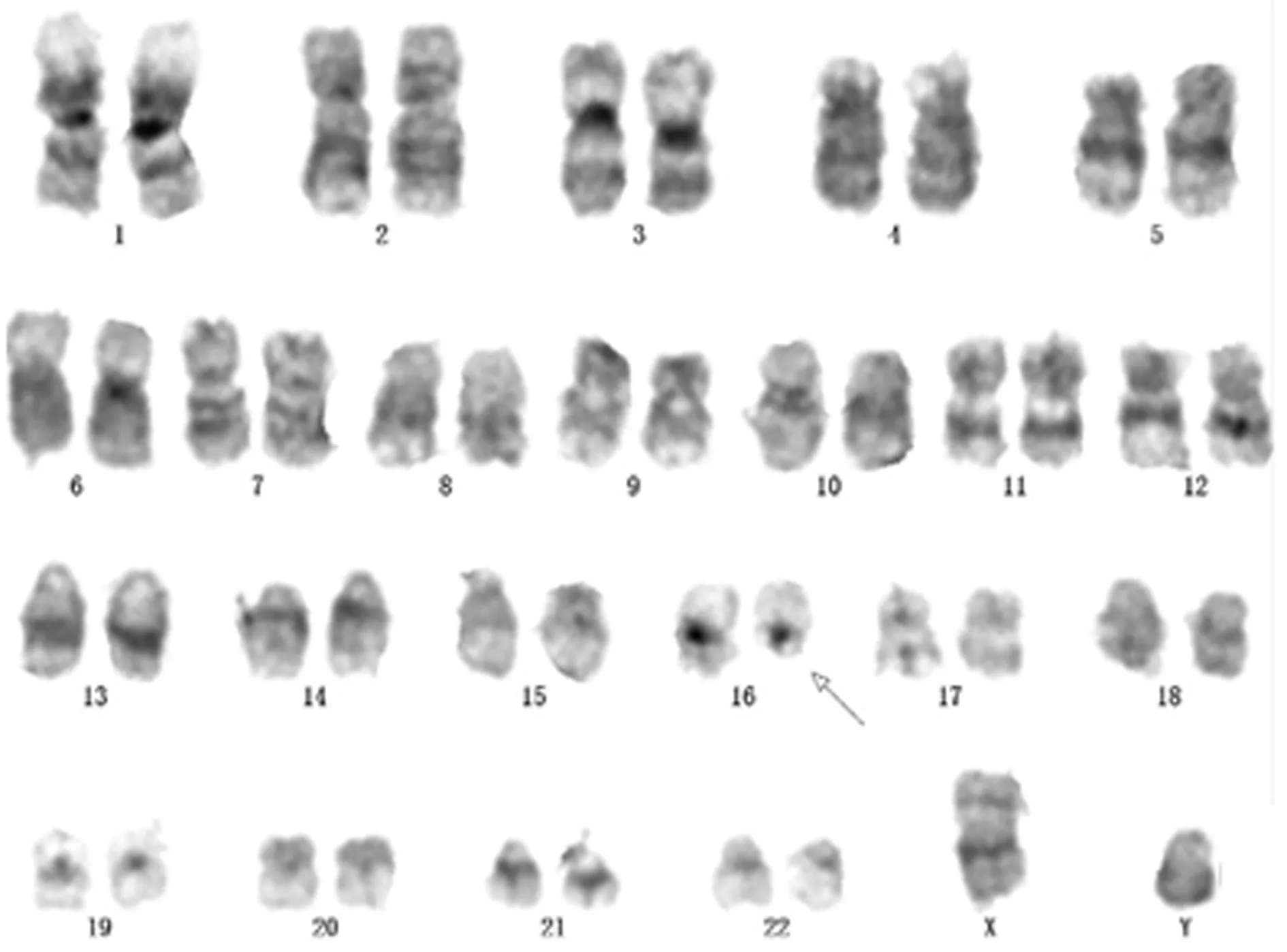
注:箭头示16号染色体
图2患者染色体核型
2 讨 论
1906年John Auer首次对Auer小体进行报道,后研究发现,其电镜显示Auer小体与细胞内的嗜天青颗粒结构电子密度相似,呈条纹状结构,有规律排列;其过氧化物酶染色,苏丹黑染色,糖原染色、酸性磷酸酶染色剂碱性磷酸酶染色均为阳性,而脂肪酶和核酸染色为阴性,推测Auer小体是由胞浆内嗜天青颗粒融合而成。其形态长1.0~6.0 μm,形状多为棒状,其次为柴捆状、弧形、针尖状、圆形、卵圆形等不同形态。柴捆状Auer小体多见于APL,而其他髓系白血病细胞中大多仅见1~2条Auer小体。该患儿初诊时的骨髓象中白血病细胞浆中可见1条Auer小体,回顾分析再次审阅初诊骨髓片时发现在成熟中性粒细胞浆中偶见呈柴捆状的奥氏小体,患儿进行诱导化疗第21天及第28天后,骨髓检查中很容易观察到中性晚幼粒及杆状核粒细胞浆中含有较多Auer小体,甚至部分为柴捆状。同时三个时期流式结果均证实此白血病细胞非APL,融合基因也显示未有PML-RARa的表达。在AML(非M3型)患者中成熟中性粒细胞胞浆中存在柴捆状的奥氏小体,是很少见的[4]。 DAWSON等[5]报道1例AML(非M3型)成人患者初诊骨髓片中成熟中性粒细胞易见多量奥氏小体,但此患者染色体核型正常,化疗后缓解,该患者融合基因及基因突变等检查未提及;GUÉRIN等[6]报道1例在AML(非M3型)中原始细胞及成熟中性粒细胞浆中见到柴捆状奥氏小体,其患者染色体核型分析为46,XY,der(6)t(6;11)(p21;q13),der(8)t(8;6)(q24;p21),der(9)del(9)(p12)del(9)(q12),der(11)t(6;11)(p21;q13)t(11;17)(p13;p11),der(17)t(11;17) (p13;p11),同时FISH检测到MYC基因的高表达,该患者在诱导治疗后死亡;国内杨立东等[7]报道1例AML-M2复发患者中在其较成熟阶段浆中发现较多量的Auer小体,患者在治疗中死亡,该患者的融合基因、染色体检查及基因突变等检查未提及。而APL患者经ATRA(全反式维甲酸)诱导治疗后,其成熟阶段中性粒细胞浆中可见柴捆状奥氏小体,类似的病例报道较多[8-9]。成熟粒细胞中出现Auer小体的意义在于证明了一部份白血病患者的某些白血病原始细胞可以在人体内自发分化或在某些诱导分化剂(治疗APL使用的三氧化二砷、维甲酸等诱导分化药物)的作用下分化为成熟细胞[10]。而本例病例中,该患儿出现的Auer小体,考虑可能为白血病原始细胞在人体内自发向下成熟分化,但成熟后其奥氏小体的数量却大大增多,不过也不排除是否成熟中性粒细胞浆中的嗜天青颗粒在病理情况下也能融合形成奥氏小体。
fms样酪氨酸激酶3(FLT3)作为一个刺激造血干/祖细胞增殖、分化的生长因子受体,在正常骨髓CD34+造血干/祖细胞中表达,在其他细胞一般不表达。早在其基因发现之初FLT3就被认为是一个潜在的引发白血病的原癌基因。FLT3基因突变已被公认是AML中发生率最高的一种基因改变,最常见的突变有ITD和TKD两种形式[11]。FLT3-ITD突变可导致造血细胞的增殖、分化及凋亡异常,从而引起白血病的发生。在疾病特征方面,伴FLT3/ITD突变的儿童AML患者初诊时白细胞计数及骨髓原始细胞比例更高。在预后方面,国内外多项研究已证实FLT3/ITD突变是AML一个重要的独立预后不良指标[12-13]。该患儿基因突变检测中检测到FLT3基因ITD突变,其初诊时白细胞总数较高为72.09×109/L,骨髓原始细胞比例也较高,为76%。在初期的诱导治疗中一直不缓解,可能与FIT3-ITD突变提示其预后不良有关,而在未化疗前骨髓中出现的成熟中性粒细胞浆中可见较多Auer小体,是否与此基因突变有关,尚未有资料提及。 患儿染色体核型分析为46,XY,del(16)(q12),属于非特异的改变,此核型改变是否与此现象相关,也未查到相关资料报道。
在过去很多研究报道,奥氏小体在AML中出现提示预后良好,但近来也有研究提示奥氏小体与AML患者总生存率没有明显差异[14],但在MDS与CMML中出现奥氏小体却是向急性白血病转化的潜在风险标志[15-17]。本例AML(非M3型)白血病患儿初诊骨髓中发现成熟中性粒细胞浆中含有柴捆状奥氏小体,证实柴捆状奥氏小体对APL并不特异,而此种形态是否与FLT3-ITD突变或是染色体核型改变有关,甚至该形态在用药上是否有帮助,少有的资料仍无法判断,需要在今后工作中继续研究。
