鼎湖山国家自然保护区林下土壤微生物新结构生物活性代谢产物的研究进展
2019-10-16李翰祥魏孝义
李翰祥, 魏孝义
鼎湖山国家自然保护区林下土壤微生物新结构生物活性代谢产物的研究进展
李翰祥, 魏孝义*
(中国科学院华南植物园, 广州 510650)
鼎湖山国家自然保护区特殊的地理位置和气候条件造就了独特的生态环境,孕育了丰富的植物和微生物资源。为了挖掘其中的微生物资源,对近年来鼎湖山林下土壤来源的真菌和放线菌次生代谢物研究进行了综述。
鼎湖山;微生物;真菌;放线菌;次生代谢产物;活性物质
微生物作为自然界中多样性最高的生命形式,能够合成数量巨大、结构复杂的次生代谢物。就药物发现途径而言,从微生物代谢产生的新结构物质中寻找新药先导化合物已经成为世界药学界公认的有效方法[1–2]。当前的微生物源药物创制中,特殊生境来源的微生物是研究的热点和重点,这些特殊生境包括海洋、极地、高山、热带雨林、荒漠等。细菌和真菌在与特殊的生态环境相互作用中,形成了独特的适应能力和代谢防御机制。但是受到样品采集等技术的限制,长期以来缺乏对特殊生境中的微生物资源的认识和研究。收集和发掘这些新的菌种资源,保护和研究特境微生物新的基因资源,将是天然药物创制的重要途径。
鼎湖山国家级自然保护区(以下简称鼎湖山)位于广东中西部,是我国第一个国家自然保护区,也是我国第一批加入联合国科教文组织“人与生物圈”计划的世界生物圈保护区。鼎湖山地处北回归线上,属于南亚热带季风湿润型气候,冬夏气候交替明显,分布着南亚热带森林生态系统,是我国生物多样性最丰富的地区之一。最为典型的是其中包括有400年保护历史的南亚热带季风常绿阔叶林,其林下土壤腐殖质中有机碳、氮,以及微量元素含量丰富,为微生物的生长提供了优良的生境和条件,林下土壤微生物资源具有丰富的生物多样性。
近年来本研究组针对鼎湖山林下土壤丰富的微生物资源,对其进行了系统的分离、纯化工作,重点对收集得到的菌株的次生代谢物进行研究,旨在从中发现新结构活性物质,为药物先导化合物的发现提供物质基础。目前从林下土壤中分离、收集了近1 200株菌株,通过活性筛选从中发现了一些对真菌和细菌有显著活性的菌株,对其中活性菌株的代谢产物进行了研究,共分离、鉴定了309个化合物,其中135个为新化合物,包括31个新骨架结构化合物。现将近年取得的研究进展综述如下。
1 产紫青霉中新碳架甾醇及其抗炎、细胞毒活性
甾醇作为生物学中重要的小分子,是真核生物细胞膜的组成成分,具有多种与细胞膜结构和信号功能相关的细胞功能。甾醇类药物在医药市场占据重要领域,对提高生活质量、预防和治疗疾病具有重要意义。因此,甾醇及其衍生物不断引起化学家和生物学家的关注。对鼎湖山林下土壤真菌产紫青霉() SC0070的固体发酵产物进行研究,分离得到1个具有稀有四环碳架重排的甾醇penicillitone (1)和1个新的类似物penici- llisterol (2) (图1)[3]。对1可能的生源途径分析表明,该化合物可能以麦角甾醇为前体,通过脱氢氧化形成四烯酮1b,并进一步氧化裂解C-14和C-15间的双键得到中间体1c,在此基础上通过-烯醇化以及分子内的烯醇羟醛缩合得到化合物1。上述途径的关键步骤在于C-14和C-15位间的氧化裂解,该步反应不仅产生了亲电基团C-15位的醛基,同时还在C-8的位(C-14)形成了,-不饱和酮羰基。后者的形成增强了-氢(H2-11)的酸性,进而促进了-烯醇化和提高了羟醛缩合的反应活性。这类生源合成机制在目前甾醇生物合成或化学转化中尚未见报道,其中的可能中间体1c,结构中含邻位具有酮基的,-不饱和酮羰基片段,将为设计构建新的烯醇羟醛缩合反应基元提供启示。
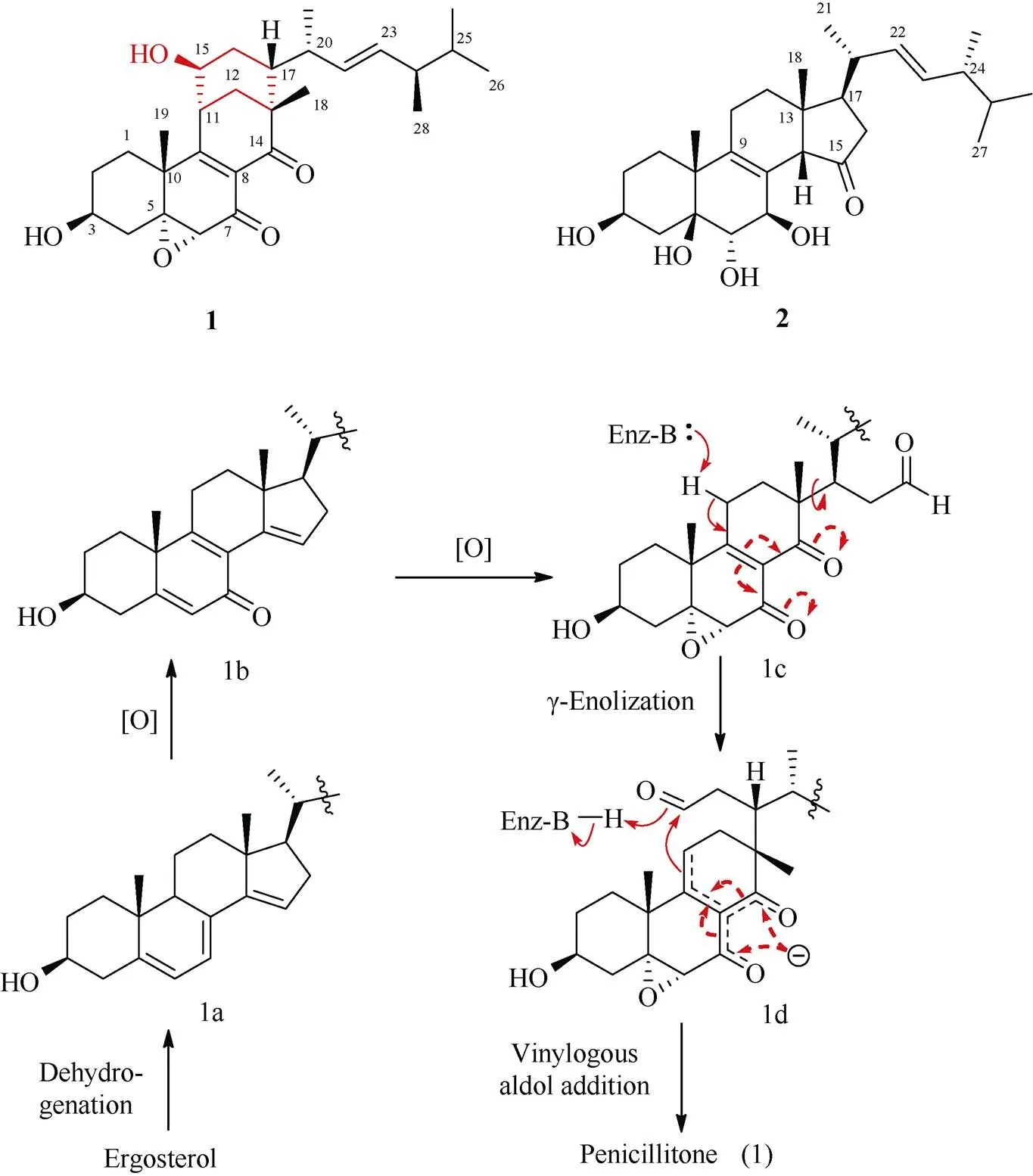
图1 化合物1和2的结构及1可能的生源途径
活性测试表明,化合物1对肿瘤细胞株A549、HepG2和MCF-7具有强的生长抑制活性,IC50分别为(5.57±0.19)、(4.44±0.24)和(5.98±0.22)mol L–1,但是类似物2对上述细胞株不显示活性。同时,化合物1能够剂量依赖性地降低脂多糖诱导RAW264.7巨噬细胞的炎症反应,抑制肿瘤坏死因子-(TNF-)和白介素-1(IL-6)的生成。这表明化合物1作为新的分子骨架,在抗炎和抗肿瘤先导物的设计合成中具有研究前景。
2 枝顶孢霉来源的新结构枝顶孢素及抗菌肽
枝顶孢属真菌(sp.)属于子囊菌亚门,世界上约有130种,分布广泛,形态学特征是分生孢子的孢子链或顶端有单细胞(极少数为双细胞)的瓶梗孢子。鼎湖山林下土壤分离的真菌菌株SC0105,经形态学和分子生物学鉴定为。该菌株的发酵产物粗提物对金黄色葡萄球菌显示抑菌活性。对发酵产物的化学成分研究表明,SC0105代谢合成了一系列骨架新颖的混源萜类枝顶孢素(acremins)二聚体bisacremines A~G (3~9)及单体衍生物(10) (图2)[4–5]。化合物7~9中含有的多环碳架结构生源上可能基于[4+2]环加成反应。化合物bisacremine E能够抑制脂多糖诱导RAW264.7巨噬细胞中肿瘤坏死因子-(TNF-)和白介素-1(IL-6)的生成。非对映异构体3~6在对肿瘤细胞株HeLa细胞毒活性测试显示,含有THF环的bisacremine A和B (3和4)活性强于含有THF环的bisacre- mine C和D (5和6),构效关系显示构型依赖性。

图2 化合物bisacremines A~G (3~10)的结构及7~9可能的生源途径
该菌株的另外一组特征性次生代谢物是抗菌肽(peptaibiotics)。抗菌肽是一类能够通过细胞膜脂质双分子层,建立电压依赖性离子通道的小分子多肽,具有抗菌、抗病毒、抗真菌和细胞毒性等多种生物学特性。该类化合物以其独特的结构、优越的生物活性和特异的作用方式,引起了科学界和制药业的广泛关注。从该株菌的固体发酵物中分离获得了一组新的抗菌肽acremotinsA~D (11~14) (图3)[6], 其结构中含有特征性的3个,-二烷基氨基酸-亚氨酸结构基元和一个未被还原的C-末端残基。通过改良的Marfey法确定了acremotins A~D (11~14)中氨基酸残基的绝对构型。此外,采用密度泛函理论(DFT)和从头算方法(initio)对acremotin D (14)进行了理论构象分析,并确定了该化合物的三维空间结构(图4)。Acremotin D (14)显著抑制金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌(methicillin-resistant, MRSA),MIC分别为12.5和6.25g mL–1。细胞毒活性测试还表明,acremotin D (14)具有强的细胞毒活性,对HepG2细胞株的IC50值为1.2mol L–1。
3 拟青霉属真菌来源的β-雷琐酸大环内酯及其生物活性
-雷琐酸大环内酯(-resorcylic acid lactones, RALs)是一类结构独特的真菌聚酮类代谢产物,结构母核中含有-雷琐酸(2,4-二羟基-苯甲酸)并合的14元内酯环。生源上,-雷琐酸大环内酯结构母核的形成基于芳香环C-6上的烷基侧链中的C-10ʹ与C-1位的羧基酯化反应,同时,烷基链上的不同修饰取代赋予了该类化合物的结构多样性。对鼎湖山林下土壤真菌代谢产物进行活性筛选表明,拟青霉属真菌(sp.) SC0924对荔枝霜疫霉()显示抗真菌活性。对该菌株次生代谢物进行研究,从中获得了一系列新结构-雷琐酸大环内酯[7–11]:paecilomycins A~P (15~30)、dechlo- ropochonin I (31)、monocillin VI (32)、monocillin VII (33)、4′-hydroxymonocillin IV (34)和4′-methoxy- monocillin IV (35)。上述结构基于C-10′的绝对构型,可分为hypothemycin型(10′)和radicicol型(10′)两类。就化学结构而言,化合物28和29含有新颖的6/11/5环系结构。化合物19对疟原虫() 3D7具有显著抑制活性(IC50=20.0 nm),化合物32和34能够抑制荔枝霜疫霉,化合物28、32和33对肿瘤细胞株MCF-7、A549和HeLa具有显著细胞毒活性。

图3 抗菌肽acremotins A~D (11~14)的结构

图4 抗菌肽acremotin D (14)立体结构图。A: 理论计算3D结构图和静电势表面图; B: 理论计算3D肽链骨架(蓝色)与类似物[Leu1]zervamicin单晶(黄色)叠合图。
4 漆斑属真菌来源的醌基倍半萜及其细胞毒、抗菌活性
醌基倍半萜(quinone sesquiterpenes)作为重要的混源杂萜,结构中含有醌基取代的drimane倍半萜基团。醌基倍半萜结构多样并具有突出的生物活性,如抗艾滋病毒、抗结核、蛋白激酶抑制和免疫抑制活性。从鼎湖山林下土壤来源的漆斑属真菌(sp.) SC0265的小麦固体发酵产物中, 分离得到一组新的醌基倍半萜myrothecols A~F (36~41)和已知类似物hymenopsin B (42) (图6), 通过构象分析和ECD量子化学计算确定了该组化合物的绝对构型[12]。化合物36对金黄色葡萄球菌(MIC=12.5g mL–1)和蜡状芽孢杆菌() (MIC=25.0g mL–1)具有抗菌活性。细胞毒活性实验中,化合物42的细胞毒活性最强,对3株肿瘤细胞MCF-7、A549和HeLa的IC50值为1.3~ 4.5mol L–1。
5 白粉寄生菌来源的新型碳环糖
碳环糖(carbasugar)是一类呋喃或吡喃糖环中的氧原子被亚甲基取代后形成的糖类似物。作为糖类化合物的类似物,碳环糖却有着不同的活性和稳定性,引起了有机合成化学和药理学研究领域的广泛关注。白粉寄生菌(sp.) SC0307于2002年分离自鼎湖山林下土壤,从其固体发酵提取物中,分离得到一组多羟基取代的甲基环己醇ampelomins A~G (43~49,图7)[10]。其中化合物43、45、47和49对-葡萄糖苷酶具有弱的抑制活性,化合物43对菌株金黄色葡萄球菌、大肠杆菌、变形杆菌和铜绿假单胞菌显示中等抑菌作用。
6 高等真菌代谢产生的萜类物质及其生物活性
高等真菌,也称大型真菌,通常指能产生子实体的一类真菌,包括担子纲真菌和部分子囊纲真菌,因其代谢产物的结构新颖性和药理活性的显著性, 在真菌活性物质研究中占据重要地位。从鼎湖山采集的担子菌杀线虫活性筛选中发现,污叉丝孔菌() SC0197具有杀线虫活性,从该菌株固体发酵物中鉴定了一组新型倍半萜类化合物(图8)[13–14]。化合物56对松材线虫()的LC50为35.6g mL–1。其中化合物52具有1,10-裂-2,3-裂-香橙烷结构,该类骨架为首次报道。研究另一株有毒担子菌——鬼伞目(Coprinaceae)花褶伞属真菌() SC0641的活性成分[15],从中得到了2个新的伊鲁烷(illudane)倍半萜paneolic acid (57)和paneolilludinic acid (58) (图8), 这两个倍半萜对金黄色葡萄球菌有抑制活性。

图5 β-雷琐酸大环内酯15~35的结构

图6 醌基倍半萜myrothecols A~F (36~41)和hymenopsin B(42)的结构
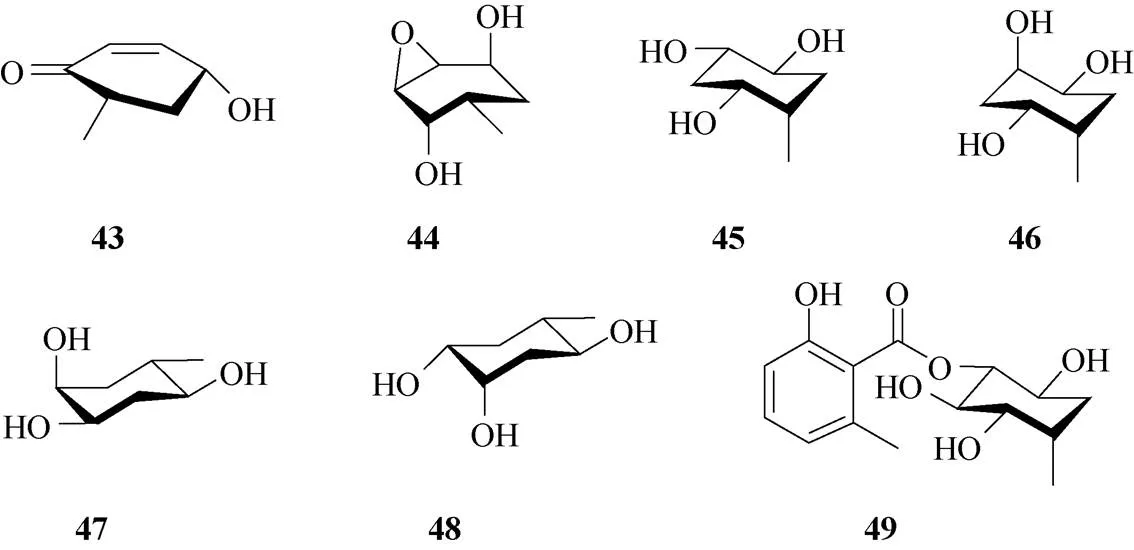
图7 碳环糖ampelomins A~G (43~49)的结构

图8 高等真菌来源的倍半萜50~58的结构
7 放线菌来源的环酯肽素dinghupeptins A~D及抗菌成分
在对鼎湖山林下土壤微生物次生代谢物研究中,除了对真菌的新结构活性物质进行研究外, 还关注了放线菌代谢产生的活性物质。从其中1株链霉菌(sp.) SC0581的代谢产物中,获得了4个具有显著糜蛋白酶选择性抑制活性的环酯肽类化合物——鼎湖山肽素A~D (dinghupeptins A~D, 59~62) (图9),首次运用量子化学计算从头算方法确定了该类化合物的绝对构型,并通过酶动力学试验和分子对接探讨了这些活性分子的作用机制和结合位点(图10, 11)[16]。化合物59~62分子中具有特征性的Ahp环结构,该类环酯肽家族庞大,大部分存在于蓝藻中,并多具有丝氨酸蛋白酶抑制等活性,是丝氨酸蛋白酶生物功能研究的潜力天然分子探针,受到药物化学、天然产物化学和有机合成化学等研究领域的广泛关注。本研究从放线菌中发现的该系列新结构成分,以及该组化合物绝对构型的确定和酶抑制机理的探讨,对环酯肽化学生物学功能及其相关研究具有重要意义。

图9 鼎湖山肽素A~D(59~62)及化合物63和64的结构

图10 鼎湖山肽素A (59)理论计算最低能量构象及ROESY相关图

图11 鼎湖山肽素与α-糜蛋白酶分子对接图
另一株放线菌师岗链轮丝菌() SC1169发酵提取物对热带水果重要病原菌荔枝霜疫霉具有抑制活性,从中分离鉴定了2个新的生物碱(图9)[17],包括咔唑类生物碱链轮丝菌素(streptoverticilin,63)和结构中含有2-氮杂环丁酮(2-azetidinone)的链轮丝菌酮(streptoverticilinone, 64)。其中63对荔枝霜疫霉的抑菌作用与农业用杀菌剂多菌灵(carbendazim)的活性相当。
8 结语
综上所述,鼎湖山特殊的地理位置和独特的水热条件孕育了珍稀的生物资源,其林下土壤微生物具有丰富的生物多样性,对这些真菌和放线菌次生代谢物进行研究,从中获得了一系列结构新颖、活性显著的化合物,为新型药物先导化合物的发现提供了物质基础。同时,鼎湖山林下微生物在遗传背景和次生代谢机制上具有独特性,是发现新结构活性物质的宝贵资源,这也为鼎湖山生物资源的系统研究和可持续利用提供了借鉴和启示。
[1] BROWN E D, WRIGHT G D. Antibacterial drug discovery in the resistance era [J]. Nature, 2016, 529(7586): 336–343. doi: 10.1038/ nature17042.
[2] CROFTS T S, GASPARRINI A J, DANTAS G. Next-generation approaches to understand and combat the antibiotic resistome [J]. Nat Rev Microbiol, 2017, 15(7): 422–434. doi: 10.1038/nrmicro.2017.28.
[3] XUE J H, WU P, XU L X, et al. Penicillitone, a potentanti- inflammatory and cytotoxic rearranged sterol with an unusual tetra- cycle core produced by[J]. Org Lett, 2014, 16(5): 1518–1521. doi: 10.1021/ol500418f.
[4] WU P, YAO L, XU L X, et al. Bisacremines A–D, dimeric acremines produced by a soil-derivedstrain [J]. J Nat Prod, 2015, 78(9): 2161–2166. doi: 10.1021/np501037x.
[5] WU P, XUE J H, YAO L, et al. Bisacremines E–G, three polycyclic dimeric acremines produced bySC0105 [J]. Org Lett, 2015, 17(19): 4922–4925. doi: 10.1021/acs.orglett.5b02536.
[6] WANG C, WU P, YAO L, et al. Acremotins A–D, peptaibiotics produced by the soil-derived fungusSC0105 [J]. J Antibiot, 2018, 71(11): 927–938. doi: 10.1038/s41429-018-0086-3.
[7] XU L X, WU P, XUE J H, et al. Antifungal and cytotoxic-resorcylic acid lactones from aspecies [J]. J Nat Prod, 2017, 80(8): 2215–2223. doi: 10.1021/acs.jnatprod.7b00066.
[8] XU L X, XUE J H, WU P, et al. Antifungal activity of hypothemycin againstand[J]. J Agric Food Chem, 2013, 61(42): 10091–10095. doi: 10.1021/jf4030882.
[9] XU L X, HE Z X, XUE J H, et al.-Resorcylic acid lactones from afungus [J]. J Nat Prod, 2010, 73(5): 885–889. doi: 10. 1021/np900853n.
[10] ZHANG H Y, XUE J H, WU P, et al. Polyoxygenated methyl cyclo- hexanoids from a terrestrialfungus [J]. J Nat Prod, 2009, 72(2): 265–269. doi: 10.1021/np800667e.
[11] XU L X, XUE J H, ZOU Y, et al. Three new-resorcylic acid lactones fromsp. SC0924 [J]. Chin J Chem, 2012, 30(6): 1273– 1277. doi: 10.1002/cjoc.201200406.
[12] FU Y, WU P, XUE J H, et al. Cytotoxic and antibacterial quinone sesquiterpenes from afungus [J]. J Nat Prod, 2014, 77(8): 1791–1799. doi: 10.1021/np500142g.
[13] HUANG Z L, DAN Y, HUANG Y C, et al. Sesquiterpenes from the mycelial cultures of[J]. J Nat Prod, 2004, 67(12): 2121–2123. doi: 10.1021/np0497144.
[14] XIE H H, XU X Y, DAN Y, et al. Novel sesquiterpenes from the mycelial cultures of[J]. Helv Chim Acta, 2011, 94(5): 868–874. doi: 10.1002/hlca.201000328.
[15] MA W Z, HUANG Y C, LIN L D, et al. Two new biologically active illudane sesquiterpenes from the mycelial cultures of[J]. J Antibiot, 2004, 57(11): 721–725. doi: 10.7164/antibio tics.57.721.
[16] YANG L, LI H X, WU P, et al. Dinghupeptins A–D, chymotrypsin inhibitory cyclodepsipeptides produced by a soil-derived[J]. J Nat Prod, 2018, 81(9): 1928–1936. doi: 10.1021/acs.jnatprod.7b01009.
[17] FENG N, YE W H, WU P, et al. Two new antifungal alkaloids produced by[J]. J Antibiot, 2007, 60(3): 179– 183. doi: 10.1038/ja.2007.19.
New Bioactive Metabolites of Microorganisms Derived from Forest Soil in Dinghu Mountain National Nature Reserve
LI Han-xiang, WEI Xiao-yi*
(South China Botanical Garden, Chinese Academy of Sciences,Guangzhou 510650, China)
The particular geographical location and climate conditions of Dinghu Mountain National Nature Reserve create a unique ecological system and breed diverse plants and microbials. In order to exploit microbial resources for discovery of bioactive substances, the bioactive secondary metabolites of the fungi and actinomycetes derived from forest soil in Dinghu Mountain National Nature Reserve has been focused. Some recent progresses of this work are summarized.
Dinghu Mountain; Microorganism; Fungus; Actinomycete; Secondary metabolite; Bioactive natural product
10.11926/jtsb.4103
2019–06–06
2019–07–17
国家自然科学基金项目(20672114, 81172942, 30901856, 21502197, 81872773)资助
This work was supported by the National Natural Foundation of China (Grant No. 20672114, 81172942, 30901856, 21502197, 81872773).
李翰祥(1981~ ),男,博士,助理研究员,研究方向为天然产物化学。E-mail: lihanxiang@scbg.ac.cn
E-mail: wxy@scbg.ac.cn
