红景天对间歇低氧致大鼠肺损伤的干预作用
2019-10-15吴茂兰曹慧焦婷
吴茂兰 曹慧 焦婷
[摘要] 目的 探討红景天对间歇低氧(IH)致大鼠肺损伤的干预作用。 方法 建立IH大鼠模型。将45只4周龄雄性SD大鼠按体重随机分为五组(每组9只):常氧对照组(A组)、IH组(B组)、IH+低剂量红景天组(C组)、IH+中剂量红景天组(D组)、IH+高剂量红景天组(E组)。实验45 d后,检测肺组织匀浆中一氧化氮(NO)、超氧化物歧化酶(SOD)、丙二醛(MDA)、肿瘤坏死因子-α(TNF-α)、促红细胞生成素(EPO)含量及P物质-1(SP-1)和低氧诱导因子-1α(HIF-1α)的mRNA表达水平,分析验证其相关性,显微镜下观察肺组织病理变化。 结果 与A组比较,B组NO和SOD含量降低,MDA含量升高(均P < 0.01);与B组比较,C组SOD含量升高(P < 0.01),D组、E组NO、SOD含量升高,MDA含量降低(P < 0.05或P < 0.01)。与A组比较,B组EPO含量及HIF-1α mRNA表达水平升高(均P < 0.01);与B组比较,C组、D组、E组EPO含量及HIF-1α mRNA表达水平降低(均P < 0.01)。与A组比较,B组TNF-α含量及SP-1 mRNA表达水平升高(均P < 0.01);与B组比较,C组TNF-α含量降低(P < 0.01),D组、E组TNF-α含量及SP-1 mRNA表达水平降低(均P < 0.01)。相关性分析显示:TNF-α含量、SP-1 mRNA水平与NO含量(r = -0.55、-0.57)、SOD(r = -0.84、-0.69)呈负相关,与MDA含量(r = 0.55、0.56)、EPO含量(r = 0.69、0.57)、HIF-1α mRNA水平(r = 0.86、0.75)呈正相关(均P < 0.01)。HE结果显示:IH组肺组织见炎性及缺氧性改变,红景天干预后改善。 结论 红景天对IH所致肺损伤有保护作用,可能是通过抗氧化应激、减轻低氧损害、抑制炎性反应途径实现的。
[关键词] 间歇低氧;红景天;氧化应激;炎性反应;肺损伤
[中图分类号] R-332 [文献标识码] A [文章编号] 1673-7210(2019)12(c)-0008-06
Effect of Rhodiolae Herba on pulmonary injury induced by intermittent hypoxia in rats
WU Maolan1 CAO Hui1 JIAO Ting1 LIU Weiying2
1.The First Clinical Medical College, Lanzhou University, Gansu Province, Lanzhou 730000, China; 2.Department of Respiratory Medicine, the First Hospital of Lanzhou University, Gansu Province, Lanzhou 730000, China
[Abstract] Objective To investigate the effects of Rhodiolae Herba on pulmonary injury induced by intermittent hypoxia (IH) in rats. Methods Rat model of IH was established. 45 male and Sprague-Dawley rats aged 4 weeks were randomly divided into 5 group according to weight (9 rats in each group): normoxia control group (group A), IH group (group B), IH with low-dose Rhodiolae Herba group (group C), IH with medium-dose Rhodiolae Herba group (group D), IH with high-dose Rhodiolae Herba group (group E). After 45 days, the contents of nitric oxide (NO), superoxide dismutase (SOD), malondialdehyde (MDA), erythropoietin (EPO), tumor necrosis factor-α (TNF-α) and the expression levels of hypoxia inducible factors-1α (HIF-1α) mRNA and substance P-1 (SP-1) mRNA in the lung homogenate of rats were detected. The pathological changes under microscope were observed, and the relationship between the indicators, oxidative stress and hypoxic reactions were analyzed. Results Compared with group A, the contents of NO and SOD in group B decreased and the content of MDA increased (P < 0.01); compared with group B, the content of SOD in group C increased (P < 0.01), the contents of NO and SOD in group D and group E increased, and the content of MDA decreased (P < 0.05 or P < 0.01). Compared with group A, EPO content and HIF-1α mRNA expression level in group B increased (all P < 0.01); compared with group B, EPO content and HIF-1α mRNA expression level in group C, group D and group E decreased (all P < 0.01). Compared with group A, TNF-α content and SP-1 mRNA expression level in group B increased (P < 0.01); compared with group B, the TNF-α content in group C decreased (P < 0.01), TNF-α content and SP-1 mRNA expression level in group D and group E decreased (P < 0.01). Correlation analysis showed that TNF-α content and SP-1 mRNA level were negatively correlated with NO content (r = -0.55, -0.57), SOD content (r = -0.84, -0.69). TNF-α content, SP-1 mRNA level were positively correlated with MDA content (r = 0.55, 0.56), EPO content (r = 0.69, 0.57), HIF-1α mRNA level (r = 0.86, 0.75) (all P < 0.01). HE results showed that the lung tissue of IH group showed inflammatory and anoxic changes, and the prognosis was improved after intervention. Conclusion Rhodiolae Herba has protective effect on lung injury induced by IH, which may be achieved by antioxidant stress, reducing hypoxia damage and inhibiting inflammatory response.
[Key words] Intermittent hypoxia; Rhodiolae Herba; Oxidative stress; Inflammatory response; Lung injury
阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是一种常见的睡眠呼吸疾病,易引起心血管、呼吸及内分泌等多系统损伤[1-3]。间歇低氧(IH)是OSAHS主要的致病因素,该缺氧/复氧循环类似缺血/再灌注损伤,可启动氧化应激,致使过氧化物增多、炎性因子水平上调,最终导致细胞损伤、组织结构改变及功能障碍,成为多器官损伤的病理生理基础[4-5]。但IH对肺损伤的影响鲜有报道,遂行进一步研究。红景天是景天科、红景天属、多年生草本植物,性微甘、涩、寒,具有抗氧化、改善循环、免疫调节等多种药理作用[6]。红景天对IH所致肺损伤有无影响及作用机制鲜见报道。本研究拟通过建立IH大鼠模型,观察IH对肺组织氧化应激、低氧损伤、炎性因子及组织结构的影响,并通过红景天的干预,进一步探讨其对IH暴露后肺组织的保护作用及机制。
1 材料与方法
1.1 实验动物
4周龄雄性SD大鼠45只[兰州大学实验动物中心,合格证号:NO.62000800000260,生产许可证号:SCXK(甘)2018/0002],颗粒饲料喂养,自由饮水。本实验遵循实验动物保护和使用指南,并获得兰州大学实验动物伦理委员会批准。
1.2 药品、试剂与仪器
大株红景天注射液(吉林通化玉圣药业有限公司,批号:1001190302)。一氧化氮(NO)、超氧化物歧化酶(SOD)、丙二醛(MDA)、促红细胞生成素(EPO)、肿瘤坏死因子-α(TNF-α)、P物质-1(SP-1)及低氧诱导因子-1α(HIF-1α)试剂盒(北京华英生物技术研究所,生产批号:20180803、201800809、20180812、201809816、20180804、20180810、20180803);医用氧/氮气(兰州光华物资公司);间歇低氧控制系统[7](兰州大学第一医院呼吸科);酶标分析仪(无锡华卫德朗仪器有限公司,DR-200BS);半自动生化仪(北京松上技术有限公司,A6);荧光定量PCR仪(上海宏石医疗科技有限公司,SLAN-96P)。
1.3 分组与处理
将45只SD大鼠常氧常压条件饲养1周后,按体重随机分为五组(每组9只):常氧对照组(A组)、IH组(B组)、IH+低剂量红景天组(C组)、IH+中剂量红景天组(D组)、IH+高剂量红景天组(E组)。用IH控制系统控制低氧/复氧的频率及循环时间。120 s/循环:30 s氮气→间歇10 s→20 s氧气→60 s压缩空气。大鼠每日8:00~16:00进舱,舱内氧浓度(低氧期6%~7%,复氧后20%~21%);A组持续充压缩空气,氧浓度维持20%~21%。其余时间常氧常压条件饲养。第16天开始,C组、D组及E组腹腔注射大株红景天(0.05 mL/100 g、0.1 mL/100 g、0.2 mL/100 g,均用0.9%氯化钠配制成1.0 mL),A组和B组注射0.9%氯化钠,1.0 mL/只,持续30 d。后以10%水合氯醛0.3 mL/100 g腹腔麻醉,在冰床上快速解剖分离大鼠左肺并分成2份,一份液氮冻存,一份多聚甲醛固定。
1.4 观察指标及方法
1.4.1 比色法(SOD、NO、MDA) 按试剂盒步骤进行。
1.4.2 酶联免疫吸附测定法(EPO、TNF-α) 均质仪匀浆,超声波碎5 min,3500 g,离心15 min后取上清液,按说明书进行。
1.4.3 RT-PCR(HIF-1α mRNA、SP-1 mRNA) 反应体系:2×qPCR Mix 12.5 μL,7.5 μmol/L基因引物 2.0 μL,反转录产物2.5 μL,ddH2O 8.0 μL。HIF-1α:上游引物5′-GCGGCGAGAACGAGAAGAAA-3′、下游引物5′-GGGGAAGTGGCAACTGATGA-3′,扩增片段132 bp。SP-1:上游引物5′-ACAACTTTCACAGGGTGCCA-3′、下游引物5′-AGAGACTGTGCGGTTCTTGG-3′,扩增片段136 bp。扩增条件:预变性95℃,10 min;循环(40次)95℃,15 s→60℃,60 s;溶解曲线75℃→95℃,每20秒升温1℃。
1.4.4 HE染色 4%多聚甲醛固定,常规石蜡包埋,4 μm厚连续切片,脱蜡,HE染色。
1.5 统计学方法
采用SPSS 20.0软件进行数据分析。计量资料用均数±标准差(x±s)表示,多組间比较采用单因素方差分析,进一步两两比较采用LSD法,相关性采用Pearson相关分析。以P < 0.05为差异有统计学意义。
2 结果
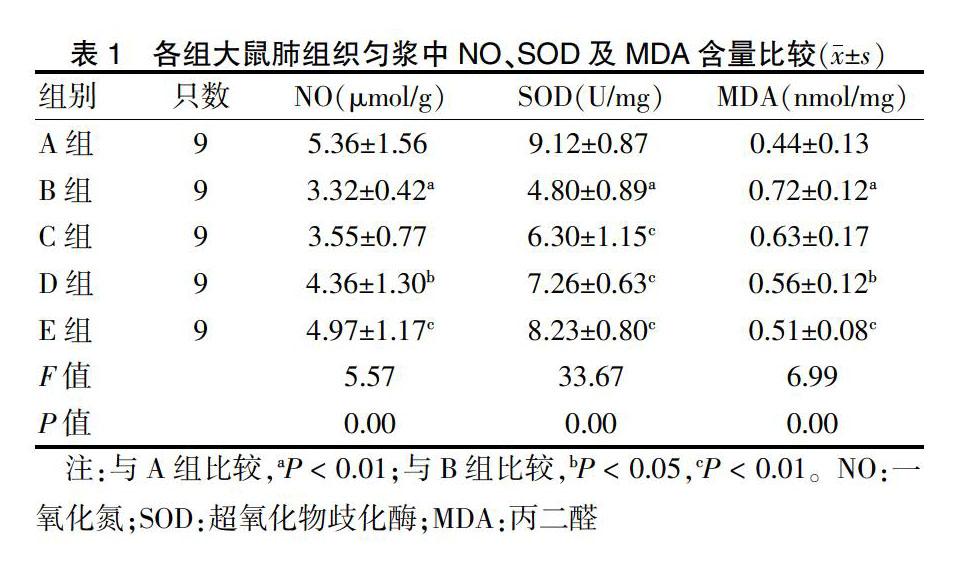
2.1 各组大鼠肺组织匀浆中NO、SOD及MDA含量比较
与A组比较,B组NO和SOD含量降低,MDA含量升高(均P < 0.01);与B组比较,C组SOD含量升高(P < 0.01),D组、E组NO、SOD含量升高,MDA含量降低(P < 0.05或P < 0.01)。见表1。
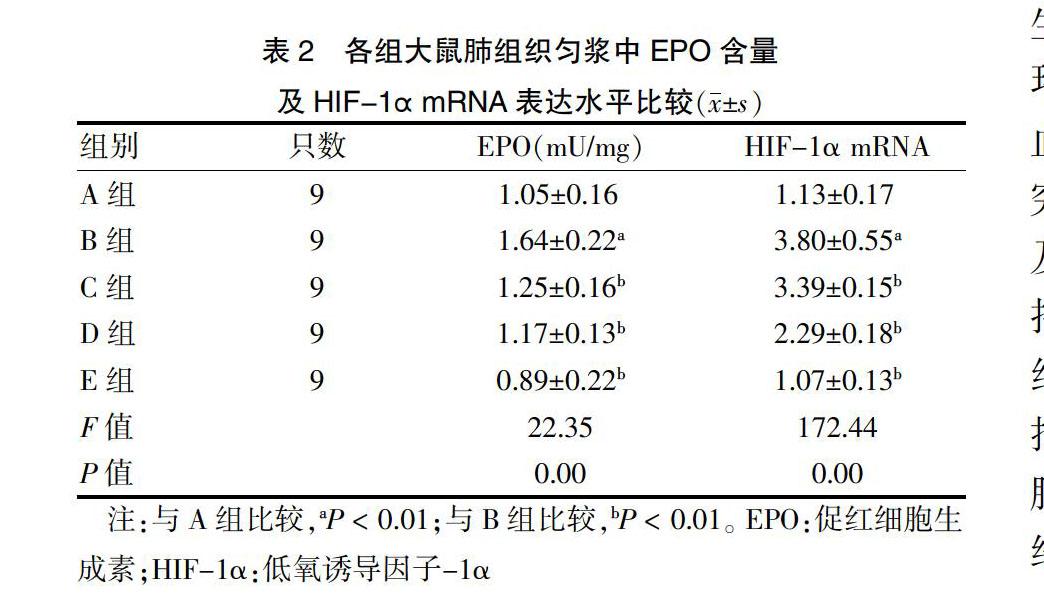
2.2 各组大鼠肺组织匀浆中EPO含量及HIF-1α mRNA表达水平比较
与A组比较,B组EPO含量及HIF-1α mRNA表达水平升高(均P < 0.01);与B组比较,C组、D组、E组EPO含量及HIF-1α mRNA表达水平降低(均P < 0.01)。见表2。
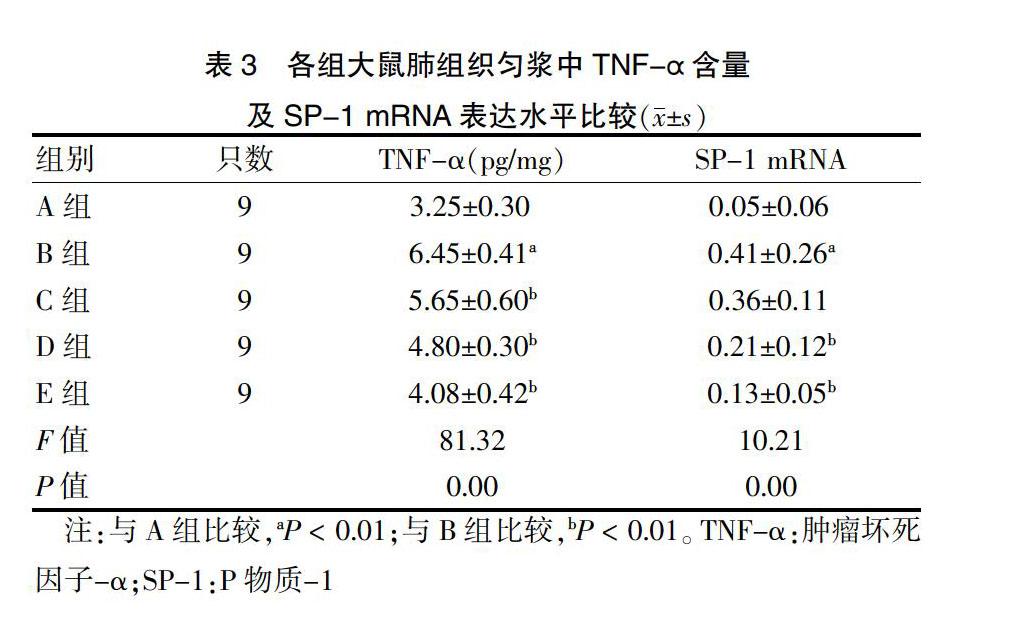
2.3 各组大鼠肺组织匀浆中TNF-α含量及SP-1 mRNA表达水平比较
与A组比较,B组TNF-α含量及SP-1 mRNA表达水平升高(均P < 0.01);与B组比较,C组TNF-α含量降低(P < 0.01),D组、E组TNF-α含量及SP-1 mRNA表达水平均降低(均P < 0.01)。见表3。
2.4 相关性分析
SP-1 mRNA表达水平、TNF-α含量与NO、SOD含量呈负相关,与MDA、EPO含量及HIF-1α mRNA表达水平呈正相关。见图1~2。
2.5 各组大鼠肺组织病理显微镜检查结果
A组肺组织形态结构未见明显异常。B组可见大量炎症细胞渗出,动脉管壁显著增厚及玻璃样变,纤维组织增生,肺泡腔见多量泡沫样细胞及灶性出血。C组、D组、E组上述病理变化有改善,以E组最为显著。见图3。
3 讨论
OSASH被公认为是一种累及多脏器的疾病,其主要病因之一为IH。本研究发现,IH暴露后大鼠肺组织可见大量炎症细胞渗出并围绕血管,小动脉及细动脉管壁显著增厚及玻璃样变,肺间质弥漫性纤维组织增生,间隔增宽,部分肺泡腔见多量泡沫样细胞,并见灶性出血。本研究提示,IH的主要致病机制为低氧应答及氧化应激。HIF-1是缺氧代谢反应的总开关[8],其生物活性主要由α亚基决定。机体缺氧后为适应低氧环境促使HIF-1α表达,其通过调控EPO、内皮素-1、血管内皮生长因子等多种靶基因发挥代偿作用。本研究观察到,IH暴露后,肺组织HIF-1α mRNA表达水平及EPO含量明显升高,提示IH可致肺组织中HIF-1α持续累积,刺激EPO生成,从而导致红细胞、成纤维细胞和平滑肌细胞生成过多,损伤肺泡Ⅱ型上皮细胞,抑制肺泡表面活性物质的合成和分泌[9],使血液黏稠、肺顺应性降低及氧合障碍,诱发动脉粥样硬化、肺纤维化等心肺疾病[10-11]。
IH的另一致病机制为低氧/复氧循环引起的氧化应激。研究表明,氧化应激可致内皮细胞损伤及修复能力降低[12]、肺血管重塑[13],从而导致肺动脉高压、心力衰竭、肺气肿等[14-15]。本研究显示,IH暴露后大鼠肺组织SOD、NO含量显著降低,MDA含量显著升高,提示IH暴露后肺组织呈高氧化应激状态。
此外,有研究表明,IH亦可通过激活NF-κB、TNF-α、白细胞介素-6等介导炎性反应[16],而这种机制依赖于NADPH氧化酶1(Nox1)对内源性ROS的催化作用。SP-1是Nox1活化的重要转录因子,可刺激肥大细胞分泌TNF-α[17],造成肺血管通透性增加、间质水肿及肺顺应性下降,又可通过HIF-1α加重血管内皮损伤[18]。本研究可见,IH暴露后肺组织TNF-α含量及SP-1 mRNA表達水平显著升高。本研究相关性分析显示,IH暴露后,肺组织TNF-α含量及SP-1 mRAN表达水平与NO、SOD、MDA、EPO含量和HIF-1α mRNA表达水平之间的变化趋势存在显著相关性,表明IH可能通过氧化应激、低氧应答介导炎性反应造成肺损伤,三者相互作用,形成恶性循环。
大株红景天注射液是由大株红景天经微波协助提取分离、精制、膜过滤而制成的中药注射液。研究表明,红景天可通过抑制活性氧簇-NO途径、降低细胞色素C释放、提高氧分压和线粒体活性、改善血黏度、降低血管通透性、抗动脉粥样硬化[19-20]等多种机制实现抗氧化保护作用。本研究观察到,经红景天干预的IH暴露后的大鼠肺组织,其炎性因子TNF-α含量及SP-1 mRNA表达随氧化应激水平及低氧反应指标的改善而改善,肺组织病理亦明显改善,并呈显著的剂量依赖性,提示红景天可能通过增强抗氧化物质活性、清除过多氧自由基、减少脂质过氧化产物、减轻低氧损害及下调多种炎性因子水平实现对IH所致大鼠肺损伤的保护作用,但具体机制还有待进一步深入研究。
[参考文献]
[1] Lévy P,Kohler M,Mcnicholas WT,et al. Obstructive sleep apnoea syndrome [J]. Nat Rev Dis Primers,2015,1(11):15015.
[2] Jordan AS,Mcsharry DG,Malhotra A. Adult obstructive sleep apnoea [J]. Lancet,2014,383(9918):736-747.
[3] Li J,Lu C,Wang W,et al. Assessment of right atrium dysfunction in patients with obstructive sleep apnea syndrome using velocity vector imaging [J]. Cardiovasc Ultrasoun,2018,16(1):32.
[4] Lurie A. Inflammation,oxidative stress,and procoagulant and thrombotic activity in adults with obstrucive sleep apnea [J]. Adv Cardiol,2011,46:43-66.
[5] Marco C,Pietro S,Annapaola Z,et al. Correlation between inflammatory markers of atherosclerosis and carotid intima-media thickness in obstructive,sleep apnea [J]. Molecules,2014,19(2):1651-1662.
[6] 刘明成,张得钧.红景天药理作用研究进展[J].亚太传统医药,2013,9(6):65-69.
[7] 刘维英,余勤,岳红梅.一种实验动物氧舱结构:CN205 511448U [P]. 2016.
[8] Choudhry H,Harris AL. Advances in hypoxia-inducible factor biology [J]. Cell Metab,2018,27(2):281-298.
[9] Suresh MV,Ramakrishnan SK,Thomas B,et al. Activation of hypoxia-inducible factor-1α in type 2 alveolar epithelial cell is a major driver of acute inflammation following lung contusion [J]. Crit Care Med,2014,42(10):e642-e653.
[10] 向永红,苏晓丽,贺若曦,等.不同低氧方式对大鼠血清和组织局部肾素血管紧张素系统的影响[J].中华结核和呼吸杂志,2012,35(1):33-36.
[11] Chen LN,Yang XH,Nissen DH,et al. Dysregulated renin-angiotensin system contributes to acute lung injury caused by hind-limb ischemia-reperfusion in mice [J]. Shock,2013,40(5):420-429.
[12] Tuleta I,Fran?觭a CN,Wenzel D,et al. Hypoxia-induced endothelial dysfunction in apolipoprotein E-deficient mice,effects of infliximab and L-glutathione [J]. Atherosclerosis,2014,236(2):400-410.
[13] Ma L,Zhang J,Liu Y. Roles and mechanisms of obstructive sleep apnea-hypopnea syndrome and chronic intermittent hypoxia in atherosclerosis:evidence and prospective [J]. Oxid Med Cell Longev,2016,2016:8215082.
[14] Lu W,Kang J,Hu K,et al. Angiotensin-(1-7) relieved renal injury induced by chronic intermittent hypoxia in rats by reducing inflammation,oxidative stress and fibrosis [J]. Braz J Med Bio Res,2017,50(1):e5594.
[15] Dumitrascu R,Heitmann J,Seeger W,et al. Obstructive sleep apnea,oxidative stress and cardiovascular disease:lessons from animal studies [J]. Oxid Med Cell Longev,2013, 2013:234631.
[16] Lee Y,Wang Y,Mak J,et al. Intermittent hypoxia induces NF-κB-dependent endothelial activation via adipocyte-derived mediators [J]. Am J Physiol Cell Physiol,2016,310(6):C446-C455.
[17] Guo S,Wang H,Luo Y,et al. Sp-1 negatively regulates miR-20b expression in macrophages [J]. Ann Clin Lab Sci,2017,47(6):706-712.
[18] Songbai Y,Jian Y,Xuhui H. Inhibition of miR-135b by SP-1 promotes hypoxia-induced vascular endothelial cell injury via HIF-1α [J]. Exp Cell Res,2018,370(1):31-38.
[19] Li Y,Wu J,Shi R,et al. Antioxidative effects of rhodiola genus:phytochemistry and pharmacological mechanisms against the diseases [J]. Curr Top Med Chem,2017,17(15):1692-1708.
[20] Ni J,Li YM,Li WM,et al. Salidroside protects against foam cell formation and apoptosis,possibly via the MAPK and AKT signaling pathways [J]. Lipids Health Dis,2017, 16(1):198.
(收稿日期:2019-08-21 本文編辑:李亚聪)
