阿魏酸对脂多糖诱导的小鼠急性肺损伤的保护作用
2019-10-15钟正灵江玉华杨沿浪张炜婷童九翠储冀汝谢海棠
钟正灵,江玉华,杨沿浪,张 飞,张炜婷,童九翠,李 娟,储冀汝,谢海棠*
(1.皖南医学院第一附属医院 弋矶山医院 《中国临床药理学与治疗学》编辑部,安徽 芜湖 241000;2.皖南医学院 药学,安徽 芜湖 241000;3.皖南医学院第一附属医院 弋矶山医院 肾内科,安徽 芜湖 241000;4.皖南医学院 临床医学,安徽 芜湖 241000;5.皖南医学院第一附属医院 弋矶山医院 临床药物评价中心,安徽 芜湖 241000)
急性肺损伤(Acute Lung Injury,ALI)是各种间接和直接致伤因素(包括机械因素、化学因素、生物因素)导致的毛细血管内皮细胞及肺泡上皮细胞损伤,致使急性低氧性呼吸功能不全。以通气/血流比例失调、肺顺应性降低、肺容积减少为病理生理特征,临床上表现为呼吸窘迫和进行性低氧血症,其严重阶段被称为急性呼吸窘迫综合征。多中心流行病学研究结果提示中国ALI的病死率远高于西方发达国家[1-2]。ALI具有较高的死亡率和发病率,并且近年呈现增高趋势,目前仍缺乏有效的治疗方法,对该病的治疗及其发病机制的研究一直以来都是危重症医学领域关注的热点问题[3-5]。
目前临床上主要使用糖皮质激素、利索茶碱、表面活性剂、N-乙酰半胱氨酸和鱼油等药物治疗ALI,这些药物对ALI有一定的作用,但同时存在各种毒副作用,治疗效果均不理想[6-8]。虽然国内外针对ALI治疗的基础研究和临床实验也较多,但目前尚无特效的治疗药物。
当归可预防和治疗放射性肺损伤[9]。当归须散能显著降低急性肺挫伤患者炎性细胞因子水平,抑制炎性反应,阻断肺损伤的演变进程,缩短康复时间[10]。阿魏酸(Ferulic Acid,FA)是从当归中提取的有效活性成分之一。文献研究表明阿魏酸在当归中的含量为0.06%[11],经高效液相色谱检测显示,当归含药血清主要成分含有阿魏酸[12-13]。当归对肺损伤的保护作用是否是阿魏酸发挥药效作用尚未可知。因此,实验以BALB/c小鼠为研究对象,探讨阿魏酸对脂多糖诱导的急性肺损伤小鼠是否具有保护效应。
1 材料与方法
1.1 药品、试剂
阿魏酸(含量为98%,使用时用生理盐水进行配制),购于南京建成生物工程研究所(批号:F103701);脂多糖,购于美国Sigma公司(批号:1020031);地塞米松磷酸钠注射液,购于辰欣药业股份有限公司(批号:1708232121);无水乙醇、戊巴比妥试剂均为市售分析纯。TNF-α试剂盒(批号:RK00027)、IL-6试剂盒(批号:RK00008)、IL-1β试剂盒(批号:RK00006),均购于ABclonal Biotechnology Co.,Ltd。
1.2 仪器与设备
UPT-Ⅱ-20T型超纯水器(成都超纯科技有限公司);电子分析天平(FA1004);高速冷冻离心机(Thermo XIR);FC型酶标仪(美国Thermo公司);50 uL微量进样器(上海高河工贸有限公司);ELISA专用微量振荡器(MX-100-4A,杭州奥盛仪器有限公司);LRHS恒温干燥箱(DHG-9023A,东莞环瑞环境测试设备厂);RM2245型转轮式切片机(德国徕卡公司);BI-2000医学图像分析系统(成都泰盟科技有限公司)。
1.3 动物
BALB/c小鼠,(20±2) g,雄性,SPF级,购于南京市江宁区青龙山动物繁殖场,许可证号:SCXK(苏)2017-0001,动物合格证号:201704335。
1.4 分组与给药
60只小鼠适应性饲养2周后随机分为6组:正常对照组,模型组,阿魏酸高(30 mg/kg)、中(15 mg/kg)、低剂量组(7.5 mg/kg)和地塞米松组(2 mg/kg),每组10只。灌胃给药,正常对照组、模型组灌胃等体积生理盐水,每天1次。连续给药7 d,末次给药后2 h,正常对照组给予同体积生理盐水,其余各组均通过微量进样器气管快速滴注脂多糖(10 mg/kg)[14],禁食不禁水,造模6 h后,小鼠眼部采血,处死小鼠,迅速取出小鼠的肺组织。
1.5 肺组织湿/干重比值测定
取出小鼠的右肺上叶,除去结缔组织,用生理盐水清洗数次并用滤纸吸干后称湿重,放在80 ℃恒温干燥箱中连续干燥72 h以上,分别称量肺组织干重并记录,计算小鼠肺组织湿/干重比值[15]。
1.6 ELISA法测定血清TNF-α、IL-6、IL-1β含量
按照ELISA试剂盒说明书分别测定血清中IL-1β、IL-6、TNF-α含量。
1.7 肺组织病理学观察
取小鼠左肺上叶肺组织适量,将肺组织固定于多聚甲醛溶液中,24 h后取出,用生理盐水充分冲洗后甲酸脱钙,并进行常规脱水、浸蜡、包埋,制备蜡块,使用切片机切成超薄切片,去石蜡,并用苏木素-伊红染液染色,采用BI-2000医学图像分析系统进行拍照以及图像分析观察肺组织形态改变(×200)。
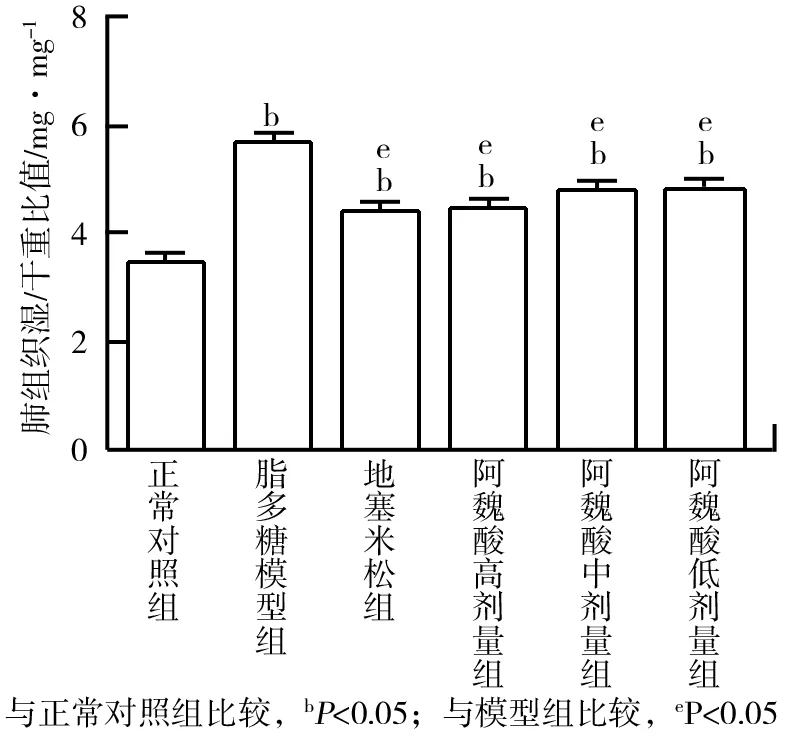
图1 阿魏酸对急性肺损伤小鼠肺组织湿/干重比值的影响(x±s,n=10)
1.8 统计学方法
2 结果
2.1 阿魏酸对急性肺损伤小鼠肺组织湿/干重比值的影响
与正常对照组比较,模型组小鼠肺组织湿/干重比值明显升高,差异具有统计学意义(P<0.05);与模型组比较,地塞米松组与阿魏酸高、中、低剂量组小鼠肺组织湿/干重比值明显降低,差异具有统计学意义(P<0.05),阿魏酸对急性肺损伤小鼠肺组织湿/干重比值的影响如图1所示。由图1可知,阿魏酸可以显著降低急性肺损伤小鼠肺组织水肿。
2.2 阿魏酸对急性肺损伤小鼠血清中TNF-α、IL-6、IL-1β含量的影响
与正常对照组比较,模型组小鼠血清TNF-α、IL-6、IL-1β含量明显升高,差异具有统计学意义(P<0.05)。与模型组比较,地塞米松组与阿魏酸高、中、低剂量组小鼠血清TNF-α、IL-6、IL-1β含量明显降低,差异具有统计学意义(P<0.05)。各组小鼠肺组织湿/重比值及血清中TNF-α、IL-6、IL-1β含量如表1所示,结果表明阿魏酸可以显著降低急性肺损伤小鼠血清炎症因子水平。
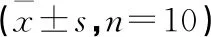
表1 各组小鼠肺组织湿/重比值及血清中TNF-α、IL-6、IL-1β含量
与正常对照组比较,bP<0.05;与模型组比较,eP<0.05。
2.3 各组小鼠肺组织病理形态学变化
正常对照组肺组织结构完整,肺泡间隔之间无水肿,肺组织未见明显病理改变;模型组肺组织可见肺泡间隔增厚,大量炎性细胞浸润,部分肺泡腔缩小,含有较多的炎性细胞;地塞米松组上述变化明显减轻;阿魏酸低、中、高剂量组上述变化依次减轻,仅见肺泡间隔少量炎性细胞。各组小鼠的肺组织病理形态学变化如图2所示。
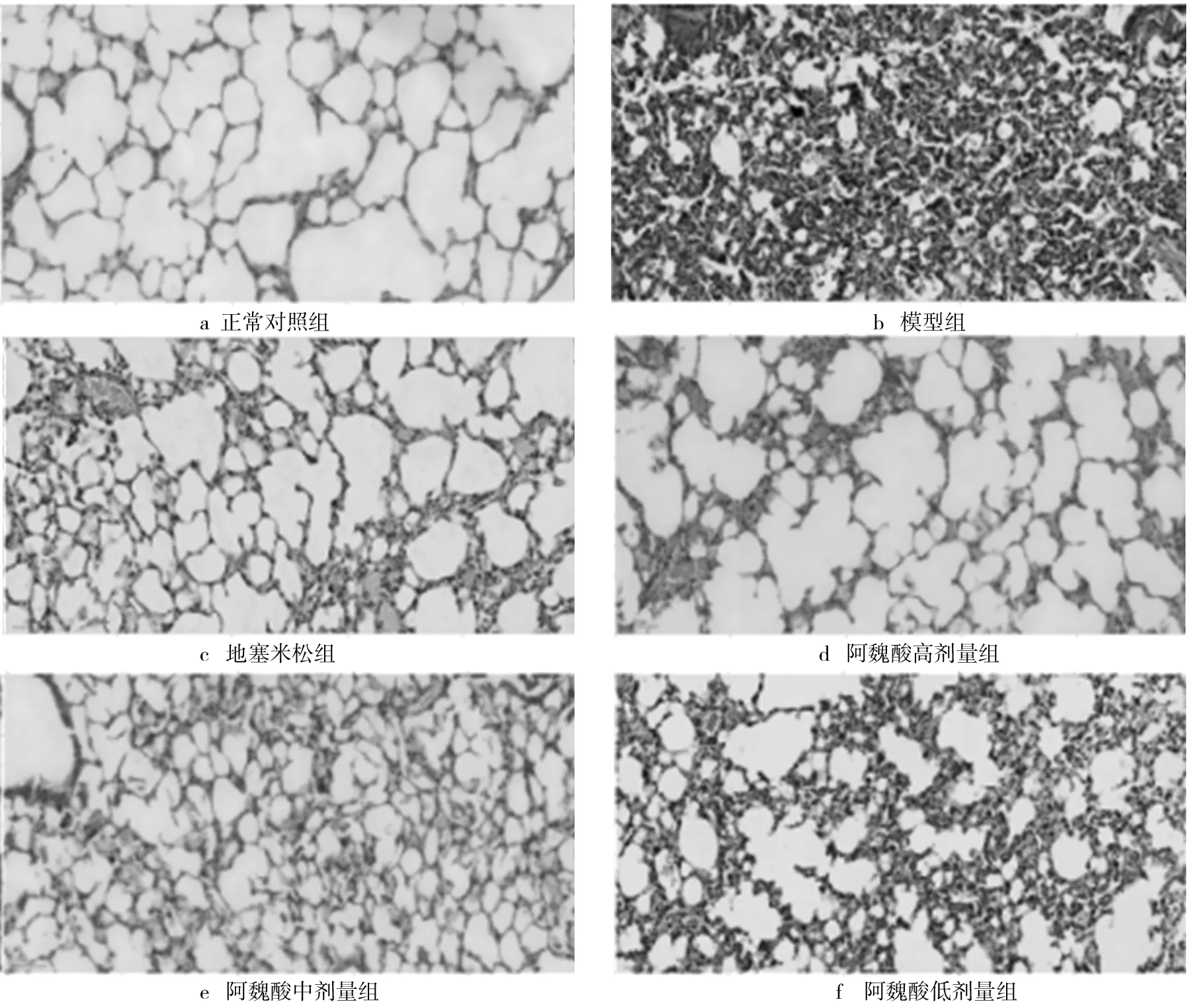
图2 各组小鼠的肺组织病理形态学变化图(×200)
3 讨论
ALI是由多种原因导致的急性呼吸功能障碍,弥漫性肺间质及肺泡水肿,肺内失控的炎症细胞因子和炎症细胞的大量释放为其主要病理表现[16-17]。耿焱[18]等对劳力型与经典型热射病大鼠急性肺损伤的病理特点及时程变化进行比较,结果发现急性肺损伤大鼠损伤早期病理改变主要为少量的炎性细胞浸润和间质毛细血管扩张充血,中暑6 h后肺脏损伤加重,肺泡结构模糊,间质血管显著扩张充血,出现肺泡腔出血;中暑24 h后大鼠肺损伤进一步加重,肺泡间隔和肺泡中充满了大量红细胞,大量的炎性细胞浸润肺间质,间质明显增厚。实验结果显示,与模型组比较,阿魏酸高、中、低剂量组肺湿/干重比值明显降低,表明阿魏酸可以显著降低急性肺损伤小鼠肺组织水肿。病理图片显示模型组肺泡间隔增厚,大量炎性细胞浸润,部分肺泡腔缩小,含有较多炎性细胞;阿魏酸高、中、低剂量组上述变化明显减轻,仅见肺泡间隔内少量炎性细胞。
脂多糖是革兰氏阴性细菌外膜的主要成分,可直接作用于肺组织,破坏肺泡引起出血、肺水肿,使坏死组织、炎性细胞堆积,促使肺泡巨噬细胞和炎性反应链的激活,导致肺内炎性反应[19]。TNF-α是导致急性肺损伤的关键细胞因子,主要来源于脂多糖刺激T细胞、单核细胞、巨噬细胞等。TNF-α能导致多种促炎细胞因子和炎症介质的过度释放,并进一步激发炎症级联反应[20]。IL-6是由激活的巨噬细胞、淋巴细胞及上皮细胞分泌,涉及肺内炎症的过度反应,是肺内主要的炎症因子之一[21]。TNF-α和IL-6均具有触发炎症反应的作用[22]。IL-1β是由激活的单核巨噬细胞、中性粒细胞、表皮细胞和内皮细胞所分泌,IL-1β是炎症放大启动因子,参与炎症的发生和发展[18]。实验结果显示,与模型组比较,阿魏酸高、中、低剂量组小鼠血清TNF-α、IL-6、IL-1β含量均明显降低,表明阿魏酸可以显著降低急性肺损伤小鼠血清炎症因子水平。
