纤维素酶协同超声波辅助乙醇提取红肉火龙果色素工艺的优化
2019-10-15段晓嫣邓放明
田 艳 段晓嫣 - 邓放明 -
(湖南农业大学食品科学技术学院,湖南 长沙 410128)
火龙果(HylocereusundulatusBritt),仙人掌科植物[1-2],植物性蛋白与膳食纤维含量丰富[3-4],经常食用可以改善便秘,对糖尿病患者及高血脂症患者有辅助治疗作用[5-7]。红心火龙果果皮和果肉色泽艳丽,富含甜菜苷类色素,是制备天然色素的优良资源[8-11]。
目前,国内外火龙果色素主要采用溶剂提取法,所得火龙果色素产品纯度低,耗时较长,且存在提取剂残留、色素产品中含有果胶等问题[12-14]。超声波可与媒质产生热作用、机械作用和空穴作用,在一定程度上破坏细胞壁结构,使细胞内物质快速溢出,从而使溶剂更易进入细胞内。应用超声波技术提取天然活性成分能够有效提高提取率,并利于生物活性的保留[15-18]。酶解法主要利用果胶酶、纤维素酶等软化或分解植物细胞壁,促进胞内成分流出,增加待提取物与提取剂接触机会,有效提高生物活性成分的提取率[19-21]。
试验拟采用酶协同超声波辅助溶剂提取红肉火龙果果皮、果肉色素,应用响应面法优化其提取工艺条件,为火龙果色素的制备及资源的综合利用提供依据。
1 材料与方法
1.1 试验材料
红肉火龙果:湖南天和盛业农业开发有限公司;
无水乙醇、丙酮:分析纯,国药集团化学试剂有限公司;
柠檬酸、柠檬酸钠:食品级,华兴生物制剂有限公司;
纤维素酶(2 113 U/mL)、果胶酶(2 096 U/mL):华兴生物制剂有限公司。
1.2 仪器与设备
分析天平:AUY2200型,日本SHAMADZV公司;
真空冷冻干燥机:FDU-1200型,日本 EYELA 公司;
旋转蒸发仪:RV10型,德国IKA公司;
紫外分光光度计:WFJ7200型,尤尼柯(上海)仪器有限公司;
离心机:TDL-5型,上海安亭科学仪器厂;
超声波清洗仪:KM-400DE型,昆山美美超声仪器有限公司;
高速中药粉碎机:400Y型,旭曼有限公司;
水浴锅:YLJYE-100型,艾本德(中国)有限公司。
1.3 试验方法
1.3.1 工艺流程
火龙果→清洗、去除表面鳞片、晾干→果皮、果肉分离→果皮切条、果肉打浆→冻干→粉碎过40目筛→取粉末,加入提取剂提取→3 800 r/min离心15 min→取上清液减压旋转蒸发去除溶剂、浓缩→红色素粗提液
1.3.2 酶—超声波法提取色素的单因素试验设计
(1) 酶种类:准确称取火龙果果皮(或果肉)冻干样品0.250 0 g,按料液比1∶200(g/mL)溶解于pH 4.5 20%乙醇中,按照表1加入不同酶种类及体积,在超声温度40 ℃,超声功率200 W条件下提取30 min,离心取上清液,浓缩处理后定容至100 mL,于538 nm处测定吸光度,计算火龙果红色素得率。
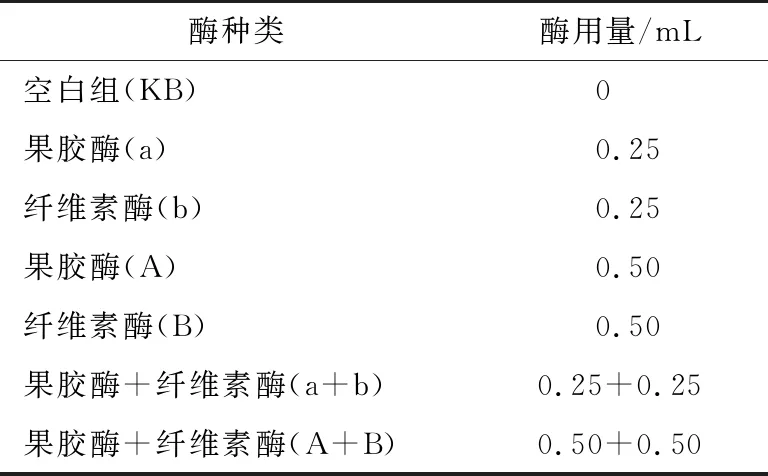
表1 不同酶种类提取红肉火龙果果皮与果肉色素†
† 果胶酶液为固体酶稀释250倍,纤维素酶为固体酶稀释200倍。
(2) 酶添加量:准确称取火龙果果皮(或果肉)冻干样品0.250 0 g,按料液比1∶200(g/mL)溶解于pH 4.5 20%乙醇中,分别添加0.20,0.25,0.50,0.75,1.00,1.25 mL 辅助酶,在超声温度40 ℃,超声功率200 W条件下提取30 min,离心取上清液,浓缩处理后定容至100 mL,于538 nm处测定吸光度,计算火龙果红色素得率。
(3) 提取溶剂种类:准确称取火龙果果皮(或果肉)冻干样品0.250 0 g,按料液比1∶200(g/mL)分别加入 pH 4.5 蒸馏水、30%丙酮、30%甲醇、30%乙醇,添加0.5 mL 纤维素酶,在超声温度40 ℃,超声功率200 W条件下提取30 min,离心取上清液,浓缩处理后定容至100 mL,于538 nm处测定吸光度,计算火龙果红色素得率。
(4) 浸提液 pH:准确称取火龙果果皮(或果肉)冻干样品0.250 0 g,按料液比 1∶200(g/mL)溶解于不同 pH的20%乙醇,添加0.5 mL纤维素酶,在超声温度40 ℃,超声功率200 W条件下提取30 min,离心取上清液,浓缩处理后定容至100 mL,于538 nm处测定吸光度,计算火龙果红色素得率。
(5) 浸提液浓度:准确称取火龙果果皮(或果肉)冻干样品0.250 0 g,按料液比 1∶200(g/mL)分别溶解于 pH 4.5 的10%,20%,40%,60%,80%乙醇,添加0.5 mL纤维素酶,在超声温度40 ℃,超声功率200 W条件下提取30 min,离心取上清液,浓缩处理后定容至100 mL,于538 nm处测定吸光度,计算火龙果红色素得率。
(6) 料液比:准确称取火龙果果皮(或果肉)冻干样品0.250 0 g,分别按照料液比为1∶50,1∶100,1∶150,1∶200,1∶250,1∶300(g/mL)溶解于 pH 4.5的20%乙醇,添加0.5 mL纤维素酶,在超声温度40 ℃,超声功率200 W 条件下提取30 min,离心取上清液,浓缩处理后定容至100 mL,于538 nm处测定吸光度,计算火龙果红色素得率。
(7) 超声功率:准确称取火龙果果皮(或果肉)冻干样品0.250 0 g,按料液比为 1∶200(g/mL)加入 pH 4.5的20%乙醇,添加0.5 mL纤维素酶,分别在超声功率50,100,200,300,400 W,超声温度40 ℃条件下提取30 min,离心取上清液,浓缩处理后定容至100 mL,于538 nm处测定吸光度,计算火龙果红色素得率。
(8) 超声温度:准确称取火龙果果皮(或果肉)冻干样品0.250 0 g,按料液比为 1∶200(g/mL)加入 pH 4.5的20%乙醇,添加0.5 mL纤维素酶,分别在超声温度20,40,60,80 ℃,超声功率200 W条件下提取30 min,离心取上清液,浓缩处理后定容至100 mL,于538 nm处测定吸光度,计算火龙果红色素得率。
(9) 超声时间:准确称取火龙果果皮(或果肉)冻干样品0.250 0 g,按料液比为 1∶200(g/mL)加入 pH 4.5的20%乙醇,添加0.5 mL纤维素酶,在超声温度40 ℃,超声功率200 W条件下分别超声10,20,30,40,50 min,离心取上清液,浓缩处理后定容至100 mL,于538 nm处测定吸光度,计算火龙果红色素得率。
1.3.3 响应面优化试验设计 根据单因素试验结果,应用Box-Behnken 中心组合的试验设计原理,选取火龙果果皮(果肉)色素得率为响应值,超声时间、超声温度、超声功率和乙醇浓度为因素进行四因素三水平的响应面分析试验。
1.3.4 指标测定
(1) 纤维素酶活力测定:按NY/T 912—2004执行。经测定,试验中所用纤维素酶稀释液活力为2 113 U/mL。
(2) 果胶酶活力测定:参照张飞等[22]、王小敏等[23],采用DNS比色法。经测定,试验中所用果胶酶稀释液活力为2 096 U/mL。
(3) 火龙果甜菜苷得率:火龙果色素粗提取液定容至100 mL,于538 nm处测得相应吸光度,按式(1)计算总甜菜苷得率。
(1)
式中:
X——总甜菜苷含量,mg/100 g;
Aλ——总甜菜苷吸光值;
MW——标准甜菜苷摩尔质量分数,550.46;
n——稀释倍数;
V——提取液体积,mL;
ε——标准甜菜苷摩尔消光系数,61 600;
L——通路长度,1.0 cm。
1.4 数据处理
采用 Excel 2010 制作图表,利用 Design Expert 8.0软件进行试验设计、分析和建模。
2 结果与分析
2.1 单因素试验结果
综合图1及色素提取效果与性价比可知,红色火龙果果皮色素提取的工艺条件为纤维素酶0.7 mL、20%乙醇浓度、pH 5.0、料液比1∶200(g/mL)、超声功率300 W、超声温度40 ℃、超声时间20 min;红色火龙果果肉色素提取的工艺条件为纤维素酶0.5 mL、20%乙醇浓度、pH 5.0、料液比1∶200(g/mL)、超声功率300 W、超声温度40 ℃、超声时间30 min。
2.2 火龙果果皮色素提取工艺优化
2.2.1 Box-Behnken试验设计及结果 根据单因素试验结果,选取超声时间、超声温度、超声功率、乙醇浓度为自变量,以火龙果色素得率为响应值,利用Design Expert 8.0 软件中的Box-Behnken设计四因素三水平响应面优化试验,试验因素水平表见表2,试验设计及结果见表3。
2.2.2 回归方程方差分析 对表3的试验数据进行多元二次回归拟合,得到应变量对自变量的关系为:
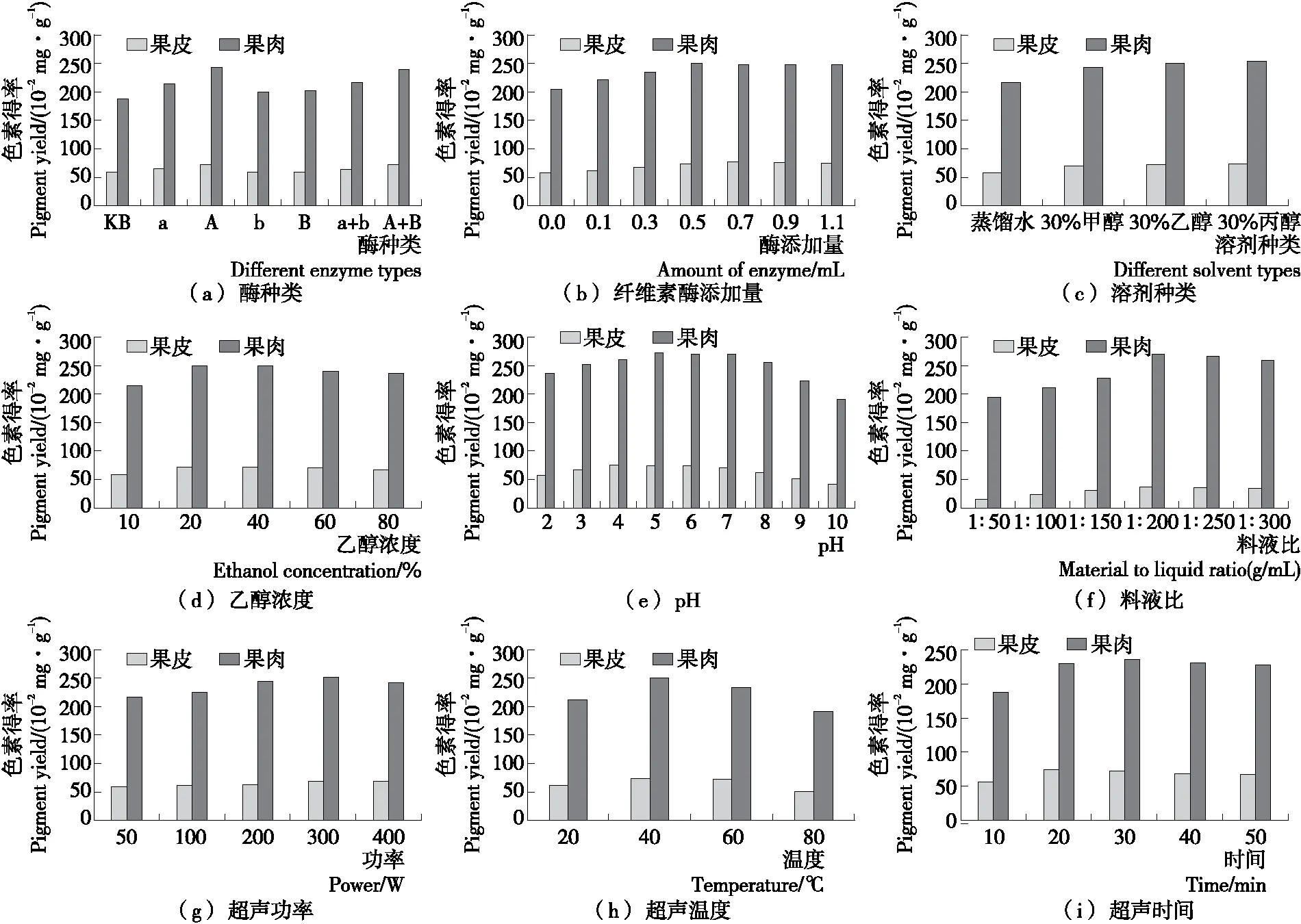
图1 不同因素对火龙果红色素得率的影响
表2酶—超声波辅助乙醇提取火龙果果皮(肉)色素响应面试验因素水平表
Table 2 Extraction of pigments from pitaya fruit peel(meat)by enzyme-ultrasound assisted method
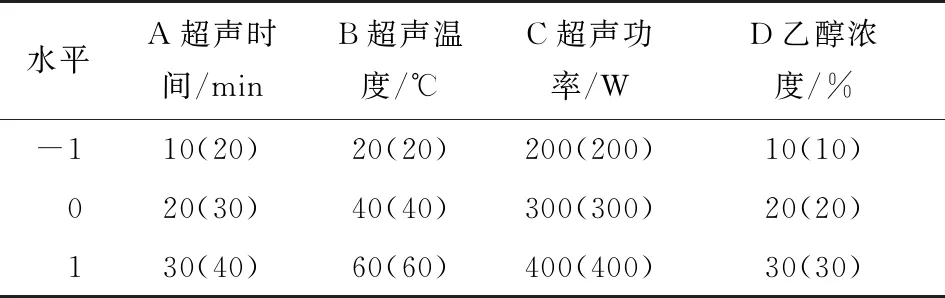
水平A超声时间/minB超声温度/℃C超声功率/WD乙醇浓度/%-110(20)20(20)200(200)10(10)020(30)40(40)300(300)20(20)130(40)60(60)400(400)30(30)
表3酶—超声波辅助乙醇提取火龙果果皮色素响应面分析法试验设计及结果
Table 3 Ultrasonic-assisted enzymatic extraction of pitaya pericarp pigment by response surface methodology design and results
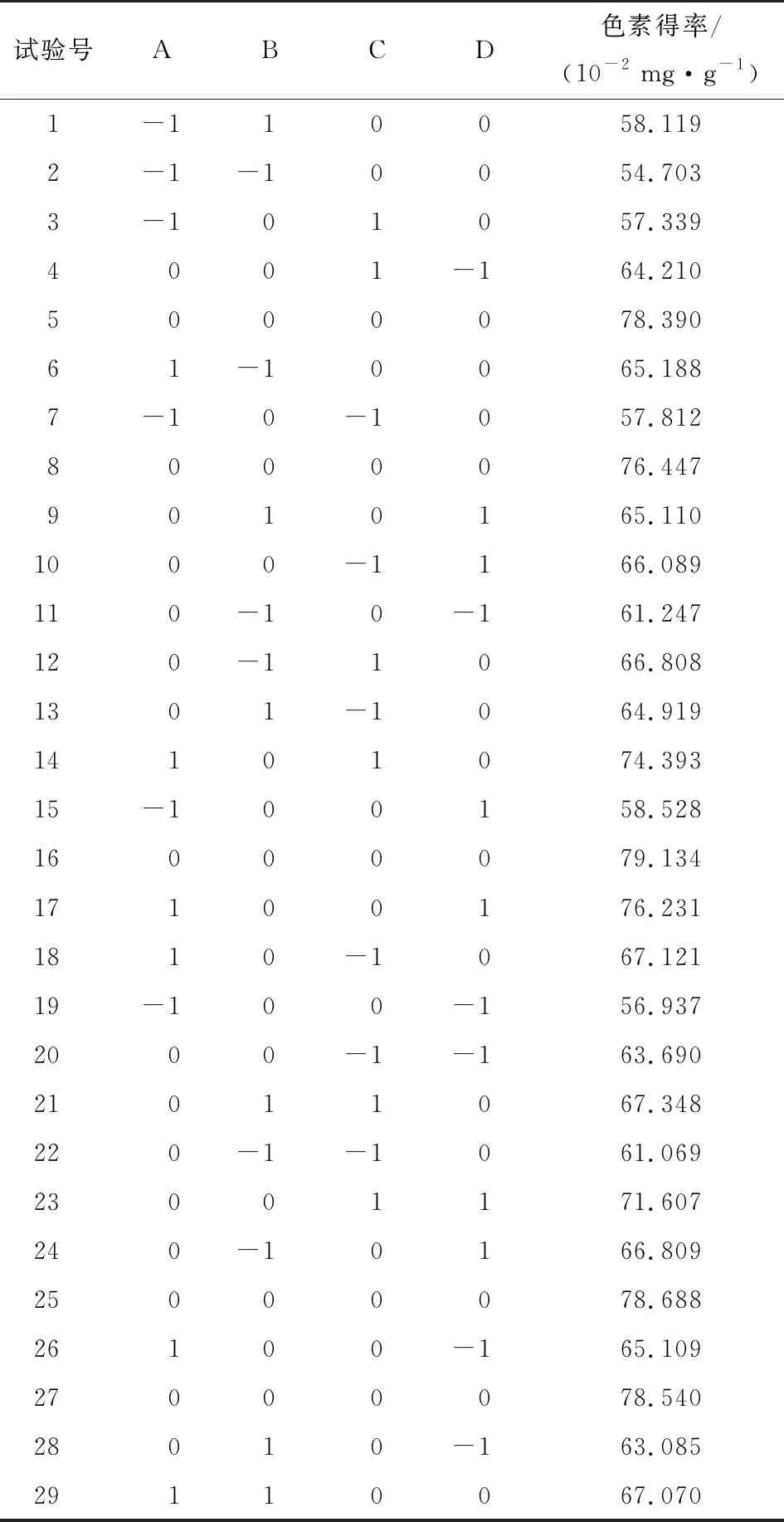
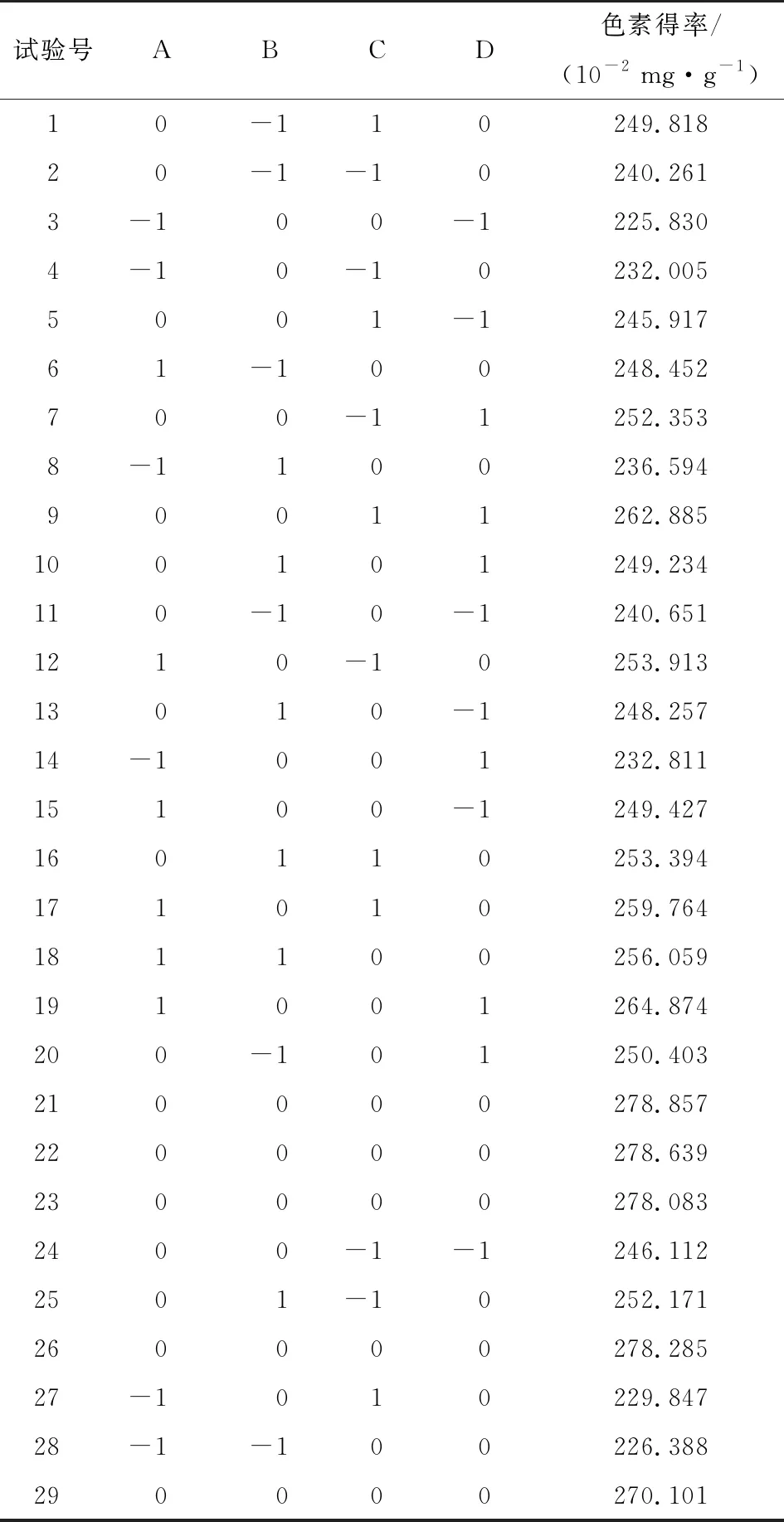
试验号ABCD色素得率/(10-2 mg·g-1)1-110058.1192-1-10054.7033-101057.3394001-164.2105000078.39061-10065.1887-10-1057.8128000076.4479010165.1101000-1166.089110-10-161.247120-11066.8081301-1064.91914101074.39315-100158.52816000079.13417100176.2311810-1067.12119-100-156.9372000-1-163.69021011067.348220-1-1061.06923001171.607240-10166.80925000078.68826100-165.10927000078.54028010-163.08529110067.070
Y=78.24+5.97A+0.82B+1.75C+2.51D-0.38AB+1.94AC+2.38AD-0.83BC-0.88BD+1.25CD-8.49A2-8.12B2-5.51C2-5.98D2。
(2)
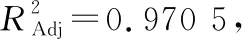
综上所述,该回归模型拟合度良好,试验误差小,能准确分析和预测酶—超声波同步辅助提取火龙果果皮色素的得率。
表4酶—超声波辅助乙醇提取火龙果果皮色素影响因素响应面回归模型的方差分析†
Table 4 Variance analysis on regression model of enzyme-ultrasonic method for extraction of pitaya pericarp pigments
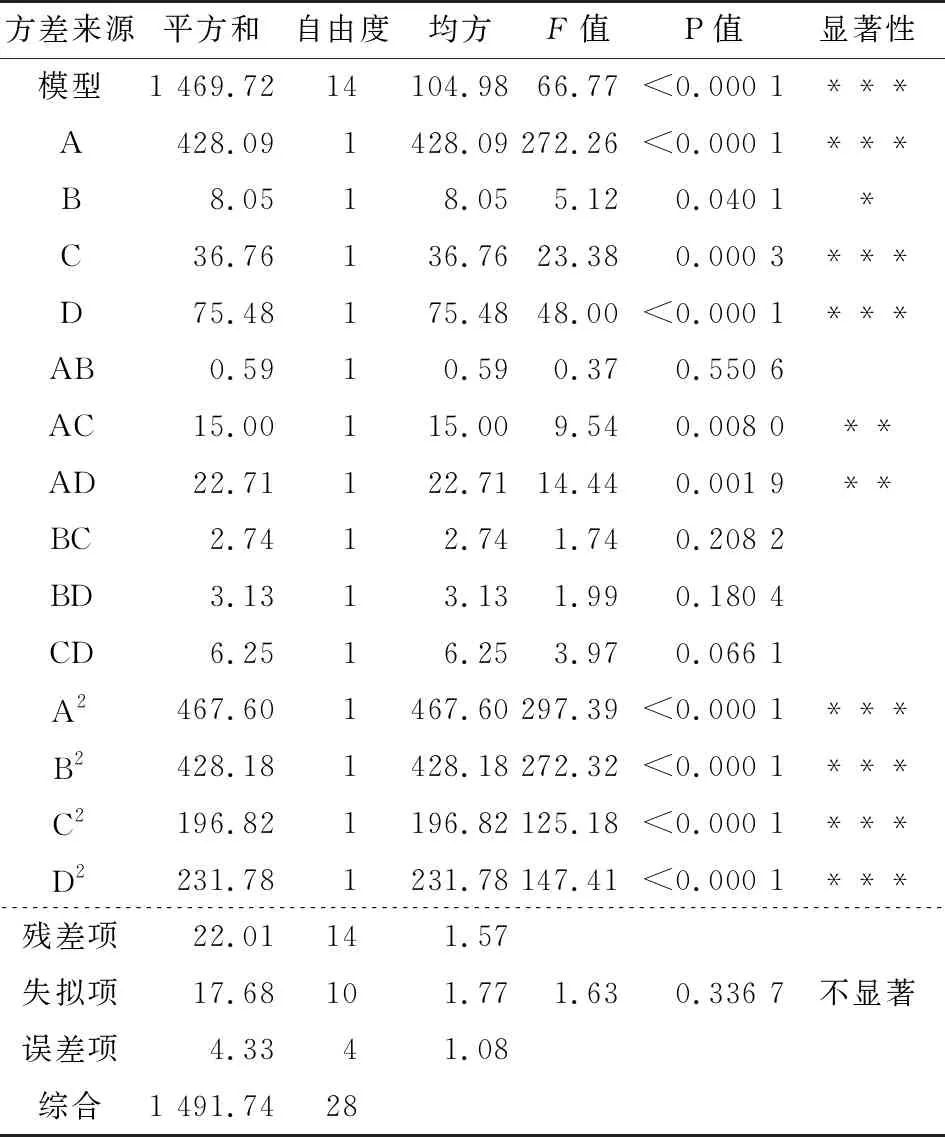
方差来源平方和自由度均方F值P值显著性模型1 469.7214104.9866.77<0.000 1***A428.091428.09272.26<0.000 1***B8.0518.055.120.040 1*C36.76136.7623.380.000 3***D75.48175.4848.00<0.000 1***AB0.5910.590.370.550 6AC15.00115.009.540.008 0**AD22.71122.7114.440.001 9**BC2.7412.741.740.208 2BD3.1313.131.990.180 4CD6.2516.253.970.066 1A2467.601467.60297.39<0.000 1***B2428.181428.18272.32<0.000 1***C2196.821196.82125.18<0.000 1***D2231.781231.78147.41<0.000 1***残差项22.01141.57 失拟项17.68101.771.630.336 7不显著误差项4.3341.08综合1 491.7428
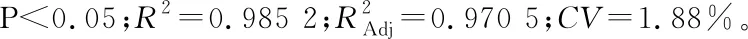
2.2.3 响应曲面分析 由图2(a)、(b)可知,A与B对Y的交互作用不显著,A与C对Y存在交互作用。随着超声时间和超声功率的增加,火龙果果皮色素得率逐渐升高,但当超声时间和超声功率增大到一定值后,火龙果果皮色素的得率却随超声时间的增加和超声功率的增大而降低。同理,由图2(c)~(f)可得,A与D所对应的响应曲面图形坡度陡峭,等高线形状趋于椭圆形且排列紧密,说明超声时间和乙醇浓度对火龙果果皮色素得率的响互影响较大,而A与B、B与C、C与D对Y的响应面图形坡度相对平缓,等高线排列较稀疏,表明超声温度与超声时间、超声时间与超声功率、超声时间与乙醇浓度对火龙果果皮色素得率的交互影响相对较弱。
2.2.4 提取参数优化及模型验证运用 根据所得模型,预测出在稳定状态下最佳提取工艺参数为超声时间24.28 min、超声温度 39.18 ℃、超声功率326.97 W、乙醇浓度23.23%。在此条件下,火龙果果皮色素得率为80.161 2 mg/100 g。考虑到实际操作及设备参数调整可行性,调整最优提取工艺参数为提取时间24 min、提取温度39 ℃、超声功率325 W、乙醇浓度23%。在此条件下采用酶—超声波同步辅助提取火龙果果皮色素(n=3),得到火龙果果皮色素得率为(81.661 3±0.762 0) mg/100 g,与预测值接近,说明优化结果可行。
2.3 火龙果果肉色素提取工艺优化
2.3.1 Box-Behnken试验设计及结果 试验设计与火龙果果皮色素提取的方法一致,试验设计及结果见表5。
2.3.2 回归方程方差分析 对表5的试验数据进行多元二次回归拟合,获得应变量对自变量的关系为:
Y=276.79+12.42A+3.31B+2.07C+4.70D-0.65AB+2.00AC+2.12AD-2.08BC-2.19BD+2.68CD-20.04A2-15.58B2-12.23C2-13.44D2。
(3)
图2 各因素交互作用对火龙果果皮色素得率的影响
表5酶—超声波辅助乙醇提取火龙果果肉色素响应面分析法试验设计及结果
Table 5 Ultrasonic-assisted enzymatic extraction of pitaya pulp pigment by response surface methodology design and results
试验号ABCD色素得率/(10-2 mg·g-1)10-110249.81820-1-10240.2613-100-1225.8304-10-10232.0055001-1245.91761-100248.452700-11252.3538-1100236.59490011262.885100101249.234110-10-1240.6511210-10253.91313010-1248.25714-1001232.81115100-1249.427160110253.394171010259.764181100256.059191001264.874200-101250.403210000278.857220000278.639230000278.0832400-1-1246.1122501-10252.171260000278.28527-1010229.84728-1-100226.388290000270.101

表6酶—超声波辅助乙醇提取火龙果果肉色素影响因素响应面回归模型的方差分析†
Table 6 Variance analysis on regression model of enzyme-ultrasonic method for extraction of pitaya pulp pigments
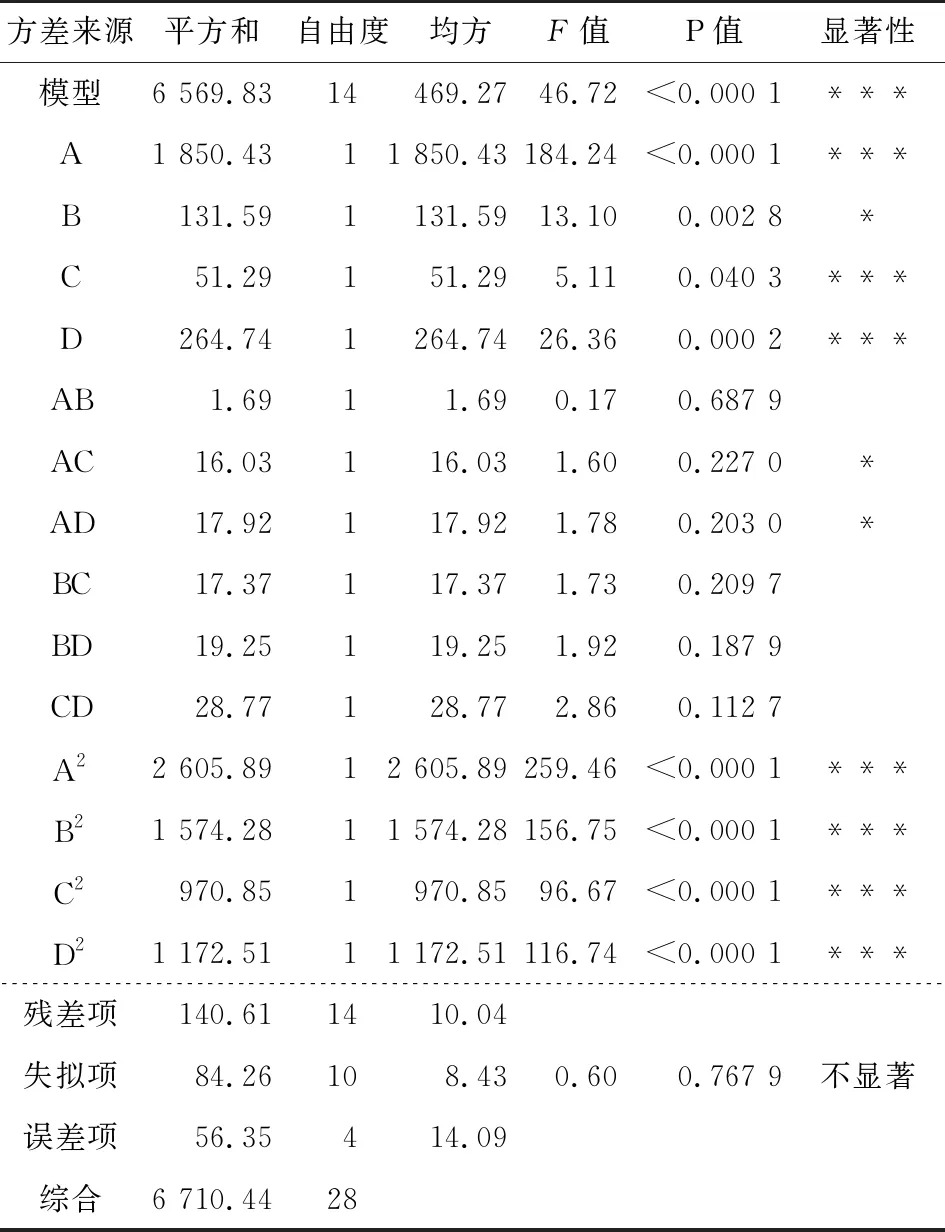
方差来源平方和自由度均方F值P值显著性模型6 569.8314469.2746.72<0.000 1***A1 850.4311 850.43184.24<0.000 1***B131.591131.5913.100.002 8*C51.29151.295.110.040 3***D264.741264.7426.360.000 2***AB1.6911.690.170.687 9AC16.03116.031.600.227 0*AD17.92117.921.780.203 0*BC17.37117.371.730.209 7BD19.25119.251.920.187 9CD28.77128.772.860.112 7A22 605.8912 605.89259.46<0.000 1***B21 574.2811 574.28156.75<0.000 1***C2970.851970.8596.67<0.000 1***D21 172.5111 172.51116.74<0.000 1***残差项140.611410.04 失拟项84.26108.430.600.767 9不显著误差项56.35414.09综合6 710.4428
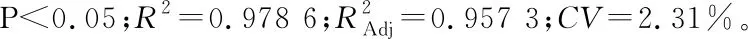
2.3.3 响应面曲面分析 由图3(a)、(b)可知,A与B对Y的交互作用不显著,A与C对Y存在交互作用。随着超声时间和超声功率的增加,火龙果果肉色素得率逐渐升高,但当超声时间和超声功率增大到一定值后,火龙果果肉色素的得率却随超声时间的增加和超声功率的增大而降低。同理可得,A与D所对应的响应曲面图形坡度陡峭,等高线形状趋于椭圆形且排列紧密,说明超声时间和乙醇浓度对火龙果果肉色素得率的相互影响较大,而A与B、B与C、C与D对Y的响应面图形坡度相对平缓,等高线排列较稀疏,表明超声温度与超声时间、超声时间与超声功率、超声时间与乙醇浓度对火龙果果肉色素得率的交互影响相对较弱。
2.3.4 提取参数优化及模型验证运用 据所得模型预测出在稳定状态下最佳提取工艺参数为提取时间34.27 min、提取温度40.50 ℃、超声功率312.72 W、乙醇浓度22.93%,此条件下,火龙果色素得率为279.560 2 mg/100 g。考虑到实际操作及设备参数调整可行性,调整最优提取工艺参数为提取时间34 min、提取温度41 ℃、超声功率315 W、乙醇浓度23%,此条件下采用酶—超声波同步辅助提取火龙果果肉色素(n=3),得到火龙果果肉色素得率为(278.660 4±1.084 2) mg/100 g,与预测值接近,说明优化结果可行。
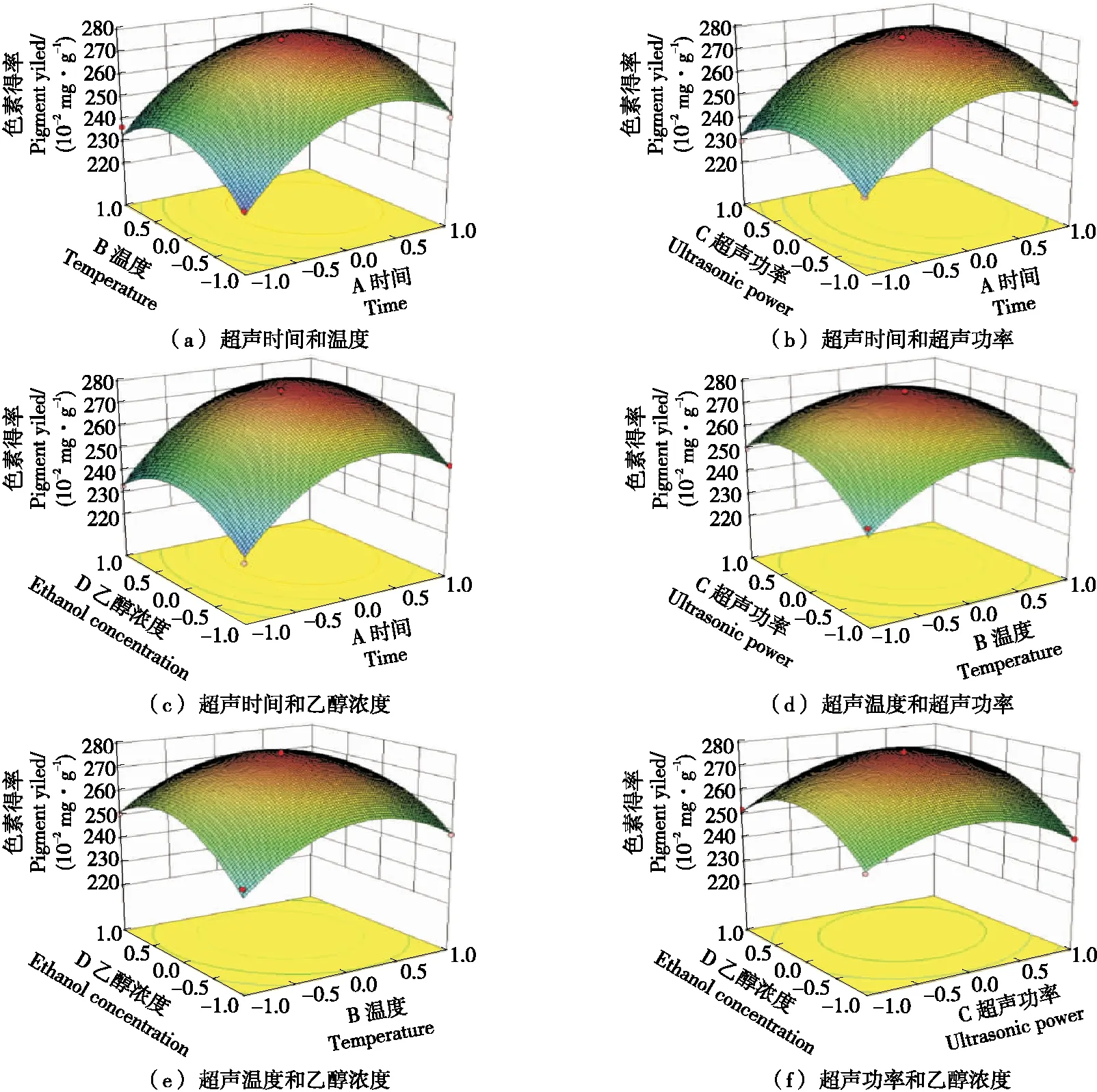
图3 各因素交互作用对火龙果果肉色素得率的影响
3 结论
以红色火龙果果皮、果肉冻干样为原料,采用四因素三水平响应面分析法对纤维素酶—超声波辅助乙醇提取火龙果果皮、果肉色素进行优化,得到红色火龙果果皮色素提取的最优工艺为料液比1∶200(g/mL)、pH 5.0、乙醇浓度23%、纤维素酶0.7 mL(2 133 U/mL)、超声时间24 min、超声温度39 ℃、超声功率325 W,此条件下火龙果色素得率为(81.661 3±0.762 0) mg/100 g;红色火龙果果肉色素提取的最优工艺条件为料液比1∶200 (g/mL)、pH 5.0、乙醇浓度23%、纤维素酶0.5 mL(2 133 U/mL)、超声时间34 min、超声温度41 ℃、超声功率315 W,此条件下火龙果色素得率为(278.660 4±1.084 2) mg/100 g。红色火龙果果肉色素明显高于果皮,是工业化提取色素的优质原料,但果皮是火龙果食用后的废弃物,提取色素也是其综合利用的有效途径之一。纤维素酶—超声波辅助乙醇提取火龙果色素具有条件温和、处理时间短、提取物食用安全性高和提取率高等特点,优于高治平等[24]、王娅玲等[19]采用的超声波辅助乙醇提取法和陈艳红等[25]采用的微波提取工艺。但其工业化应用还有待于进一步完善。
