子宫腺肌病内膜细胞中HAS-2和CD44的表达及雌激素对其影响
2019-10-15林斯丽
林斯丽 段 华
首都医科大学附属北京妇产医院(100006)
子宫腺肌病(ADS)是一种雌激素依赖型妇科常见疾病,发病机制尚不清,但子宫内膜细胞侵袭迁移能力的增加被认为在ADS发生发展中起重要作用[1]。透明质酸合成酶(HAS)广泛参与癌症细胞的侵袭迁移、组织损伤的修复及炎症反应等[2]。透明质酸受体CD44与透明质酸(HA)结合可激活多种下游信号通路参与肿瘤细胞的侵袭和转移过程。ADS虽是一种良性疾病,却具有侵袭转移等恶性生物学行为。近来,上皮间质转化(EMT)与ADS子宫内膜侵袭迁移的研究备受关注[3-4],而HAS和CD44与EMT的发生发展密切相关[5-6]。目前,有关HAS与ADS的研究鲜有报道, 且CD44与ADS的研究也未曾与HAS有过关联。本研究检测HAS及CD44在子宫腺肌病患者子宫内膜细胞中的表达及相关性,分析雌激素对其影响,探讨其在子宫腺肌病的发生发展中的可能作用。
1 资料与方法
1.1 资料来源
选取2017年10月—2018年9月在本院手术治疗的ADS患者21例(ADS组),均经病理学检查确诊,年龄(44.2±2.6)岁,收集其在位子宫内膜。选择同期因子宫颈上皮内瘤变Ⅲ级行全子宫切除术且无子宫内膜病变的患者19例为对照组,年龄(43.0±2.4)岁,收集其子宫内膜组织。两组对象月经规律,未合并其他内外科疾病,术前3个月内未接受激素类药物治疗。本研究经院伦理委员会批准,患者术前均签署知情同意书。
1.2 方法
1.2.1组织取材刮取ADS在位内膜组织,置于4℃生理盐水中,用于子宫内膜细胞分离及培养。
1.2.2子宫内膜细胞的培养将获得的子宫内膜组织剪粉碎(<1mm),用胶原酶I消化30 min,经100 μm尼龙网过滤,去除未消化的组织。1000g离心5 min,弃上清,DMEM培养基(0.5%FBS)洗涤1次,离心后弃上清。细胞沉淀中加入含5%FBS的DMEM/F12培养基将细胞打散为均匀悬浮液,接种于25cm2培养瓶中,置于37℃,5%CO2培养箱中培养。待90%~95%细胞融合,消化传代。子代经形态经电镜鉴定确定为上皮细胞后,待细胞生长至培养瓶内表面积的80%时,予以无酚红无血清培养基同步化48 h,然后分别以0、0.1、1.0、10.0 nmol/L 17β-雌二醇(美国sigma公司产品)作用子宫内膜细胞24 h,提取细胞RNA。
1.2.3 RT-qPCR检测HAS各亚型及CD44 mRNA的表达提取细胞RNA,反转录合成 cDNA,并进行PCR反应扩增。HAS1、HAS2、HAS3和CD44及内参照磷酸甘油醛脱氢酶 (GAPDH)基因序列通过Gene Bank获得。引物设计和合成由上海生工生物科技有限公司完成,引物序列见表1。确认实时PCR的扩增曲线和熔解曲线,由Applied Biosystems 7500荧光定量PCR仪(美国ABI公司)分析结果,自动计算出目的基因mRNA的表达。

表1 HAS各亚型和CD44的引物序列
1.3 统计学方法
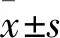
2 结果
2.1 内膜组织中HAS各亚型和CD44表达
ADS组HAS2和CD44 mRNA的表达量均高于对照组,而HAS1和HAS3 mRNA的表达量无差异(P>0.05),见表2。ADS组HAS2与CD44表达呈正相关(r=0.797,P<0.0001),见图1。
2.2 雌激素对HAS2和CD44的调节作用
ADS组HAS2的表达与17β-雌二醇呈浓度依赖型上升,与未用药0 nmol/L比较有差异(t=2.647、5.448、8.644,P<0.05),见表3。1.0 nmol/L 17β-雌二醇使对照组HAS2 mRNA表达量发生显著上升,与未用药比较有差异(t=5.643,P<0.05);而0.1、10.0 nmol/L浓度的17β-雌二醇未能上调对照组HAS2 mRNA的表达,与未用药比较均无差异(P>0.05)。对照组仅10.0 nmol/L 17β-雌二醇干预后CD44 mRNA的表达量上调,与未用药比较有差异(t=3.426,P<0.05),见表3。ADS组1.0、10.0 nmol/L浓度的17β-雌二醇可显著上调CD44 mRNA表达量,与未用药比较均有差异(t=3.141、4.892,P<0.05)。

表2 两组子宫内膜细胞HAS各亚型和CD44 mRNA表达水平

表3 不同浓度17β-雌二醇作用后两组子宫内膜细胞 HAS2和CD44 mRNA的表达
*与0 nmol/L比较P<0.05
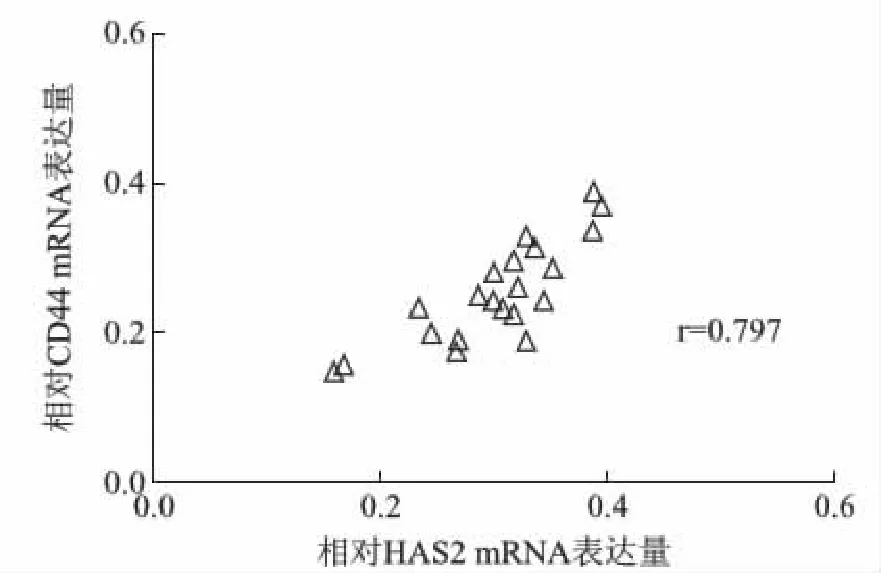
图1 ADS组子宫内膜细胞HAS2与CD44表达相关性
3 讨论
3.1 ADS子宫内膜过表达HAS2
HAS2是HAS家族亚型(HAS1、HAS2和HAS3)之一,合成的HA的分子量最大,在调节细胞的迁移进程中有重要作用。研究表明,多种恶性肿瘤细胞通过过表达HAS2,调控细胞的浸润和远处转移等恶性生物学行为[7]。ADS虽是一种良性疾病,却具有侵袭转移等恶性生物学行为。本研究结果显示,在正常子宫内膜组织中存在3种HAS亚型的表达,且HAS2的表达最为显著,ADS子宫内膜HAS2发生异常高表达。提示HAS2可能对子宫内膜细胞侵袭转移能力的提高有一定的调控作用。
3.2 ADS子宫内膜HAS2/HA/CD44轴的异常激活
CD44是一种参与细胞间相互作用、粘附和迁移的细胞表面糖蛋白,也是参与HA信号转导通路中最常见的受体。临床上CD44的过表达与多种肿瘤的转移呈正相关[8]。本研究结果显示,与对照组相比,ADS组子宫内膜CD44表达明显增加,异常表达的CD44与HAS2表达水平呈正相关。既往研究表明,CD44与HA结合可通过激活局部粘着斑激酶、丝裂原活化蛋白激酶和Rho激酶下游靶点等多种途径促进癌细胞的运动[9]。由此推测,在ADS中HAS2可能通过合成大量HA,HA作用于其受体CD44并激活下游多种信号通路参与ADS发生发展。
研究人员经过免疫组化检测正常子宫内膜及ADS的在位内膜、异位内膜组织中E-cadherin,CD44v6的表达发现,ADS异位内膜和在位内膜中E-cadherin的表达发生下调,CD44v6的表达发生上调,且两者表达呈负相关[10]。E-cadherin是一种重要的细胞粘附因子,E-cadherin表达的损失会触发EMT转录因子的表达。可见,CD44v6的表达与子宫腺肌病EMT的发生发展密切相关。CD44v6是CD44变体之一,子宫腺肌病中HAS2/HA/CD44激活的下游信号通路是否通过下调E-cadherin的表达还需进一步研究证实。
3.3 ADS子宫内膜局部高浓度雌激素上调HAS/HA/CD44轴的表达
本研究结果显示,使用中、高浓度(1.0、10.0 nmol/L)的17β-雌二醇作用于ADS组子宫内膜细胞后CD44 mRNA表达呈上升趋势,而对照组CD44 mRNA表达仅高浓度17β-雌二醇干预后发生上调。提示两组子宫内膜细胞CD44的表达对雌激素的反应有所不同,ADS组对雌激素的反应性更高。此外,ADS组子宫内膜HAS2的表达与17β-雌二醇呈浓度依赖型增高,而对照组仅对中浓度的17β-雌二醇有明显的反应性,而高浓度的17β雌二醇对正常子宫内膜HAS2的表达显示一定的抑制作用。提示正常子宫内膜对高浓度雌激素有一定的抵抗作用,而ADS组子宫内膜失去了此保护机制。子宫腺肌病是一种雌激素依赖性疾病,雌激素诱导的EMT在子宫腺肌病的发病机制中至关重要。研究表明,ADS血清17β-雌二醇水平与在位和病变子宫内膜的上皮组分中的E-cadherin表达呈负相关[11]。雌激素可诱导EECs发生成纤维细胞样表型的形态学变化,并通过上调Slug的表达,引发从上皮标志物表达向间充质标志物表达的转变,增加迁移和侵袭的能力[11]。由此推断,在ADS子宫内膜中高浓度的雌激素可能通过表达HAS2和CD44,导致机体合成大量HA,参与ADS子宫内膜EMT过程。
本研究对ADS子宫内膜细胞HAS2和CD44的表达进行了分析,从体外细胞培养的角度验证了HAS2和CD44在ADS的高表达,且对不同浓度雌激素的反应性,一定程度上解释了ADS子宫内膜细胞发生侵袭转移能力增强的原因,为后续ADS的研究提供方向。 HAS2与ADS发病机制关系的报道较少,本研究只是初步探索,对HAS2功能的研究以及与ADS发病的因果关系将是今后研究的重点。
