成都地区肉鸭屠宰链弯曲菌毒力基因分布及分子分型研究
2019-10-15李佳康黄雪琳巫梦雨申玉玺邹立扣韩新锋
李佳康,黄雪琳,曾 杭,杨 蕾,巫梦雨,雪 妍,申玉玺,黄 勇,邹立扣,韩新锋
弯曲菌(Campylobacterspp.)是重要的食源性人兽共患病原菌,可引起人类细菌性胃肠炎,表现为腹泻、腹痛等,这些疾病通常在2~3周内可自行痊愈,但特殊情况下,弯曲菌可导致人类吉兰-巴雷综合征(Guillain-Barre syndrome,GBS),甚至产生败血症,严重危害人类的生命安全[1]。其发病率在某些欧美国家已经超过志贺氏菌以及沙门氏菌等主要腹泻致病菌[2]。弯曲菌属目前报导包含24个菌种,其中空肠弯曲菌(Campylobacter jejuni,C.jejuni)和结肠弯曲菌(Campylobacter coli,C.coli)为人类疾病的主要致病菌[3]。
家禽是弯曲菌最重要的贮存库,人类感染弯曲菌主要与直接接触带菌动物或者食用未充分加工的禽肉有关。大部分温血动物均为弯曲菌的携带者,通常不表现明显的症状,但可长时间向环境排出大量的弯曲菌。在肉鸭屠宰链中,若卫生管理不合格或者监控不到位,则屠宰胴体很容易受到弯曲菌的污染,从而增加消费者罹患弯曲菌病的风险。
目前有学者通过群体遗传分析证实了食物中弯曲菌病原体在动物和人之间可以进行克隆传播[4],而致病细菌中毒力基因的存在与表达是其致病的原因之一。弯曲菌的毒力基因主要包括介导空肠弯曲菌附着宿主肠道上皮细胞以及定植的黏附基因cad F和趋化基因cheY;介导鞭毛运动的蛋白基因fla A;影响细菌粘附和侵袭力的质粒基因virB11;引起腹泻的主要入侵基因iam A、cia B;表达产生多种有害毒素的毒素基因cdt A、cdtB、cdtC等。
国内外对于弯曲菌的研究主要集中在鸡源弯曲菌的分离鉴定以及抗菌药物耐药性分析,缺乏肉鸭贮库的相关资料。本文主要针对成都地区某屠宰场肉鸭屠宰链过程中的弯曲菌进行主要毒力基因的检测以及PFGE分子分型研究,以此探究鸭源弯曲菌的毒力基因分布现状和肉鸭屠宰过程中的交叉污染现象,了解屠宰链过程中弯曲菌的潜在风险和克隆传播趋势,为兽医公共卫生以及为预防食源性疾病的发生提供基础数据。
1 材料与方法
1.1 材 料
1.1.1 菌株来源 2015年、2016年先后于成都地区某肉鸭屠宰场采集样品,屠宰肉鸭为42日龄樱桃谷肉鸭。采集盲肠内容物、肉鸭胴体表面棉拭子、屠宰肉鸭胴体浸没水样以及冲洗水样,低温运输。水样及棉拭子于Bolton肉汤中增菌后,进行Skirrow弯曲菌选择性血琼脂平板、改良CCDA琼脂平板划线;盲肠内容物直接于Skirrow弯曲菌选择性血琼脂进行划线培养。随后挑取疑似典型菌落进行多重PCR鉴定,从以上样品中共分离鉴定出68株弯曲菌,包括35株空肠弯曲菌和33株结肠弯曲菌,分别编号为CJ1~CJ35和CC1~CC33。
1.1.2 标准菌株 沙门氏菌(Salmonella enteritidis)标准菌株H9812。
1.1.3 主要试剂和培养基 Skirrow弯曲菌选择性血琼脂、Bolton肉汤(含特殊添加剂)以及哥伦比亚血琼脂基础购于青岛海博生物技术有限公司;DL 2000 DNA Maker、Premix TaqTM和限制性内切酶SmaⅠ、XbaⅠ均购于宝日医生物技术(北京)有限公司;蛋白酶K和Gel Red核酸染料购于天根生化科技(北京)有限公司;Gold ViewTMⅠ型核酸染色剂购于北京索莱宝科技有限公司;AgaroseⅢTM,Low EEO&High Gelstrength购于BBI Life Sciences。1.1.4 主要仪器 PCR扩增仪(C1000TMThermal Cycler);凝胶成像系统(BIORAD ChemiDocTMMP)和脉冲场凝胶电泳系统(BIORAD CHEF MAPPERTM);二氧化碳恒温培养箱(Forma SeriesⅡWater Jacketed CO2Incubator)。
1.2 方 法
1.2.1 DNA模板制备 将已分离鉴定的弯曲菌接种于哥伦比亚血琼脂上,24 h后挑取纯培养物接种于Bolton肉汤中,85%N2、10%CO2和5%O2微需氧条件下,42℃恒温培养48 h。振荡混匀菌液后取1 mL菌液于1.5 mL无菌离心管中,12 000 r/min离心3 min,弃上清液。加入1 mL无菌dd H2O,12 000 r/min离心1 min,弃上清液,重复洗涤3次。取80μL无菌TE buffer(p H=8.0)加入弯曲菌沉淀中,随后进行沸水浴10 min,再迅速冰浴5 min,12 000 r/min离心3 min,取上清液,移至1.5 mL无菌离心管中,即为PCR模板,置于-20℃备用。
1.2.2 毒力基因检测 根据文献报道合成9对毒力基因的PCR特异性引物,其序列、目的基因片段大小和退火温度见表1。PCR扩增体系包括Taq Premix 12μL、DNA模板1μL、毒力基因上下游引物各1μL,补充无菌dd H2O 10μL至25μL。9种毒力基因扩增条件如下:95℃预变性1 min,95℃变性30 s,退火1 min(退火温度见表1),72℃延伸1 min,从变性至延伸阶段循环35次,最后一轮结束后72℃延伸5 min,4℃保存。
PCR扩增结束后,取5μL PCR产物,于2%琼脂糖凝胶电泳,电压120 V、电泳时间20 min。随后取出凝胶置于凝胶成像系统拍照后分析结果。
1.2.3 弯曲菌PFGE分型 参照美国Pulse Net PFGE标准[11],对弯曲菌进行PFGE分型与分析。使用AgaroseⅢTM琼脂糖制胶后进行酶切,弯曲菌为限制性内切酶SmaⅠ酶切,沙门氏菌H9812使用限制性内切酶XbaⅠ。电泳参数为:分离片段范围50~400 Kbp;起始转换时间6.76 s;终止转换时间38.35 s;斜度6 V/cm;转角120°;电泳时间18 h。1×GelredTM溶液泡染胶块30 min后使用凝胶成像仪拍照,图像保存为“.TIF”格式。采用Dice和UPGMA 在 Applied Math Bionumerics(Version 3.0)指纹图谱分析软件中对电泳条带进行图像处理和数据分析,建立聚类分析图。酶切基因谱相似系数大于85%的菌株视为同一谱型。
2 结 果
2.1 毒力基因检测结果 空肠弯曲菌fla A、cad F、cdt B、cdtC、iam A和cheY毒力基因携带率均高于90%,且cad F、iam A和cheY阳性率为100%;fla A、cdtB和cdtC分别为97.1%、94.3%和94.3%。此外,cia B毒力基因携带率虽然偏低,但也达到80%;而virB11和cdt A毒力基因检出率较低,仅为2.9%和25.7%。结肠弯曲菌毒力基因总携带率较空肠弯曲菌低,只有cad F检出率为100%。cdt A、cdtB、iam A和cheY携带率分别为54.5%、72.7%、66.7%和84.8%;而fla A、cdtC、cia B携带率和空肠弯曲菌携带率相比差异较大,分别为48.5%、36.4%和18.2%。值得注意的是,两种菌virB11基因检出率均最低,但结肠弯曲菌携带率较空肠弯曲菌高,为18.2%。

表1 弯曲菌9种毒力基因引物名称、序列及扩增产物大小Tab.1 Virulence gene primer names,sequences and amplification products of Campylobacter spp.
2.2 毒力基因谱结果 空肠弯曲菌分离株共检测出8个谱型,其毒力基因携带率差异性较小(表2);而33株结肠弯曲菌含有26个谱型,毒力基因携带率差异性较大(表3)。同时携带6种及以上毒力基因的弯曲菌占67.6%,其中空肠弯曲菌占比48.5%(33株)、结肠弯曲菌占比19.1%(13株)。空肠弯曲菌优势毒力基因谱为fla A-cad F-cdtB-cheY-iam A-cia B-cdtC(45.7%);结肠弯曲菌优势毒力基因谱为cad F-cdt A-cdtB-cheY(9.1%),且为本次研究中结肠弯曲菌特有的毒力基因谱型。

表2 空肠弯曲菌分离株毒力基因谱及其所占比例Tab.2 Virulence gene profiles of Campylobacter jejuni isolates and their proportion

表3 结肠弯曲菌分离株毒力基因谱及其所占比例Tab.3 Virulence gene profiles of Campylobacter coli isolates and their proportion
2.3 PFGE分型结果 根据Tenover聚类分析原则,若菌株间PFGE谱型相似度高于50%,则具有流行病学相关性[12]。因此本次研究中空肠弯曲菌可分为5大类(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ)、结肠弯曲菌可分3大类(Ⅰ、Ⅱ、Ⅲ)。参照美国PluseNet方法[11],对包括35株空肠弯曲菌和33株结肠弯曲菌进行PFGE分型和追溯。结果表明,同一个PFGE谱型含有不同屠宰环节的分离株,如谱型G中,菌株CJ24、CJ3、CJ14、CJ35来源于屠宰链各环节,表明空肠弯曲菌于该屠宰场中存在上游环节至下游环节传播的现象。见图1。溯源性分析结果显示某些相同来源的菌株存在不同的谱型,如谱型E和谱型G中的菌株CJ18和菌株CJ24,说明在同一个屠宰环节存在弯曲菌交叉污染的现象。从菌株分离时间进行分析,该屠宰场一直存在某空肠弯曲菌的克隆株,如谱型J中菌株CJ2、CJ30、CJ31来源于不同分离时间,但菌株CJ30、CJ31毒力基因谱型却完全一致,表明该空肠弯曲菌可通过水平和垂直传播感染不同批次的肉鸭,随后在屠宰链中被分离出。也可能是工作人员等外源性感染导致。
33株结肠弯曲菌可分为11个PFGE谱型,优势谱型为A,存在7个仅包含一株菌的独特谱型。屠宰前26株结肠弯曲菌共有11个谱型,分布于各个谱型;脱毛环节拥有2个谱型,包含3株结肠弯曲菌分离株,均被分为流行病学相关性Ⅰ类别中;掏膛环节具有2个谱型,共包含3株分离株,也在流行病学相关性类别Ⅰ中。该结果显示肉鸭盲肠粪样中结肠弯曲菌分离株来源广泛,推测可能存在二次污染的情况(图2)。
3 讨 论
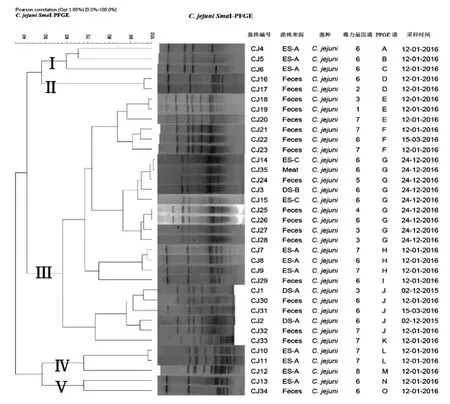
图1 35株空肠弯曲菌PFGE聚类分析结果Fig.1 PFGE cluster analysis of 35 strains of Campylobacter jejuni

图2 33株结肠弯曲菌PFGE聚类分析结果Fig.2 PFGE cluster analysis of 33 strains of Campylobacter coli
弯曲菌自1963年发现以来,其在人类体内具体的致病因素和机理仍然不明确。迄今为止,界内已经认同的致病机理之一是弯曲菌利用鞭毛侵入人体肠上皮细胞间,在其毒力基因表达产生的毒力因子作用下入侵至宿主体内进行繁殖发育从而引起疾病[13]。本次研究结果显示不同来源的弯曲菌均携带不同的毒力基因,且具有高阳性率,说明这些毒力基因广泛存在于弯曲菌中。除virB11和cdt A毒力基因外,空肠弯曲菌其余7种毒力基因阳性率普遍较高,与 Datta S[14]、Andrzejewska M[15]等研究结果一致。目前大部分报道中弯曲菌病主要由空肠弯曲菌引起,可能与空肠弯曲菌毒力基因携带率偏高有关。如果食用了被空肠弯曲菌污染的食品或者未完全加工成熟的禽肉,空肠弯曲菌感染的风险将会大大增加。因此,为了防止弯曲菌通过食物链将毒力传递给人类,在生产过程中应该防止弯曲菌污染,减少人类食用未加工成熟肉制品的机会,并且加强对弯曲菌污染程度及其毒力基因的监测,保障人类健康。
为探究该肉鸭屠宰场中弯曲菌分离株之间的基因相关性,利用SmaⅠ对68株鸭源弯曲菌分离株酶切并进行PFGE分型。结果表明,同一个PFGE谱型包含不同来源的弯曲菌,表明该肉鸭屠宰场上下游环节有弯曲菌传播的趋势,且具有弯曲菌的交叉污染。此情况不仅存在于肉鸭屠宰场,鸡、猪等加工屠宰场均存在弯曲菌上下游传播以及交叉污染现象[16-17]。另外,不同时期屠宰的肉鸭屠宰链分离株出现同一种谱型,说明它们可能来源于肉鸭养殖场或者肉鸭屠宰场中的同一克隆系,且长期存在于肉鸭生长养殖环境或者屠宰场环境、设备中,随着机械或者人员进行水平传播。也可能是外源性污染,如运输车辆、屠宰链中工作人员、屠宰链中机械设备等携带有弯曲菌,通过屠宰加工而污染屠宰场或者养殖厂环境,从而被检测出。Takahashi R等[17]在养殖至屠宰加工的过程中跟踪研究了6个肉鸡场的弯曲菌流行情况,结果表明屠宰加工后鸡翅表面分离的弯曲菌主要来源于养殖厂;Peyrat M B等[18]研究发现,屠宰场经过适当的清洗消毒后,加工设备表面仍然可分离到弯曲菌,且存在污染屠宰胴体的可能性;Francesca等[19]发现,在意大利超市已上架的禽肉仍然存在较严重的弯曲菌污染,细菌分离率达61.6%,其中弯曲菌分离率为58.1%。
本研究结果还表明,弯曲菌的毒力基因表型与PFGE基因型之间存在一定的相关性,即毒力基因谱相似的菌株其PFGE型亦较为相似,例如CJ4、CJ5和CJ6号菌株具有同一种毒力基因谱型,PFGE分型也同属于Ⅰ型。然而国外学者Wieczorek等[20]的研究结果未发现弯曲菌的毒力基因表型与PFGE基因型之间有关联。本文中仅对有限数量的弯曲菌的毒力基因型与PFGE基因型进行了分析,因为样本量较少,不足以证明两者之间的具体联系,对于它们之间具体的关联性还需要进一步的研究。
综上所述,该肉鸭屠宰场存在交叉污染且存在的空肠弯曲菌对于9种主要毒力基因的携带率较高,为防止交叉污染和控制弯曲菌的传播,可加强屠宰场卫生监督管理以及严格执行杀菌消毒措施,以降低加工处理中弯曲菌污染概率,从而减少弯曲菌感染的风险,确保公共卫生安全。
利益冲突:无
引用本文格式:李佳康,黄雪琳,曾杭,等.成都地区肉鸭屠宰链弯曲菌毒力基因分布及分子分型研究[J].中国人兽共患病学报,2019,35(9):815-820.DOI:10.3969/j.issn.1002-2694.2019.00.115
