MicroRNA-613靶向调控 FRS2抑制肾母细胞瘤发生发展
2019-10-12杨以恒藏平张伟同
杨以恒 藏平 张伟同
(1.菏泽市立医院小儿外科,山东 菏泽 274000;2.湖南省儿童医院儿科,湖南 长沙 410000)
肾母细胞瘤也称为肾胚胎肿瘤,是一种混合胚胎肿瘤[1]。肾母细胞瘤是儿童中最常见的恶性肿瘤。在儿科疾病手术中占绝大多数,约占儿童所有实体瘤的8%[2]。肾母细胞瘤发病率约为百万之二,发病年龄为1~3岁,发病高峰为3岁[2]。手术、化疗和放疗的联合疗法大大改善了肾母细胞瘤患者的预后[3]。然而,这些方法有可能引起严重的不良反应。microRNA是长度约为18~25个核苷酸的内源RNA,miRNA可以与其靶基因的3’UTR结合以抑制蛋白质翻译[4]。越来越多的研究发现miRNA可以在多种细胞过程中发挥重要作用[5]。因此,对相关miRNA的透彻研究可能有助于解释肿瘤的发生和发展。本研究旨在探讨肾母细胞瘤组织中miR-613表达水平及其抑制肾母细胞瘤细胞增殖的作用机制。
1 材料与方法
1.1实验样本收集 选择本院2015年10月至2018年7月手术切除的肾母细胞瘤体及癌旁非肿瘤肾脏组织(距离病灶至少2 cm)各64例。所有受试者术前均未行放疗和化疗。患者及家属知情,且签署同意书,本研究所有实验方案及内容获得医院伦理委员会批准。
1.2实验材料和仪器
1.2.1实验材料 人肾母细胞瘤细胞系(SK-NEP-1和G401)(中国科学院上海生命科学学院细胞库);miR-613模拟物(mimics)和对照mimics negative control(miR-NC)(广州市锐博生物科技有限公司);胰蛋白酶、DMEM 培养基和胎牛血清(Gibco公司);Interferin 转染试剂、MTT试剂盒和Taqman microRNA assay Real-time PCR试剂盒(美国Sigma公司);兔抗GAPDH和FRS2多克隆抗体(美国Cell Signaling Technology公司);Lipofectamine3000 和Trizol试剂盒(美国Invitrogen公司);AnnexinV-FITC/PI细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司)。
1.2.2实验仪器 超净工作台和CO2细胞培养箱(美国Thermo Scientific公司);流式细胞仪(美国BD公司);电泳仪和凝胶成像系统(上海天能科技有限公司);Real-time PCR仪(Roche公司)。
1.3肾母细胞瘤细胞培养和miR-613模拟物转染
1.3.1细胞培养 按照9(DMEM培养基)∶1[胎牛血清(FBS)]配置培养基,用其培养人肾母细胞瘤系SK-NEP-1和G401细胞株,置于CO2恒温培养箱孵育,每隔1~2 d换培养液。细胞达到80%~85%汇合,用胰蛋白酶消化,进行传代培养,并保存生长状态好的细胞株用于实验。
1.3.2细胞转染 将对数生长期的细胞分为空白组、miR-NC组和miR-613 mimics组;采用Lipofectamine2000转染试剂转染miR-NC和miR-613 mimics分别至miR-NC组和miR-613 mimics组,空白组不加任何转染质粒。选取SK-NEP-1和G401 2株人肾母细胞瘤株,所有操作均按照试剂盒说明书进行。(1)配置试剂:将miR-NC和miR-613 mimics样品离心,用焦碳酸二乙酯(diethy pyrocarbonate,DEPC)水稀释成20 μmol/L母液,置于-20 ℃备用;取适量无血清Opti-MEMI培养基稀释miR-NC或miR-613 mimics母液(A液)和 Lipofectamine2000(B液),轻轻混匀;将A液和B液混合(C液),室温放置20~30 min。(2)培养细胞:在6孔板上种植细胞,每孔2 mL培养液,等细胞汇合度达80%时,开始实验。(3)转染:将C液加入6孔板孵育6h后,换成含10%FBS的DMEM 培养基,置于CO2恒温培养箱孵育。
1.4q-PCR检测 Real-time PCR检测组织和肾母细胞瘤细胞株中miR-613的表达用Trizol试剂盒提取癌旁组织、肾母细胞瘤组织和肾母细胞瘤细胞株中总RNA;采用 Taqman microRNA assay Real-time PCR试剂盒和Real-time PCR仪进行分析。实验重复3~5次,细胞实验中设置8个复孔。组织和细胞中 miR-613表达水平采用2-ΔΔCt法计算。引物序列见表1。

表1 qPCR引物序列
1.5MTT检测过表达 miR-613 对肾母细胞瘤细胞系增殖的影响 实验分为空白组、miR-NC 组和miR-613 mimics 组,每组设8个平行复孔。96孔板200 μL肾母细胞瘤细胞转染48 h后,加入20 μL 5 g/L 的MTT,避光孵育3 h;再去上清,加入150 μL DMSO 孵育10 min;最后,用酶标仪在570 nm波长下检测吸光度值。实验重复3~5次。
1.6流式细胞仪检测过表达miR-613对肾母细胞瘤细胞凋亡的影响 实验分为空白组、miR-NC组和miR-613 mimics 组,每组设8个平行复孔。将转染48 h肾母细胞瘤细胞收集后,根据Annexin Ⅴ-FITC/PI 细胞凋亡检测试剂盒说明书处理,最后用流式细胞仪检测细胞凋亡并分析数据。实验重复3~5次。
1.7双荧光素酶报告基因检测miR-613对FRS2的靶向调控作用 将G401细胞接种于6孔板中,待细胞密度达到50%~60%即可用于转染。试验分为4组,每组设个复孔:(1)miR-NC+FRS2WT;(2)miR-613+FRS2WT;(3)miR-NC+FRS2 MT;(4)miR-613+FRS2 MT。细胞接种12 h后更换培养基,48 h后,根据双荧光素酶报告基因检测试剂盒说明书上机检测各组荧光素酶的活性。
1.8Western blotting 检测miR-613对 G401细胞中FRS2蛋白表达的影响 收集各组细胞,加入裂解液提取胞内总蛋白。先用二喹啉甲酸(bicinchoninic acid,BCA)法检测每组蛋白浓度,再使蛋白变性后,每个样品取40~50 μg蛋白经12%SDS-PAGE分离,转移到PVDC膜,室温封闭1~2 h;加入兔抗FRS2多克隆抗体(1∶2 000)和兔抗GAPDH多克隆抗体(1∶25 000),室温孵育2 h;洗膜后,加入二抗,HRP标记的山羊抗兔 IgG(H + L)(1∶1 000)孵育1~2 h;最后用ECL显影法,进行曝光。
2 结 果
2.1miR-613的相对表达量 Real-time PCR检测结果显示,肾母细胞瘤组织中miR-613表达量明显低于癌旁组织[(0.46±0.18)VS(1.10±0.06)],比较差异有统计学意义(t=22.65,P<0.05)。见图1。
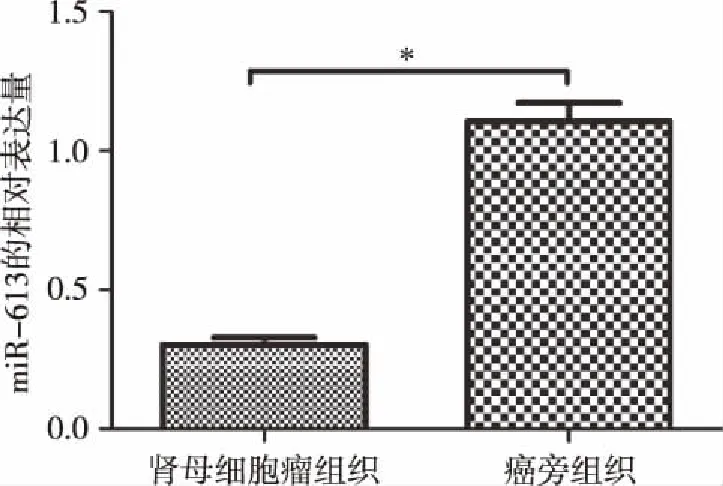
图1 肾母细胞瘤组织和癌旁组织中miR-613的相对表达量
2.2miR-613表达与肾母细胞瘤患者病理特征的关系 综合64例肾母细胞瘤患儿的临床病理资料,方差分析检验不同年龄、性别、肿块大小、淋巴结转移及病理学分型的miR-613的表达水平均无统计学差异,但miR-613表达水平与临床分期有相关性,临床Ⅰ~Ⅱ期患儿的肿瘤标本中miR-613表达水平高于临床Ⅲ~Ⅳ期的患儿,差异具有统计学意义(P<0.05)。见表2。
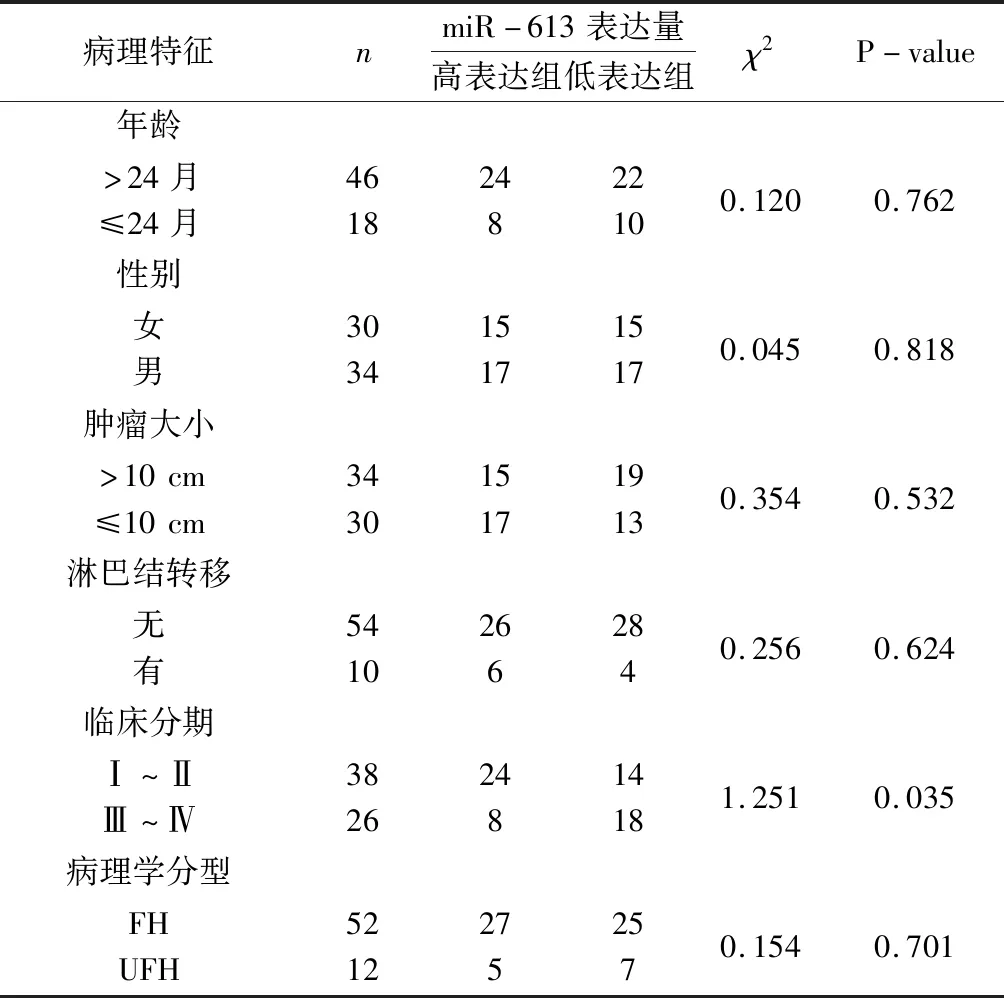
表2 肾母细胞瘤组织miR-613表达与临床病理特征的相关性
2.3肾母细胞瘤细胞系中miR-613过表达 在肾母细胞瘤细胞系(SK-NEP-1和G401)中瞬时转染 miR-613 mimics,建立过表达 miR-613肾母细胞瘤细胞系。转染24 h,用Real-time PCR检测miR-613表达。空白组 miR-613表达量设为1,在SK-NEP-1细胞系中,miR-NC 组为(0.94 ±0.15),miR-613 mimics 组为(6.17 ±0.36);在G401细胞系中,miR-NC组为(0.97±0.07),miR-613 mimics组为(6.08±0.72);两组肾母细胞瘤细胞系中,空白组和miR-NC组中miR-613表达差异均无显著性(P>0.05),miR-613 mimics 组中miR-613表达明显高于空白组和miR-NC组,差异有统计学意义(P<0.05)。见图2。
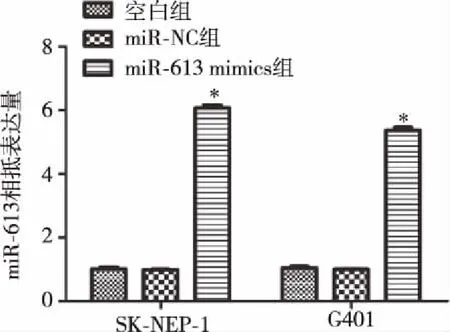
图2 两种肾母细胞瘤细胞系中miR-613表达水平
2.4过表达miR-613对SK-NEP-1和G401细胞增殖的影响 分别在培养0,24,48,72 h用MTT法检测过表达miR-613对SK-NEP-1和G401细胞增殖水平的影响。结果显示,miR-613 mimics 组细胞活力显著低于空白组和miR-NC组,差异有统计学意义(P<0.05),见图3。
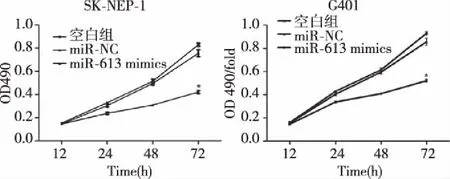
图3 过表达 miR-613抑制肾母细胞瘤细胞增殖
2.5过表达 miR-613对SK-NEP-1和G401细胞凋亡情况的影响 分别在培养0,24,48,72 h用用流式细胞仪检测过表达miR-613对SK-NEP-1和G401细胞凋亡情况的影响。结果显示,miR-613 mimics 组细胞凋亡率显著高于空白组和miR-NC组,差异有统计学意义(P<0.05)。见图4。

图4 过表达 miR-613对肾母细胞瘤细胞凋亡情况的影响
2.6双荧光素酶报告基因检测miR-613对FRS2的靶向调控作用 利用microRNA org软件预测出miR-613与FRS2之间存在良好的碱基互补配对关系(图5),在此基础上构建野生型和突变型的FRS2真核表达载体。双荧光素酶报告基因检测显示共转染miR-613+FRS2 WT的G401细胞荧光活性显著下降,差异有统计学意义(P<0.05),见图6。

图5 miR-613与FRS2 3’UTR存在互补碱基配对的序列
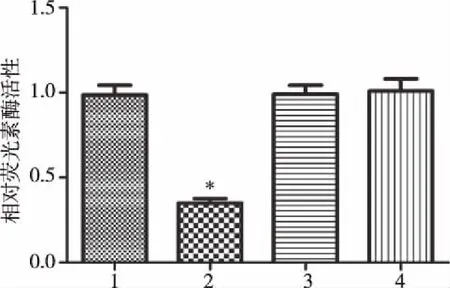
注:1.miR-NC+FRS2WT;2.miR-613+FRS2WT;3.miR-NC+FRS2;4.miR-613+FRS2 MT。
图6各组G401细胞中荧光素酶活性的比较
2.7过表达miR-613对G401细胞中FRS2 mRNA表达量的影响 用q-PCR检测G401细胞中FRS2 mRNA表达情况。转染72h后,miR-613 mimics组细胞FRS2 mRNA表达量显著低于miR-NC组,差异有统计学意义(P<0.05),见图7。
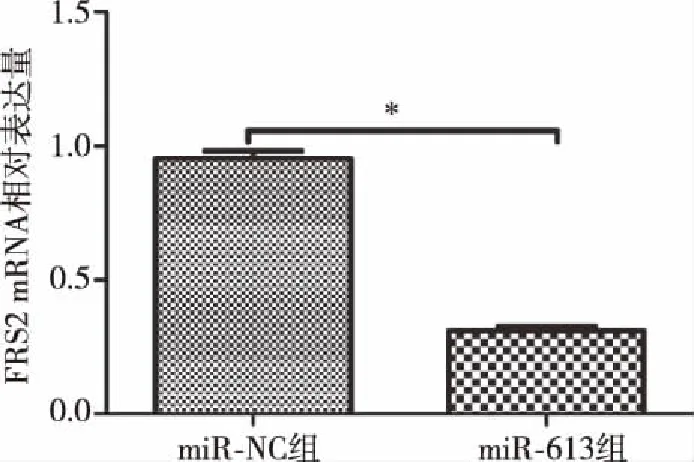
图7 miR-613对G401细胞中FRS2 mRNA表达量的影响
2.8过表达miR-613对G401细胞FRS2蛋白表达量的影响 用Western blotting检测G401细胞中FRS2表达情况。转染72h后,miR-613 mimics组细胞FRS2蛋白表达量显著低于miR-NC组,差异有统计学意义(P<0.05),见图8。

图8 miR-613对G401细胞中FRS2 蛋白表达量的影响
3 讨 论
目前肾母细胞瘤假说主要包括“双击模型理论”和“肾源性休息理论”[6-7],但这些假说解释肿瘤的发病机制都有各自局限性。近年来,由于分子生物学的迅速发展,越来越多的研究表明,miRNA在各种肿瘤的进展中起着至关重要的作用。例如,F.Karimi Dermani等[8]发现白藜芦醇可通过上调大肠癌中miR-200c来抑制细胞凋亡、抑制侵袭,并从EMT转变为MET表型。Shen等[9]的研究表明在人乳腺癌中miR-660-5p通过靶向调控TFCP2的表达促进乳腺癌增殖,为乳腺癌提供及极有前景的治疗策略。X.M.Tian等[10]发现miR-509-5p通过靶向MDM2抑制前列腺癌的细胞增殖和转移。Y.Du等[11]报道miR-543通过靶向RKIP促进前列腺癌的细胞生长和转移。MiR-613是一种与肿瘤相关的miRNA,在几种类型的癌症中表达下调并起着抗癌基因的作用,如前列腺癌[12]、乳腺癌[13]、骨肉瘤[14]和结肠直肠癌[15]等。然而,miR-613在肾母细胞瘤的发生和发展中的作用和机制尚不清楚。
在本研究中,我们证实miR-613在Wilms的肿瘤组织中与邻近的正常组织相比表达下调,这意味着miR-613在肾母细胞瘤的发生和发展中起着潜在的抑癌作用。此外,miR-613的过表达减弱了肾母细胞瘤的增殖能力。进一步通过流式试验证实过表达miR-613可以促进细胞凋亡。总之,这些发现表明miR-613对Wilms肿瘤的细胞增殖具有抑制作用。为了进一步明确miR-613如何抑制Wilms的肿瘤细胞肿瘤增殖的潜在机制,我们通过生物信息学分析预测并选择FRS2(成纤维细胞生长因子2)作为miR-613的新靶标。研究表明FRS2参与乳腺癌[16]和前列腺癌[17]等某些恶性肿瘤的肿瘤发生。FRS2可能主要通过介导前列腺癌中的促有丝分裂FGF信号传导来调节肿瘤发生,并且可以作为激素受体阳性乳腺癌患者的预后生物标志物。FRS2也可以通过肿瘤发生中的miRNA调节,例如胃癌中的miR-206[18]。在本研究中,我们通过双荧光素酶报告基因证实miR-613与FRS2直接结合,且过表达miR-613可以显著抑制FRS2基因的mRNA及蛋白表达,这就表明miR-613可能通过调节FRS2表达进而抑制肾母细胞瘤的增殖。
