眼眶软组织肿瘤455例临床病理观察
2019-10-12任雨洁蔡凤梅杨菁茹李元朋王卉芳
刘 辉,任雨洁,蔡凤梅,杨菁茹,李元朋,王卉芳
0引言
眼眶软组织肿瘤涵盖软组织肿瘤分类中绝大部分病理学类型,其中大多数为良性肿瘤,以脉管肿瘤为主,不乏眼眶部位少见的良性肿瘤,如Erdheim-Chester病(ECD)、砂粒体性骨化性纤维瘤(POF)、血管周细胞性肿瘤和黏液瘤等病理学类型,而眼眶中间型和恶性软组织肿瘤罕见。部分眼眶软组织肿瘤在诊断中存在较大困难,仅靠HE切片诊断时常存在困难,常常需要结合免疫组化甚至分子检测结果。目前国内外大部分文献多为眼眶部位各类型肿瘤综合报道,缺乏专门针对眼眶软组织肿瘤大量病例的病理统计分析。本研究收集我院15a间455例眼眶软组织肿瘤病例,参考WHO软组织肿瘤分类第4版(2013年)分类标准,并参照刘彤华教授《诊断病理学》软组织相关章节,对其进行病理学分类,对少见的病理学类型病例进行免疫组织化学染色,结合分子检测,分析其病理学特征,为临床和病理诊断提供更多关于眼眶软组织肿瘤的资料参考。
1对象和方法
1.1对象收集我院2003-11/2018-11确诊的眼眶软组织肿瘤病例455例,经我院伦理委员会及患者家属同意,其中男240例(52.7%),女215例(47.3%),左眼252例(55.4%)、右眼203例(44.6%),患者年龄5~87(平均42)岁。
1.2方法所有标本用10%中性福尔马林固定液固定,石蜡包埋,4μm厚切片,HE染色,光镜观察,由经验丰富的两位病理科医师阅片分类,并对部分病例[包含25例孤立性纤维性肿瘤(solitary fibrous tumor,SFT)、33例外周神经肿瘤、11例所谓纤维组织细胞瘤、2例髓系肉瘤(myeloid sarcoma,MS)、1例恶性黏液样脂肪肉瘤(myxoid liposarcoma,MLS)和1例未分化肉瘤)]进行免疫组织化学与染色(EnVision法),所用一抗和EnVision试剂盒均购自福州迈新公司。3例罕见病例[包含1例眼眶外周原始神经外胚叶肿瘤(PNET)、1例恶性MLS和1例白血病性MS)]送至上级医院进行分子检测。观察其临床特点、病理分类和少见肿瘤的病理学特征。
2结果
按照病理学类型455例眼眶软组织肿瘤分类为:眼眶脉管肿瘤340例,均为良性,最常见为海绵状血管瘤258例,占眼眶脉管肿瘤75.9%,占眼眶软组织肿瘤56.7%,男153例(59.3%),女105例(40.7%),年龄17~86(平均45)岁,左眼141例(54.7%),右眼117例(45.3%),其中眼眶骨的海绵状血管瘤3例,其余均发生于眼睑、结膜等眼眶软组织;其次为毛细血管瘤58例,占眼眶脉管肿瘤17.1%,占眼眶软组织肿瘤12.7%,年龄5~42(平均22)岁;混合型血管瘤7例,淋巴管血管瘤6例,淋巴管瘤5例,静脉型血管瘤4例,上皮样血管瘤2例。
眼眶纤维母细胞/肌纤维母细胞性肿瘤42例,其中良性17例,包括纤维瘤15例,砂粒体性骨化性纤维瘤(psammomatoid ossifying fibroma,POF)2例(图1);中间型23例,均为眼眶孤立性纤维性肿瘤(solitary fibrous tumor,SFT),包含此前诊断为眼眶血管外皮瘤(hemangiopericytoma,HPC)3例、眼眶巨细胞血管纤维瘤(giant cell angiofibroma,GCA)1例;恶性SFT者2例。本组眼眶部位SFT肿瘤直径0.4~7cm,中间型23例,其中12例镜下具有典型SFT特征:肿瘤细胞密集区和稀疏区交替分布,其间可见石棉样胶原纤维带和鹿角状的薄壁分支血管(图2),细胞呈血管外皮瘤样排列方式,1例可见多核巨细胞(图3),此前诊断为GCA,其余10例仅仅表现为血管外皮瘤样或无规律式梭形肿瘤细胞弥漫排列,2例恶性SFT均为复发病例,镜下肿瘤细胞丰富,可见核异型性,核分裂象>4/10 HPF,浸润眼眶周围骨膜和软组织,其中1例侵及鼻窦和骨组织,并可见肿瘤性坏死。25例SFT免疫组织化学结果示:STAT6的阳性表达率为100%(图4),表现为弥漫强阳性的核表达,CD34、CD99、Vimentin和Bcl-2的阳性表达率分别为78.3%、70%、82.6%和65.2%。

图1 眼眶POF:梭形细胞间可见大量砂粒体(HE×100)。

图2 眼眶SFT:肿瘤细胞间可见鹿角状血管(HE×100)。

图3 眼眶SFT巨细胞亚型,肿瘤组织内可见大量多核巨细胞(HE×100)。

图4 SFT中STAT6弥漫阳性表达(IHC×100)。
眼眶外周神经肿瘤33例,其中神经纤维瘤18例(含低度恶性黏液性神经纤维瘤2例,丛状神经纤维瘤1例),神经鞘瘤14例(含1例混杂性神经鞘瘤)和眼眶PNET者1例。1例罕见眼眶PNET患者男性,63岁,送检左眼眶肿瘤镜下示:肿瘤细胞短梭形或卵圆形,片状分布,较多的血管分隔,肿瘤细胞染色质细,局部可见胶质样物质(图5)。免疫组织化学结果:CD99(核小点状+),NSE部分细胞(+),CD34(+)、Vimentin(+),CD56部分细胞弱(+),Ki67约5%,Actin、CKL、Desmin、SMA、Myoglobin、CgA、Syn、CEA、EMA、Pan-mel、S100、HMB45、AE1/AE3、CAM5.2、CK20、oligo-2等均阴性。外院分子检测结果:荧光原位杂交EWSR1未查见断裂,仅查见EWSR1基因多拷贝,病理特征不明显,经会诊诊断为眼眶特殊的PNET。
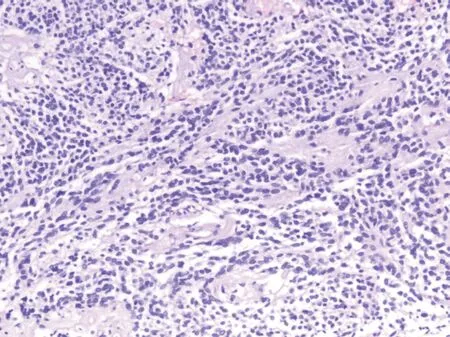
图5 眼眶PNET:肿瘤细胞弥漫分布,其间可见胶样物质(HE×100)。

图6 眼眶ECD:泡沫样非朗格汉斯组织细胞弥漫分布,并可见淋巴细胞、浆细胞及增生纤维组织(HE×100)。
眼眶所谓纤维组织细胞肿瘤11例,其中纤维组织细胞瘤10例(包含2例低度恶性纤维组织细胞瘤),罕见Erdheim-Chester病(Erdheim-Chester diease,ECD)1例。眼眶ECD患者,男,55岁,以双眼反复肿胀,突出伴流泪1a入院,双侧眼睑反复肿胀,眼球显著突出,眶压+++,活动受限;CT显示双侧眼眶球后多发性占位,X线显示双侧股骨中下段和胫腓骨全段骨髓质异常,胸部和腹部CT显示心影增大、心包和胸膜腔积液、双肾积水、肾周和腹膜后渗出;眼眶病变组织镜下见增生的纤维组织间大量泡沫状或胞浆嗜酸性的组织细胞(图6),并可见多核巨细胞、淋巴细胞、浆细胞和少量嗜酸性粒细胞;免疫组织化学CD68阳性,CD1α阴性;分子检测出BRAF V600E基因突变,本例ECD以眼眶累及为主要表现,累及多个器官组织,进展快,治疗反应不明显。

图7 眼眶MLS:梭形肿瘤细胞弥漫分布于黏液样背景中(HE×100)。

图8 眼眶MS:肿瘤细胞弥漫分布,细胞核空泡状(HE×200)。
眼眶脂肪细胞性肿瘤15例,其中良性14例,包括脂肪瘤13例,血管脂肪瘤1例;MLS 1例,男,44岁,眼眶CT示左眼眶颞上占位。镜下见成片星形或梭形肿瘤细胞网状排列,细胞核小,卵圆形,核仁不明显,无明显异型性,核分裂像无,并可见脂肪母细胞和细胞质内小空泡,黏液样基质背景,嗜伊红或嗜碱性,可见出血灶和丰富分枝状薄壁血管,仅有一层内皮细胞(图7)。免疫组织化学结果:CD34、Vimentin阳性,ki67(5%),S100、AE1/AE3、Desmin、D99、SMA、HMB45、GFAP、ENSE、CMA、PR、CD68及黏液PAS+AB均阴性。西京医院分子检测结果:FISH检测到DDIT3基因断裂,同时检测到DDIT3基因扩增或者12号染色体移位。
眼眶MS者2例,均为男性,年龄为9岁和36岁,均以眼球显著突出入院,镜下瘤细胞弥漫分布,形态一致,中等或偏大,细胞质少、淡染,细胞核圆形、卵圆形或不规则(图8),部分细胞核空泡状,核仁明显,核分裂象易见,可见散在分布嗜酸性粒细胞,肿瘤细胞均浸润周围组织;免疫组织化学2例均呈MPO、Lysozyme、CD117、CD34、CD31、CD43等标记阳性,例1患儿骨髓涂片诊断为急性髓系白血病(AML),分子检测出AML1/ETO融合基因,确诊为左眼眶白血病性MS,给予抗AML全身化疗,随访5mo患儿状态良好;例2患者未查见白血病证据,确诊为右眼眶孤立性MS,随访2a,状态良好。
眼眶梭形细胞未分化肉瘤1例,属于未分化/未能分类肿瘤一类,患者女性,65岁,2017-06诊断为“右侧眼眶低度恶性纤维组织细胞瘤”。1a后复发,肿瘤破坏周围组织,侵及上颌窦、鼻下方皮下和鼻下骨窝,镜下肿瘤细胞呈席纹状、缎带样或弥漫无规律排列,核仁圆形、卵圆形或短梭形,核仁明显,病理性核分裂像罕见,胞浆嗜酸性,丰富,细胞界限不清。免疫组织化学:Vimentin(++),ki67<5%、S100(散在个别细胞+),AE1/AE3、CD34、CD117、CD68、ALK、EMA、Desmin、NSE均为阴性。诊断:“右侧眼眶、上颌窦自然开口、鼻下方皮下、鼻下骨窝”梭形细胞未分化肉瘤。
本组病例还包括周细胞性肿瘤、平滑肌瘤、黏液瘤等少见软组织肿瘤病例共11例,具有与其他部位软组织肿瘤相同的典型病理学特征。
3讨论
眼眶软组织肿瘤居于眼眶肿瘤的首位,病理分类繁杂,涵盖软组织肿瘤分类中绝大部分病理学类型,肿瘤形态复杂多样,缺乏典型病理学特征,常常存在较大争议,鉴别诊断困难,极易误诊漏诊。此前国内外文献多为眼眶部位肿瘤的综合病理分类分析,缺乏针对眼眶软组织肿瘤的大量病例统计分析。本研究收集455例眼眶软组织肿瘤患者,对其进行病理学分类并分析部分病例的临床病理学特征,为临床和病理诊断提供更多依据。
脉管肿瘤居于眼眶肿瘤首位,分为海绵状血管瘤、毛细血管瘤、静脉性血管瘤、淋巴管瘤等,其中最常见的为海绵状血管瘤,多发于成年人,毛细血管瘤多见于儿童。本组病例中包含2例上皮样血管瘤,上皮样血管瘤是一种良性血管肿瘤,特征是小的毛细血管型血管增生,血管腔衬覆肥胖的上皮样(组织细胞样)内皮细胞,胞质嗜酸性或嗜双染,核大、染色质疏松,常有中位核仁。病变常为界限清楚的包块,绝大多数病变伴有明显炎症性背景。免疫组化上皮样内皮细胞CD31、CD34阳性,上皮样血管瘤局部复发率达1/3,应局部切除并随访。
眼眶SFT属于胸膜外SFT,是一种少见的间叶性梭形细胞肿瘤,随着免疫组化和分子检测技术的发展,2013年WHO删除HPC的诊断,将GCA归入SFT,一并纳入中间型(偶见转移型)肿瘤。Furusato等[1]收集了41例眼眶SFT,显示此前这些肿瘤曾被诊断为HPC、GCA或纤维组织细胞瘤,因而病例应多于此前报道。典型的SFT一般为境界清楚的结节性肿物,多数良性SFT具有典型组织学形态:肿瘤细胞密集区和稀疏区交替分布,其间可见石棉样胶原纤维带和鹿角状的薄壁分支血管,细胞呈席纹状、束状、血管外皮瘤样或无模式性排列方式。肿瘤细胞呈梭形或卵圆形,胞质少,核染色质均匀,核仁不明显,核分裂象无或少见。恶性SFT肿瘤细胞丰富,可见核异型性,病理学核分裂象≥4/10HPF,并可见肿瘤性坏死和浸润性生长。部分病例缺乏上述典型的病理学特征,常常仅表现为血管外皮瘤样或无模式性生长方式,缺乏典型病理学特征,与眼眶其他梭形细胞肿瘤如眼眶纤维组织细胞瘤、神经鞘瘤和神经纤维瘤等鉴别困难。此前多依靠CD34、CD99、Bcl-2等免疫组化指标进行鉴别诊断,但仍具有一定局限性,如CD34在5%~10%的SFT中不表达,Mosquera等[2]研究发现,在良性区域CD34阳性率较高,而在分化差的区域,CD34阳性率多数下降或缺失;CD99和Bcl-2的表达率均低于70%,且均缺乏特异性。近年来分子水平研究发现在SFT中普遍存在NAB2-STAT6基因融合[3-5],研究证实检测STAT6的表达能够准确体现NAB2-STAT6融合基因的表达,可作为检测SFT的一个具有高度敏感性与特异性的免疫组化指标[6]。Smith等[7]收集88例头颈部SFT,发现眼眶SFT中STAT6的阳性率高达100%,而在其他形态学类似的肿瘤中不表达,STAT6可作为SFT诊断中较为理想的抗体,随着目前临床逐步开展的STAT6检测情况来看,STAT6弥漫强阳性的核表达能够很好地支持SFT的诊断。
MLS是由一致性原始非脂肪性间叶细胞、小型印戒样脂肪母细胞、明显黏液样间质和特征性芽枝状血管构成的恶性肿瘤,包括过去的圆形细胞脂肪肉瘤,约占成人软组织肉瘤的10%,眼眶MLS更为少见。MLS多见于年轻人,有局部复发倾向,约1/3患者发生远处转移。CT常表现为界限较为清楚的团块影,低密度为主,常被忽视漏诊,增强扫描能有助于诊断[7]。显微镜下MLS多呈结节状生长方式,小叶周边细胞丰富。肿瘤由圆形、卵圆形至梭形原始间叶细胞、印戒样脂肪母细胞、分枝状毛细血管网和黏液样间质组成,部分病例中细胞外黏液形成大的黏液湖,周边细胞呈扁平状,形成类似淋巴管瘤或所谓“肺水肿”样结构。肿瘤细胞核分裂罕见,无明显多形性及瘤巨细胞。免疫组化分枝状血管CD34阳性,肿瘤细胞S100、Vimentin阳性,CK、EMA、SMA、NSE等均为阴性。MLS中90%以上的病例中存在FUS/DDIT3基因融合,少数MLS存在EWS/DDIT3融和基因。眼眶部位MLS虽然少见,但不应忽视,活检取材时多在肿瘤边缘充分取材,寻找脂肪分化的证据,防止漏诊。
外周神经肿瘤章节作为2013年WHO软组织肿瘤分类中新增章节,包括神经鞘瘤、神经纤维瘤、混杂性神经鞘肿瘤、异位脑膜瘤和恶性外胚层间叶瘤等。眼眶PNET罕见,病理学多表现为弥漫分布的小圆细胞,胞浆稀少,鉴别诊断困难,常常需要与其他眼眶部位小圆细胞肿瘤如浆细胞瘤、淋巴瘤、滑膜肉瘤和嗅神经母细胞瘤等相鉴别,一般而言PNET多表现为CD99的弥漫膜阳性表达,此外Vimentin、NSE、Syn等标记也为阳性,且常常存在EWS/ETS基因融合。对于眼眶部位的外周神经肿瘤特别需要注意其肿瘤发生部位,需要与来源于颅内的神经系统肿瘤相鉴别,分清是颅内肿瘤侵犯眼眶还是眼眶原发,而在遇到类似PNET这种病理形态学不典型病例时,更应借助于免疫组化和分子检测来明确诊断。
眼眶梭形细胞未分化肉瘤罕见,本组病例仅发现1例,2013版WHO软组织肿瘤分类删除原来的多形性、巨细胞和炎症性恶性纤维组织瘤/未分化多形性肉瘤章节,增加未分化/未能分类肿瘤一新的章节。这类肿瘤属于排他性诊断,部分软组织肉瘤因无明确的分化方向或目前技术水平不能确定肿瘤的分化方向,统称为未分化软组织肉瘤。分为多形性未分化肉瘤、梭形细胞未分化肉瘤、圆细胞未分化肉瘤和上皮样未分化肉瘤,但此诊断不应成为病理诊断的“垃圾箱”,应该充分借助目前各种病理诊断技术,并多取材,特别是肿瘤边缘或交界处,寻找其分化的线索来帮助诊断。
MS曾被称为绿色瘤或粒细胞肉瘤,是一类罕见的由原始粒细胞或未成熟髓系细胞在髓外组织浸润形成的肿瘤。包括孤立性MS和白血病性MS(白血病髓外浸润),成人发病率为2/1000 000,而眼眶受累更为罕见。孤立性MS表现为全身不同部位肿物,临床表现无特异性,缺乏白血病病史,诊断主要依靠组织病理学检查,而肿瘤镜下常常仅表现为原始或幼稚的髓细胞,极易误诊,据报道误诊率可高达47%[8],常被误诊为非霍奇金淋巴瘤、胚胎型横纹肌肉瘤、尤文肉瘤/原始神经外胚叶肿瘤和未分化癌等[9]。白血病性MS为白血病伴发的MS,预后差,生存期短。据统计[10]约2.5%~9.1%的急性粒细胞白血病(acute myeloid leukemia,AML)可出现MS。常见的受累部位包括皮肤、软组织、骨骼等,儿童MS中,最常见受累部位是皮肤和眼眶。镜下MS肿瘤细胞呈片状弥漫分布或列兵样排列,形态较一致,细胞中等或偏大,细胞质少、淡染,细胞核圆形、卵圆形或不规则,部分细胞核呈空泡状,核仁明显,病理性核分裂象易见。肿瘤细胞间可见薄壁小血管穿插其中,并可见散在分布嗜酸性粒细胞。免疫组化中MPO、溶菌酶、CD117、CD99、CD34、CD43、TdT等多为阳性。MS的细胞遗传学和分子检测报道较少,Kaur等[11]研究显示63%的MS伴有细胞遗传学异常,8号染色体和21号染色体易位t(8;21)是髓外浸润最常见的细胞遗传学异常,在分子水平上产生AML-ETO融合基因。眼眶MS特别是孤立性MS,无特异性临床表现,细胞来源极为原始,诊断较困难,易误诊,联合应用免疫组化指标和分子检测,结合临床特征和骨髓涂片能够有效提高MS的确诊率。
ECD是一种罕见的非朗格汉斯细胞组织细胞增生症,迄今为止国内外仅报道500余例,发病年龄多位于40~70岁,男性稍多见[12]。目前认为ECD是一种系统性疾病,其发病机制目前仍未明确,多数学者认为ECD是一种炎性克隆性疾病[13],大多患者存在多脏器多系统受累,常可累及骨骼、中枢神经系统、肾、心血管、肺、内分泌、腹膜后、眼眶、皮肤等,眼眶受累的ECD罕见。眼眶受累ECD患者主要表现为眼睑肿胀、眼球突出、眼眶内软组织肿物、疼痛流泪和视神经水肿等。ECD组织病理学特征表现为泡沫样或胞浆嗜酸性染色的非朗格汉斯组织细胞弥漫或巢状浸润,纤维组织增生,伴有淋巴细胞、浆细胞及少量嗜酸性粒细胞,并常可见Touton巨细胞。免疫组化CD68阳性,CD1α阴性,并可见CD163阳性,S100阴性或弱阳性。ECD进展快、预后差,治疗措施多为经验性。以眼眶症状作为首诊的ECD,往往缺乏特征性的骨骼、神经系统、心血管等系统性临床表现,而以单独的眼眶肿物为临床表现,造成误诊漏诊而耽误病情,特别需要与镜下形态类似的眼眶部位朗格汉斯细胞组织细胞增生症(Langerhans cell histiocytosis,LCH)相鉴别,鉴别点为:(1)ECD多见于中老年人,LCH多见于儿童;(2)LCH中的细胞缺乏脂质,可见核沟;(3)免疫组化ECD中CD1α阴性,LCH中CD1α阳性;(4)电镜下ECD细胞中无Birbeck颗粒,LCH中可见Birbeck颗粒。ECD的诊断需要结合临床表现、影像学检查、病理学特征和分子检测综合分析。
眼眶软组织肿瘤具有一般软组织肿瘤分类复杂、表现多样且鉴别诊断较为困难的特点,也具有其部位的特殊性,特别需要与颅内和鼻腔鼻窦等部位的软组织肿瘤相鉴别,对于病理学形态特征不典型的病理,应借助目前最新的病理检测手段,密切联系临床,综合参考患者临床病史、影像学资料和病理形态做出正确诊断。
