‘南通小方柿’赤霉素不敏感基因DkGAI2的克隆与功能分析
2019-10-12蒋梦婷朱宁龚洪泳侯应军余心怡渠慎春
蒋梦婷,朱宁,龚洪泳,侯应军,余心怡,渠慎春
‘南通小方柿’赤霉素不敏感基因的克隆与功能分析
蒋梦婷,朱宁,龚洪泳,侯应军,余心怡,渠慎春
(南京农业大学园艺学院,南京 210095)
【】对的亚细胞定位及表达特性进行分析,并将转化烟草,分析转基因烟草的生理和形态指标,为的深入研究提供理论基础。以‘南通小方柿’高通量转录组测序结果中标注的为原始序列(未发表),利用RT-PCR,3′RACE和5′ RACE技术从‘南通小方柿’中克隆得到的序列全长。利用生物信息学分析其序列特征,采用实时荧光定量PCR(qRT-PCR)分析在‘大方柿’及‘南通小方柿’5个不同物候期的表达特性以及在‘南通小方柿’不同组织中的表达特性,构建瞬时表达载体pCAMBIA-GFP-1302-,并瞬时侵染烟草分析的亚细胞定位,通过构建植物双元表达载体,利用农杆菌介导法转化烟草,经过GUS染色、RT-PCR对转基因烟草株系进行鉴定;并将野生型和转基因烟草移栽,于第一朵花开放时测定转基因植株的株高、节间长度、叶片长宽比以及GA1和GA4含量。从‘南通小方柿’中克隆得到了1 827 bp的,DkGAI2核苷酸序列与猕猴桃(KF588651.1)、光皮烨(MF149049.1)、砂梨(KX078214.1)、苹果(FJ535245.1)、葡萄(MG738718.1)的相似度达72%-80%,具有DELLA蛋白家族特有的DELLA结构域,属于DELLA蛋白基因家族。编码608个氨基酸,相对分子质量为66.5 kD,理论等电点为5.54,不稳定系数为50.41,无明显疏水区,无跨膜区,无信号肽。序列系统进化分析结果显示,与葡萄亲缘关系最近。qRT-PCR结果显示,在‘南通小方柿’5个不同物候期的表达量都高于‘大方柿’;在‘南通小方柿’不同组织中表现出组织表达特异性,其中,在老叶中表达量最高,其次为茎尖和幼叶,而在幼果中几乎不表达。pCAMBIA-GFP-1302-融合蛋白的绿色荧光信号位于细胞核中,表明编码蛋白位于细胞核。经过GUS染色和RT-PCR检测,共获得5个转烟草株系,转基因烟草叶片GA1含量增加,GA4含量降低,GA1和GA4总含量降低,且转基因烟草植株出现植株矮化、节间缩短、叶片长宽比降低及花期延迟的表型。具有组织表达特异性,定位于细胞核,在‘南通小方柿’5个不同物候期的表达量均高于‘大方柿’。推测可能通过降低GA4的含量进而引起植株矮化。
南通小方柿;;基因克隆;亚细胞定位;组织特异性表达
0 引言
【研究意义】‘南通小方柿’(Linn. cv. Nantongxiaofangshi)作为珍稀矮生型柿品种之一,矮化性状明显,干性弱、树姿开张且没有明显主干,被认为是一种优良的适于矮化密植栽培的柿品种[1]。DELLA蛋白作为植物特有的转录因子,在GA信号转导途径中发挥着重要作用,GA主要通过降解此蛋白来调节植物的生长发育[2]。开展‘南通小方柿’赤霉素不敏感基因的克隆与功能分析,对深入研究功能具有重要意义。【前人研究进展】拟南芥中有5种DELLA蛋白,包括GAI、RGA、RGL1、RGL2和RGL3[3]。Peng等[4]首次在拟南芥中克隆出GA不敏感型基因,并指出具有阻遏生长的作用,而突变体对GA信号不敏感,植株表现出不正常的矮化。研究表明,DELLA蛋白参与了水稻、大麦、小麦、番茄、草莓及油菜的形态建成,包括茎的伸长,幼苗弯钩结构的形成,单个小叶的形成及匍匐茎的形成[5-9]。如油菜中的DS-3可编码一种DELLA蛋白,负向调控油菜茎的伸长[10]。DELLA蛋白的功能还包括:抑制或延迟植物的开花[11]、减缓植物的避阴反应[12]、促进豆科植物与固氮根瘤菌的共生[13]、促进番茄保卫细胞气孔关闭[14]、减缓由年龄引起的叶片衰老[15]、参与抵抗盐胁迫等逆境等重要生命过程[16]、参与抵抗水稻病原体的免疫反应[17]。依据DELLA蛋白N端的保守结构域,现已从其他物种中分离出了多个DELLA蛋白基因,如拟南芥中的和[4,18]、小麦及玉米中的()和()[19]、水稻中的[20]、大麦中的[21]、紫花苜蓿中的[22]、苋菜中的[23]、苹果中的[24]、大岩桐中的[25]等。【本研究切入点】近年来,柿属植物中与赤霉素信号转导途径相关基因的研究较少见,尤其是‘南通小方柿’赤霉素不敏感基因的研究更是少见。【拟解决的关键问题】从‘南通小方柿’中克隆得到全长序列,分析对烟草生长发育的影响,为今后的功能研究提供理论基础。
1 材料与方法
试验于2017年5月至2019年4月在南京农业大学果树生物技术实验室进行。
1.1 材料
1.1.1 植物材料 ‘南通小方柿’和‘大方柿’,以君迁子为砧木的3年生嫁接苗。转基因所使用的烟草K326种子和供瞬时侵染用的本氏烟草()种子均由南京农业大学果树生物技术实验室提供。
1.1.2 各种酶及生化试剂 各种限制性内切酶、rTaq DNA聚合酶、Prime STAR GXL DNA聚合酶、反转录试剂盒、DNA凝胶回收试剂盒和质粒提取试剂盒均购自TaKaRa公司。T4DNA连接酶购自New England Biolabs公司。植物RNA提取试剂盒购自成都福际生物技术有限公司、植物DNA提取试剂盒购自南京天根生物技术有限公司。SMARTerTMRACE cDNA Amplification Kit购于Clontech公司(大连,中国)。
1.1.3 菌株及载体 pMD19-T Vector载体购于大连宝生物科技有限公司,pEASY-Blunt载体购自TransGenBiotech,大肠杆菌菌株DH-5α、农杆菌感受态EHA105均购自上海唯地生物技术有限公司,pCAMBIA1302-GFP、PBI121载体均由南京农业大学果树生物技术实验室提供。
1.2 方法
1.2.1中间片段的克隆 以‘南通小方柿’叶片转录组测序结果中标注的序列为原始序列(未发表),利用NCBI Primer-BLAST在线设计特异引物F和R,产物长度为1 521 bp。引物序列见表1,试验所用引物均由上海捷瑞生物技术有限公司合成。
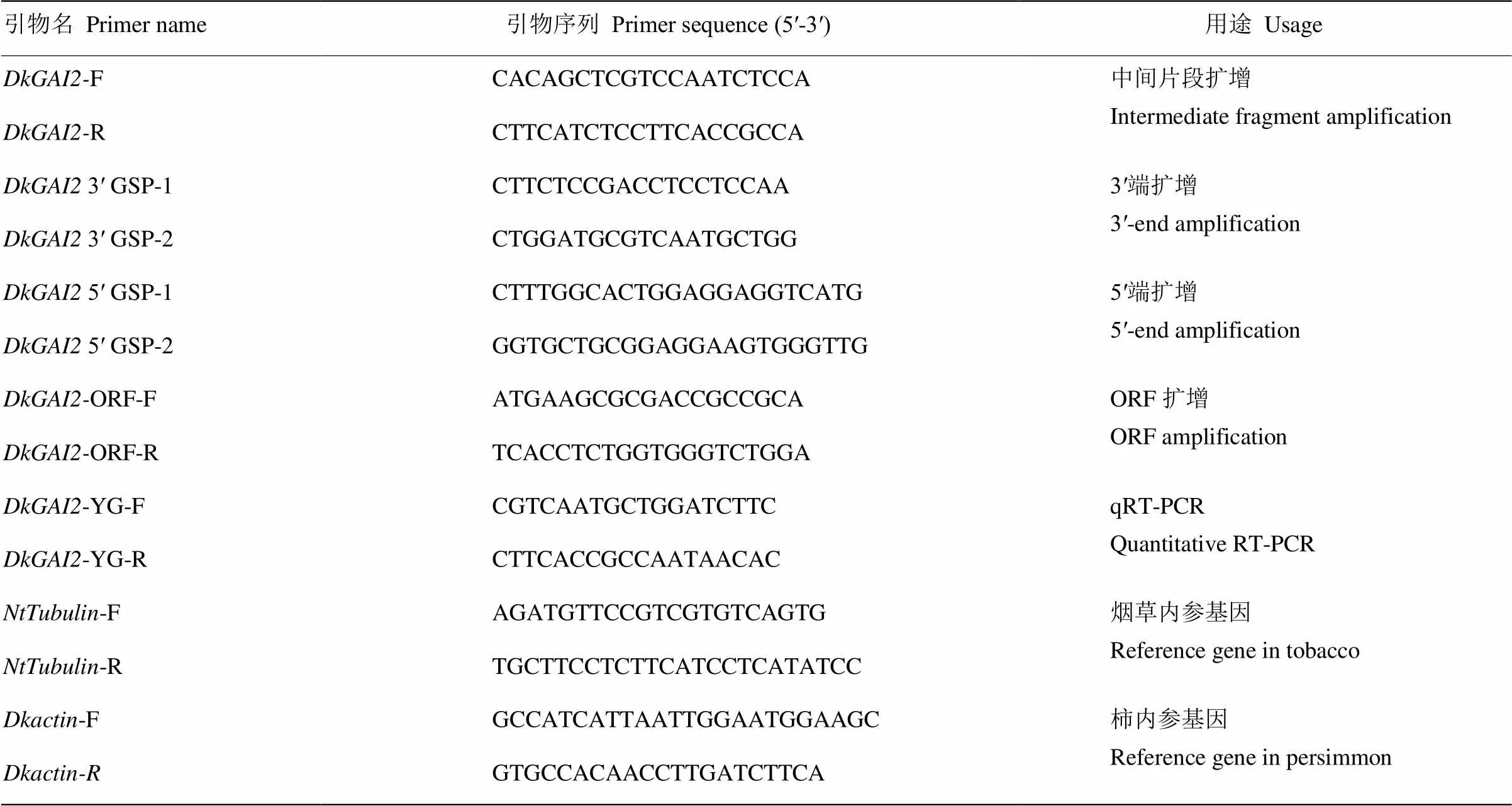
表1 ‘南通小方柿’DkGAI2克隆、表达及功能分析所用引物
以新鲜采取的‘南通小方柿’幼嫩叶片为材料,并按照植物总RNA提取试剂盒说明书上的步骤提取叶片总RNA,浓度仪检测RNA的纯度和浓度,并利用反转录试剂盒反转录为cDNA第一链。
(1)PCR反应体系为:5×GXL Buffer 5 μL,dNTP 2.0 μL,-F 0.5 μL,-R 0.5 μL,模板(cDNA) 1 μL,PrimeSTAR GXL 0.5 μL,用超纯水补足至25 μL。
(2)PCR反应程序为:98℃ 3 min;98℃ 10 s,60℃ 15 s,68℃ 1 min 40 s,35个循环;68℃延伸10 min,4℃保存。
PCR产物用1.5%的琼脂糖凝胶电泳检测,紫外下拍照,切胶并利用胶回收试剂盒进行PCR产物的回收。将回收产物与平末端克隆载体pEASY-Blunt 连接并转化大肠杆菌DH-5α。步骤如下:
①连接:吸取PCR产物4.5 μL,pEASY-Blunt 克隆载体0.5 μL,25℃反应15—20 min。
②转化:取-70℃保存的大肠杆菌DH-5α,冰上融化,至半融化状态时加入连接产物,用枪头轻轻吹打混匀,冰浴30 min,42℃热激90 s,于冰上放置2 min,立即加入700 μL无抗性的液体LB,混匀后于250 r/min、37℃摇床培养1 h。
③涂板:6 000 r/min转速离心1 min,弃去上清液,吸取100 μL左右菌液均匀涂于含50 mg·L-1Km抗性的LB固体培养基上,37℃倒置培养8—12 h。
④阳性克隆检测:挑取白色单菌落,接种在含有50 mg·L-1Km的LB液体培养基中,250 r/min、37℃摇菌培养6—8 h,菌落PCR检测阳性克隆。
⑤测序验证:取PCR检测为阳性的菌液,送南京擎科生物技术公司测序。
1.2.23′端的获得 cDNA的获得同1.2.1,其中反转录时将Ramdom Primer替换为接头引物3′ RACE Adapter(GCGAGCACAGAATTAATACGAC TCACTATAGGT12VN),此外,将反转录反应的温度从37℃调至 42℃,反转录酶的失活温度从85℃调至95℃。以通用外侧引物与特异外侧引物3′ GSP-1进行PCR扩增,扩增体系如下:cDNA 1 µL,5×GXL buffer 5 µL,dNTP 2 µL,上、下游引物各0.5 µL,PrimeSTAR GXL酶0.5 µL,超纯水补足至25 µL。PCR 程序为:98℃ 4 min;98℃ 10 s,60℃ 15 s,68℃ 60 s,35个循环;68℃延伸10 min。将第一轮PCR产物稀释10倍后做模板,以通用内侧引物与特异内侧引物3′ GSP-2进行第二轮扩增,PCR扩增体系和程序同上。产物用1.5%的琼脂糖凝胶电泳检测并回收。将回收产物与pEASY-Blunt克隆载体相连接,转化后取阳性克隆测序验证。连接转化步骤同1.2.1。
1.2.35′端的获得 cDNA的获得参照SMARTerTMRACE cDNA Amplification Kit(Clontech,Cat. Nos.634923 & 634924)。利用通用外侧引物UPM和特异外侧引物5′ GSP-1进行第一轮扩增,反应体系及程序如下:5×GXL buffer 5 µL,dNTP 2 µL,cDNA 1.0 µL,5′ GSP-1 0.5 µL,UPM 1 µL,PrimeSTAR GXL酶0.5 µL,ddH2O补足,终体积25 µL。反应条件为:98℃ 3 min;98℃ 10 s,60℃ 15 s,68℃ 60 s,35个循环;68℃ 7 min。将第一轮PCR产物稀释10倍后做模板,以内侧引物5′ GSP-2与NUP进行第二轮扩增,PCR扩增体系和程序同上。PCR产物用1.5%的琼脂糖凝胶电泳检测并回收,将回收产物与pEASY-Blunt克隆载体相连接,转化后取阳性克隆测序验证。连接转化步骤同1.2.1。
1.2.4序列分析 利用DNAMAN软件及NCBI将测序验证正确的3部分片段进行拼接,查找的ORF(最大开放阅读框),并通过NCBI数据库中的BLAST对其核苷酸序列和推导氨基酸序列进行序列相似性分析;利用protparam(http://web. expasy.org/protparam/)对氨基酸序列的蛋白质分子量和等电点进行分析;利用SignalP(http://www.cbs.dtu. dk/services/SignalP/)在线分析蛋白质的信号肽;利用ProtScale(https://web.expasy.org/cgi-bin/protscale/ protscale.pl)软件预测蛋白质的疏水性;利用TMHMM Server V.2.0在线程序预测蛋白质的跨膜结构域;利用DNAMAN对编码氨基酸序列进行同源性比对,利用MEGA 5.0软件构建系统发育树。
1.2.5的亚细胞定位
1.2.5.1瞬时表达载体的构建 在序列的两端引入I和I酶切位点,提取正确克隆的质粒。与pCAMBIA-GFP-1302质粒同时用I和I进行双酶切,酶切体系(20 µL)为载体质粒10 µL、I 1 µL、I 1 µL、BSA缓冲液2 µL、10×K Buffer 2 µL、ddH2O 4 µL。分别回收载体片段和目的基因片段,用T4DNA连接酶连接,将连接产物转化DH-5α,PCR检测阳性克隆,送公司测序,提取正确克隆的质粒。从而得到pCAMBIA-GFP-1302-瞬时表达载体。
1.2.5.2 瞬时侵染本氏烟草叶片 转化农杆菌:取保存于-70℃的农杆菌感受态EHA105,掌心融化,处于半融化状态后置于冰上,待其完全融化后,吸取1 µL pCAMBIA-GFP-1302/质粒于EHA105感受态中,冰浴5 min、液氮5 min、37℃水浴5 min、冰浴5 min,立即于超净工作台中加入700 µL不含激素的LB液体培养基,28℃、200 r/min培养2—3 h,6 000 r/min离心1 min收集菌液,弃上清,吸取100 µL左右的菌液均匀涂布于含50 mg∙L-1Km和25 mg∙L-1Rif的LB固体平板上,28℃倒置培养48—72 h。重悬浮液的配制:10 mmol∙L-1MgCl2和10 mmol∙L-1乙磺酸(EMS),两种药品单独溶解后混合,高压灭菌处理后,于超净工作台中冷凉后加入100 µmol∙L-1的AS(乙酰丁香酮),密封好待用。菌液活化:吸取1 mL小摇阳性菌液(含EHA105重组质粒)于50 mL含50 mg∙L-1Km的LB液体培养基中,28℃、200 r/min培养至OD600值约为0.5时,5 000 r/min转速离心10 min,于超净工作台弃去上清液,加入不含激素的LB液体冲洗菌块,尽量洗去菌体上的激素,5 000 r/min离心10 min后收集菌块,并加入同等体积的重悬浮液,密封后于28℃、200 r/min培养2 h,室温静置2 h后侵染本氏烟草。注射:选取培养2—4周龄的本氏烟草植株,每株选2—3片叶,注射前浇足水分,于两叶脉之间注射。叶片下表片事先用针尖头轻戳一孔,将注射器口对准所戳小孔,并将注射过的叶片做好标记,注射后,叶片会出现湿润的现象,注射完毕后立即放入培养箱中黑暗培养16 h,后正常光照,约3 d后,于激光共聚焦显微镜下观察表达情况。
1.2.6 实时荧光定量PCR 分别于展叶期(2018年4月20日)、枯顶期(2018年5月16日)、开花期(2018年5月27日)、生理落果期(2018年6月11日)和果实着色期(2018年9月13日)对‘大方柿’和‘南通小方柿’的叶片进行取样,并于2018年3—10月选取‘南通小方柿’不同部位的组织:由顶而下第3、4片幼叶,幼嫩的茎尖,由下往上第3、4片老叶以及幼嫩的果实,对‘南通小方柿’和‘大方柿’中5个不同物候期的表达特性及在‘南通小方柿’不同组织中的表达特性进行检测,以柿为内参基因,利用Beacon Designer设计特异引物-YG-F和- YG-R(表1)。qRT-PCR 反应体系为:稀释cDNA 1 µL,上、下游引物各 0.2 µL,SYBR Premix Ex Taq(TaKaRa)10 µL,ddH2O 8.6 µL。反应条件为95℃ 4 min;95℃ 25 s,60℃ 20 s,72℃ 43 s,40个循环。每处理重复3次,根据2−ΔΔCt公式计算结果,通过SPSS软件计算标准误差和差异显著性。
1.2.7 表达载体PBI121-的构建 含酶切位点ORF片段的扩增:根据PBI121载体的酶切位点和中不含有的酶切位点,在开放阅读框特异引物上、下游的5′端分别引入I(TCTAGA)和I(CCCGGG)酶切位点序列。引物序列如下:
F:5′-GC/TCTAGA/ATGAAGCGCGACC GCCGCA-3′;
R:5′-TCC/CCCGGG/TCACCTCTGGTG GGTCTGGA-3′。
以cDNA为模板,进行PCR扩增,反应体系为:cDNA 1 µL,5×GXL buffer 5 µL,dNTP 2 µL,上下游引物各 0.5 µL,PrimeSTAR GXL酶0.5 µL,超纯水补足至25 µL。PCR程序为:98℃ 4 min;98℃ 10 s,60℃ 15 s,72℃ 60 s,35个循环;68℃延伸10 min。PCR产物用1.5%的琼脂糖凝胶进行紫外拍照检测,并切胶回收PCR产物,将回收产物与pEASY-Blunt克隆载体相连接,转化大肠杆菌DH-5α,用带酶切位点的引物进行菌落PCR检测阳性克隆,将阳性克隆测序验证。连接转化步骤同1.2.1。
PBI121-表达载体的构建:将PBI121载体质粒和经测序验证正确的克隆载体质粒同时用I和I进行双酶切。酶切体系(20 µL)为载体质粒10 µL、I 1 µL、I 1 µL、BSA缓冲液2 µL、10×T Buffer 2 µL、ddH2O 4 µL。所有试剂均在冰上进行操作,并于37℃酶切反应2—3 h,将酶切产物点样于1.5%的琼脂糖凝胶上进行电泳检测,分别回收载体片段和目的基因片段,将回收后的大小片段与T4DNA连接酶于16℃连接12 h,并将连接产物转化大肠杆菌DH-5α,连接转化步骤同1.2.1。利用基因特异引物进行菌落PCR验证阳性克隆,送生物公司测序。将测序正确的PBI121-重组质粒利用冻融法转化农杆菌感受态EHA105。
1.2.8 农杆菌介导法遗传转化烟草及转基因烟草的鉴定 用培养至OD600值约为0.5的阳性农杆菌单菌落菌液侵染切下的K326烟草叶片,侵染时间5 min,接种于共培养基中,暗培养3 d,用无菌水洗涤3次,无菌滤纸吸干水分,接种于含50 mg·L-1Km(卡那霉素,Kanamycin)的筛选培养基中,两周换一次培养基,直至长出抗性芽。转基因烟草的鉴定如下:(1)GUS染色:在超净工作台上剪取转基因烟草及野生型烟草的叶片于1.5 mL离心管中,加入200 µL GUS染液以浸没检测叶片,37℃下染色6—12 h,用50%乙醇脱色30 min后用75%乙醇脱尽绿色,拍照获取检测结果。(2)RT-PCR检测:对于GUS染色呈蓝色的株系,进一步提取其叶片的RNA,利用1.5%琼脂糖凝胶电泳检测RNA的质量,并于超微量浓度仪下检测RNA的浓度,利用反转录试剂盒将提取的RNA反转录为cDNA,烟草内参基因检测模板质量,以基因特异引物进行RT-PCR检测。PCR程序:94℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸2 min,共30个循环;最后一轮72℃延伸10 min。PCR反应体系:DNA 1 µL,10×PCR buffer 2.5 µL,dNTP 2 µL,上、下游引物各0.5 µL,rTaq酶0.15 µL,超纯水补足至25 µL。反应结束,PCR产物用1%琼脂糖凝胶检测。
1.2.9 转基因烟草GA1和GA4含量的测定 取野生型和转基因烟草由顶而下的第4、5片完全展开叶0.5 g。采用ESI-HPLC-MS/MS方法测定GA1、GA4的含量。
1.2.10 转基因烟草叶绿素含量的测定 选取移栽于室外4周的转基因与野生型烟草的中部第4、5片叶,提取叶绿素。参照李合生[26]的方法提取,并使用分光光度计进行检测。
1.2.11 转基因烟草形态指标的测定 转基因烟草和野生型烟草经过炼苗后,同时移栽定植于温室,于第一朵花开放时进行株高、节间长度等形态指标的测定,每个株系选取3个重复单株进行测量。
1.2.12 数据统计与分析 利用SPSS 17.0软件进行显著性分析。利用Excel 2010软件进行数据分析并作图。
2 结果
2.1 基因克隆与序列分析
从‘南通小方柿’中克隆得到了827 bp的。生物信息学分析表明,核苷酸序列与猕猴桃(KF588651.1)、光皮烨(MF149049.1)、砂梨(KX078214.1)、苹果(FJ535245.1)、葡萄(MG738718.1)的一致性达72%—80%。编码608个氨基酸,相对分子质量为66.5 kD,理论等电点5.54,蛋白质不稳定系数为50.41。编码的蛋白质无明显疏水区,无跨膜区,无信号肽序列。具有DELLA蛋白家族特有的DELLA结构域,属于DELLA蛋白基因家族。此外,编码的氨基酸与葡萄(AEK06229.1)、光皮烨(AVP41333.1)、湖北海棠(ABL61270.1)、苹果(ADH53778.1)、砂梨(AMZ00185.1)具有较高的相似性,序列一致性达65%—71%(图1)。系统进化树结果表明,与葡萄、毛白杨、猕猴桃、苹果的亲缘关系较近(图2)。
2.2 DkGAI2的物候期表达特性
从图3中可以看出在‘大方柿’和‘南通小方柿’5个不同物候期中存在表达差异。在‘南通小方柿’5个物候期的表达量均高于大方柿,且随着物候期的推进,两品种呈同样的下降趋势(图3)。
2.3 DkGAI2的组织表达特异性
利用qRT-PCR方法检测在‘南通小方柿’不同组织中的表达。结果表明,在老叶中的表达量远远高于在其他组织中的表达量,其次是幼叶和茎尖,而在幼果中几乎不表达(图4)。
2.4 DkGAI2基因的亚细胞定位
结果发现(图5),pCAMBIA-GFP-1302-绿色荧光蛋白信号分布在细胞核中,而pCAMBIA- GFP-1302绿色荧光蛋白信号分布在细胞膜上,说明编码蛋白定位于细胞核,在细胞核中发挥功能,具有转录因子的特征,是一类转录因子,且在植物生长发育过程中发挥着重要的整合作用。
2.5 转基因烟草的鉴定
经过30 d的筛选培养,共获得33个烟草抗性苗,GUS检测结果表明,转烟草株系中有6个GUS染色呈蓝色,而野生型株系未染上蓝色(图6-A)。RT-PCR检测结果显示,阴性对照中没有检测到扩增条带,在6株GUS染色为阳性的转烟草株系中,有5个株系扩增出与阳性对照大小一致的特异条带,胶回收、克隆测序表明,所扩增条带为目的基因序列。初步证明已成功在烟草转录水平上表达(图6-B)。
2.6 转基因烟草的生理指标测定
转基因烟草株系(L-2、L-3、L-11)叶片中GA1含量高于野生型,其中,野生型的GA1含量为1.22 ng∙g-1,L-2、L-3和L-11株系GA1的含量分别为野生型的1.43、1.23和1.35倍。而转基因株系中GA4含量均低于野生型,其中,野生型GA4含量为4.66 ng∙g-1,而转基因株系L-2、L-3、L-11的GA4含量分别为野生型的34.3%、24.7%和25.8%。结果表明,转基因株系中GA1和GA4总含量均低于野生型,其中,野生型烟草GA1和GA4总含量为5.88 ng∙g-1,而转基因株系L-2、L-3和L-11的GA1和GA4总含量分别为野生型的57%、45%、48%(表2)。
通过对转基因烟草叶绿素含量的测定,结果发现转基因烟草叶片的叶绿素含量均高于野生型,植株叶片颜色更深绿。其中,野生型烟草叶片的叶绿素含量为0.78 mg∙g-1,转基因株系L-2、L-3、L-11的叶绿素含量分别为野生型的1.51、1.43和1.67倍。

图1 DkGAI2编码氨基酸同源性比对

图2 DkGAI2系统进化树
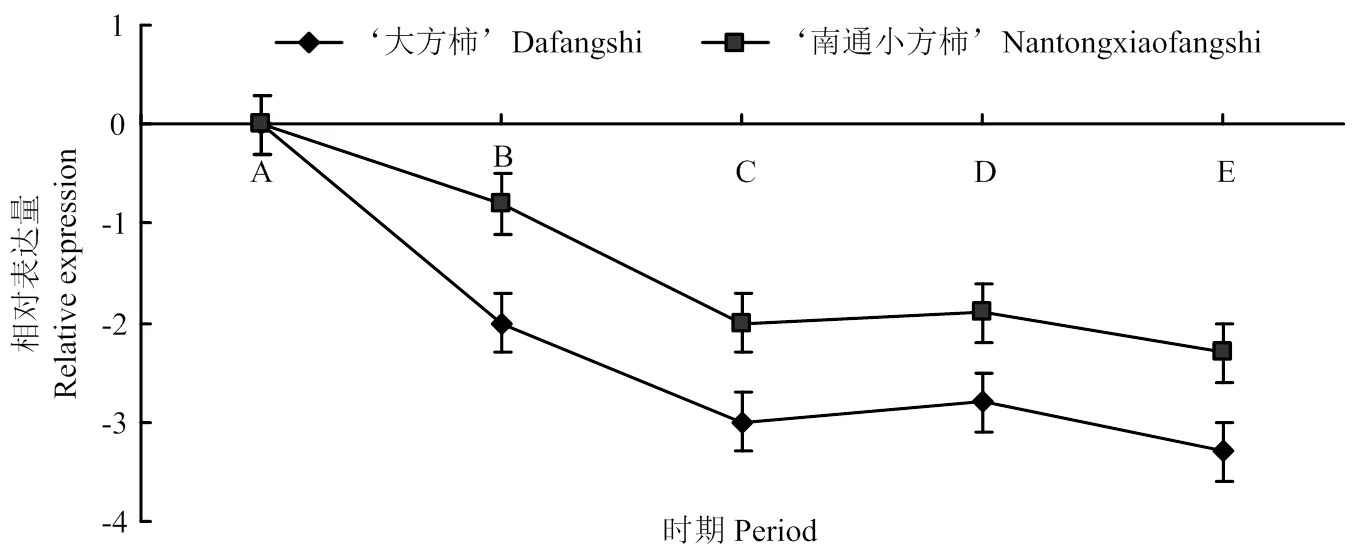
A:展叶期Leaf expanding period;B:枯顶期 Tip buds dying period;C:开花期 Flowering period;D:生理落果期 Physiological fruit-falling period;E:果实着色期 Fruit coloring period

不同小写字母表示差异显著(P<0.05)。下同 Different lowercase letters indicate significant differences (P<0.05). The same as below
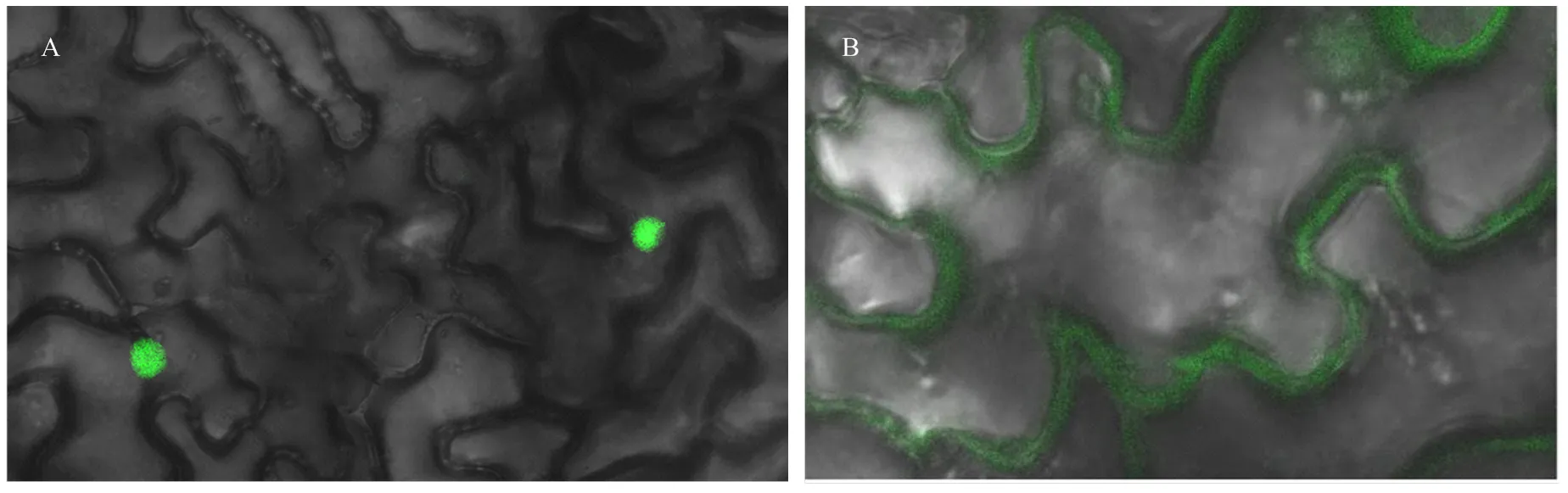
A:pCAMBIA-GFP-1302-DkGAI2融合蛋白pCAMBIA-GFP-1302-DkGAI2 fusion protein;B:pCAMBIA-GFP-1302载体pCAMBIA-GFP-1302 vector
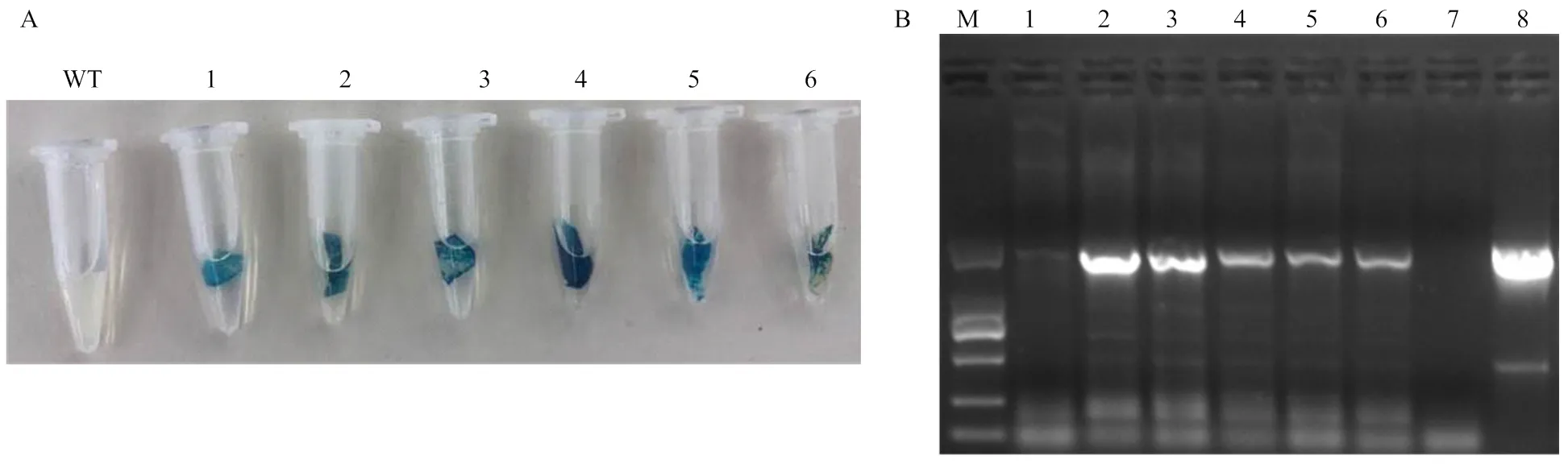
M:2000 DL Marker;1—6(A、B):转DkGAI2烟草株系 Transgenic tobacco plants;WT(A)、7(B):野生型烟草 Wild-type tobacco;8(B):PBI121-35S-DkGAI2重组质粒 PBI121-35S-DkGAI2 vector
2.7 转基因烟草的形态指标测定
转基因烟草植株表现出花期延迟、植株矮化、节间缩短等表型特征(图7)。其中,野生型的株高为31.5 cm,转基因株系L-2、L-3、L-11的株高分别为7.7、10.2和9.1 cm,分别为野生型的24.4%、32.4%和28.8%。此外,野生型的节间长度为17.5 cm,转基因株系L-2、L-3、L-11的节间长度分别为野生型的25.7%、41.1%和37.1%。且转基因株系叶片长宽比均显著低于野生型,其中以L-11株系的叶片长宽比1.4为最小,而野生型的叶片长宽比为2.6(表2)。
3 讨论
本研究中能使烟草表现出矮化表型, 这与前人拟南芥转化烟草的研究结果一致[27],且转烟草植株表现出叶色深绿的表型,与前人关于拟南芥突变体的表型研究相同[4],且在‘南通小方柿’和‘大方柿’5个不同物候期的表达呈现明显差异,在‘南通小方柿’不同物候期的表达量均高于‘大方柿’,说明很有可能参与‘南通小方柿’矮化性状的形成过程。矮化是作物育种中最有价值的性状之一,矮化品种抗倒伏,易管理,并与增产稳产相关。高等植物体内与赤霉素(GA)相关的矮化有两类:一类与其合成代谢有关,称之为合成型矮生突变体。此突变体主要是由于GA合成酶异常而引起植株体内GA缺乏,从而导致植物出现矮化[28]。另一类与GA的信号转导相关,被称为GA响应型突变体。根据其表型特征又可分为细长型响应突变体和GA不响应矮化型突变体。前者表现出施用过量GA的茎和叶过度生长、叶色浅绿、开花提前等表型特征,如拟南芥[29];后者与GA合成突变体的表型相似,这类突变体表现出矮化、叶色深绿、花期延迟等表型特征,且外源GA处理并不能使其恢复野生表型,如拟南芥(GA-insensitive-1)突变体、小麦(Reduced height 1-3) 、玉米和突变体[30],研究表明小麦和以及玉米与拟南芥赤霉素不敏感基因()属于直系同源物[5],本研究中,矮化的烟草株系的叶片长宽比与对照相比降低。

图7 转基因烟草形态指标的测定
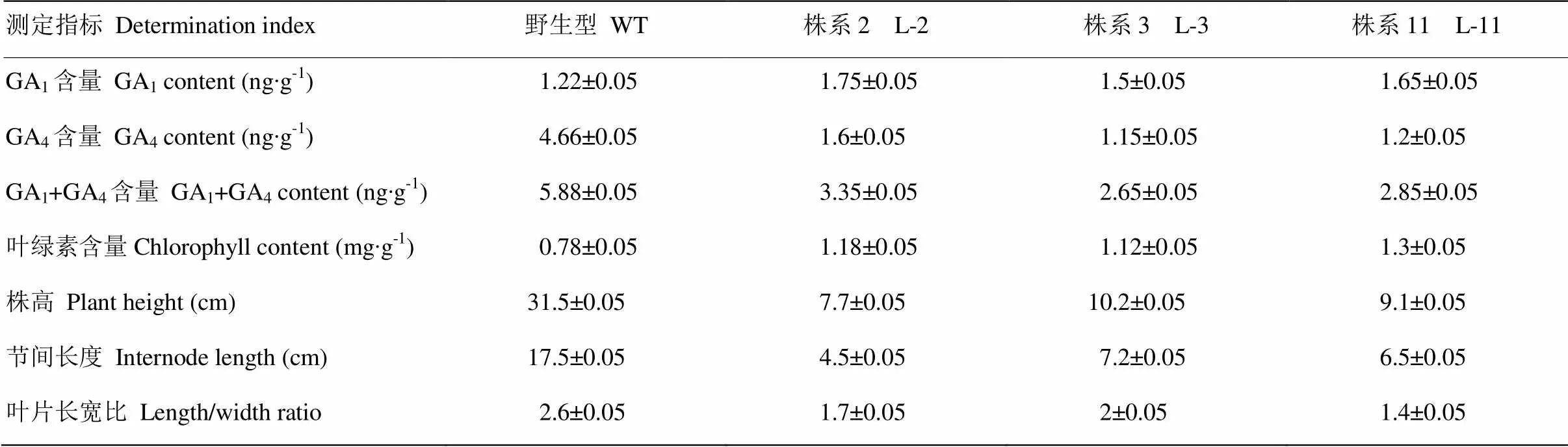
表2 转DkGAI2烟草生理及形态指标测定
‘南通小方柿’是目前在江苏省南通市发现的唯一具有矮生性状的柿品种,与‘大方柿’相比,其具有树冠矮小、新梢生长量小、适应强等优良特点[1]。生物活性GAs是一组二萜酸,可在植物的整个生命周期中调节不同的发育过程。DELLA蛋白作为GA信号转导通路中响应生长的关键阻遏物,属于GRAS(GAI、RGA、SCARECROW)家族的蛋白亚家族,含有保守的C末端GRAS结构域,而GRAS蛋白家族中GAI和RGA因其N末端均具有DELLA和VHYNP两个高度保守的酸性结构域,又被归类于DELLA蛋白[31]。在拟南芥中,RGA(由repressor of ga1-3编码)和GAI(由GA insensitive编码)是调控茎伸长的主要抑制因子[5]。GAI和RGA的DELLA结构域的突变使其对GA信号引起的降解产生抗性,并导致GA不敏感的矮化表型[19]。本研究中,含有高度保守的DELLA结构域,属于DELLA蛋白家族。且编码的氨基酸与葡萄、苹果、砂梨、芝麻的同源性达67%—75%,具有较高的相似性,说明在不同物种间的保守性较高。
关于DELLA蛋白的时空表达模式,不同植物DELLA蛋白的表达部位有所不同,和主要分布在棉花的营养器官以及纤维起始期和延伸期的胚珠中,其参与了棉花纤维的形成[32];主要分布在大豆的叶、胚组织和花等部位[33];主要分布于梅的茎和种子中[34];主要表达于葡萄茎尖和叶片等部位[35];主要分布在黄瓜茎和雄花芽中[36]。在‘南 通小方柿’老叶中表达最高,其次为幼叶和茎尖,而在幼果中几乎不表达,这与前人研究结果基本一致[33-36]。
DELLA蛋白是一类调控所有GA反应的保守的生长抑制因子[37]。近年来,随着蛋白基因组学和功能基因组学的研究,亚细胞定位、蛋白与蛋白之间的互作等研究越来越受到关注,其中,基因编码蛋白的亚细胞定位研究已成为功能基因组学的重要内容。基因所编码的蛋白质序列中包含了该蛋白的定位信息,并在细胞中的特定部位发挥作用[38]。研究表明,DELLA蛋白定位在细胞核,发挥着转录因子的功能。且具有转录因子的特征,定位于细胞核,本研究中定位于细胞核,与前人研究结果一致[39],说明是一类定位在核内的负转录因子,在植物生长发育过程中发挥着重要作用。
GAI因其N末端具有DELLA和VHYNP两个高度保守的酸性结构域,属于DELLA蛋白家族成员中的一员。是一类生长抑制因子,负向调控茎的生长。GA是植物体内重要的内源激素之一,对植物生长发育具有重要意义,GA1、GA3、GA4和GA7为植物体内有生物活性的GA[40]。本研究中,过表达烟草株系的GA1和GA4总含量均低于对照,这可能是引起烟草植株出现矮化表型的主要原因。此外,转基因烟草植株的GA1含量上升,GA4含量降低,说明主要是通过降低GA4的含量进而引起植株矮化。
4 结论
从‘南通小方柿’中克隆得到1 827 bp的,其含有高度保守的DELLA结构域,属于DELLA蛋白家族。系统进化树结果表明,DkGAI2与毛白杨、苹果、梅亲缘关系较近。亚细胞定位结果表明DkGAI2定位于细胞核。在老叶中表达量最高,其次为幼叶和茎尖,而在幼果中表达量最低。物候期表达分析结果表明在‘南通小方柿’5个不同物候期的表达量均高于‘大方柿’。过表达的烟草叶片GA1含量增加,GA4含量降低,GA1和GA4总含量降低,且转基烟草表现出植株矮化、节间缩短、叶片长宽比降低及花期延迟等现象。
[1] 戴文浩, 盛炳成, 章镇. 南通小方柿矮生性状及生理生化特性的研究. 南京农业大学学报, 1999, 22(2): 24-27.
DAI W H, SHENG B C, ZHANG Z. Studies on the physiological and biochemical characteristics and dwarfness of ‘Nantongxiaofangshi’ persimmon tree.1999, 22(2): 24-27. (in Chinese)
[2] SUN T P. Gibberellin-GID1-DELLA: a pivotal regulatory module for plant growth and development., 2010, 154(2): 567-570.
[3] HUSSAIN A, PENG J R. DELLA proteins and GA signalling in.2003,22(1): 134-140.
[4] PENG J, CAROL P, RICHARDS D E, KING K E, COWLING R J, MURPHY G P, HARBERD N P. Thegene defines a signaling pathway that negatively regulates gibberellin responses., 1997, 11(23): 3194-3205.
[5] PENG J, HARBERD N P. Gibberellin deficiency and response mutations suppress the stem elongation phenotype of phytochrome- deficient mutants of., 1997, 113(4): 1051-1058.
[6] DAI C, XUE H W. Rice early flowering1, a CKI, phosphorylates DELLA protein SLR1 to negatively regulate gibberellin signalling., 2010, 29(11): 1916-1927.
[7] ACHARD P, VRIEZEN W H, VAN DER STRAETEN D, HARBERD N P. Ethylene regulatesdevelopment via the modulation of DELLA protein growth repressor function., 2003, 15(12): 2816-2825.
[8] JASINSKI S, TATTERSALL A, PIAZZA P, HAY A, MARTINEZ- GARCIA J F, SCHMITZ G, THERES K, MCCORMICK S, TSIANTIS M. PROCERA encodes a DELLA protein that mediates control of dissected leaf form in tomato., 2008, 56(4): 603-612.
[9] LI W J, ZHANG J X, SUN H Y, WANG S M, CHEN K Q, LIU Y X, LI H, MA Y, ZHANG Z H., encoding a DELLA protein, negatively regulates runner production in, 2018, 247(4): 941-951.
[10] ZHAO B, LI H T, LI J J, WANG B, DAI C, WANG J, LIU K D.DS-3, encoding a DELLA protein, negatively regulates stem elongation through gibberellin signaling pathway., 2017, 130(4): 727-741.
[11] XU F, LI T, XU P B, LI L, DU S S, LIAN H L, YANG H Q. DELLA proteins physically interact with CONSTANS to regulate flowering under long days in., 2016, 590(4): 541-549.
[12] DJAKOVIC-PETROVIC T, WIT M D, VOESENEK L A C J, PIERIK R. DELLA protein function in growth responses to canopy signals., 2007, 51(1): 117-126.
[13] JIN Y, LIU H, LUO D X, YU N, DONG W T, WANG C, ZHANG X W, DAI H L, YANG J, WANG E T. DELLA proteins are common components of symbiotic rhizobial and mycorrhizal signalling pathways., 2016, 7: 12433.
[14] NIR I, SHOHAT H, PANIZEL I, OLSZEWSKI N, AHARONI A, WEISS D. The tomato DELLA protein PROCERA acts in guard cells to promote stomatal closure., 2017, 29(12): 3186-3197.
[15] CHEN L G, XIANG S Y, CHEN Y L, LI D B, YU D Q.WRKY45 interacts with the DELLA protein RGL1 to positively regulate age-triggered leaf senescence., 2017, 10(9): 1174-1189.
[16] GOLLDACK D, LI C, MOHAN H, PROBST N. Tolerance to drought and salt stress in plants: unraveling the signaling networks., 2014, 5: 151.
[17] DE VLEESSCHAUWER D, SEIFI H S, FILIPE O, HAECK A, NGUYEN HUU S, DEMEESTERE K, HOFTE M. The DELLA protein SLR1 integrates and amplifies salicylic acid-and jasmonic acid-dependent innate immunity in rice., 2016, 170(3): 1831-1847.
[18] SILVERSTONE A L, MAK P Y A, MARTINEZ E C, SUN T. The new RGA locus encodes a negative regulator of gibberellin response in., 1997, 146(3): 1087-1099.
[19] PENG J, RICHARDS D E, HARTLEY N M, MURPHY G P, DEVOS K M, FLINTHAM J E, BEALES J, FISH L J, WORLAND A J, PELICA F, SUDHAKAR D, CHRISTOU P, SNAPE J M, GALE M D, HARBERD N P. ‘Green revolution’ genes encode mutant gibberellin response modulators., 1999, 400(6741): 256-261.
[20] IKEDA A, UEGUCHI-TANAKA M, SONODA Y, KITANO H, KOSHIOKA M, FUTSUHARA Y, MATSUOKA M, YAMAGUCHI J. Slender rice, a constitutive gibberellin response mutant, is caused by a null mutation of thegene, an ortholog of the height-regulating gene., 2001, 13(5): 999-1010.
[21] CHANDLER P M, MARION-POLL A, ELLIS M, GUBLER F. Mutants at the Slender1 locus of barley cv Himalaya. Molecular and physiological characterization., 2002, 129(1): 181-190.
[22] 张涵, 王学敏, 刘希强, 马琳, 温红雨, 王赞. 紫花苜蓿MsGAI的克隆、表达及遗传转化. 中国农业科学, 2019, 52(2): 201-214.
ZHANG H, WANG X M, LIU X Q, MA L, WEN H Y, WANG Z. Cloning expression analysis and transformation ofgene fromL., 2019, 52(2): 201-214. (in Chinese)
[23] 赵春丽, 王晓, 潘君飞, 彭丽云, 赖钟雄, 刘生财. 苋菜AtGAI基因克隆及表达分析. 西北植物学报, 2019, 39(2): 199-209.
ZHAO C L, WANG X, PAN J F, PENG L Y, LAI Z X, LIU S C. Cloning and expression analysis ofgene inL.,2019, 39(2): 199-209. (in Chinese)
[24] 梁美霞, 祝军, 戴洪义. 柱型苹果 MdGAI 基因的克隆及表达分析. 园艺学报, 2011, 38(10): 1969-1975.
LIANG M X, ZHU J, DAI H Y. Cloning and expression analyzing ofgene of columnar apples., 2011, 38(10): 1969-1975. (in Chinese)
[25] 费元, 钟丹, 韩雪, 庞基良. 大岩桐GAІ同源基因的克隆及功能研究. 杭州师范大学学报(自然科学版), 2014, 13(5): 509-516.
FEI Y, ZHONG D, HAN X, PANG J L. Cloning and functional analysis of GAI homologous genes in.2014, 13(5): 509-516.(in Chinese)
[26] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000.
LI H S.. Beijing: Higher Education Press, 2000. (in Chinese)
[27] 彭世清, 陈守才. 在烟草中表达拟南芥基因获得矮化的烟草植株. 农业生物技术学报, 2005, 13(3): 388-389.
PENG S Q, CHEN S C. Obtaining dwarf plants by expression of angene in tobacco., 2005, 13(3): 388-389. (in Chinese)
[28] APPLEFORD N E J, EVANS D J, lENTON J R, GASKIN P, CROKER S J, DEVOS K M, PHILLIPS A L, HEDDEN P. Function and transcript analysis of gibberellin-biosynthetic enzymes in wheat., 2006, 223(3): 568-582.
[29] JACOBSEN S E, OLSZEWAKI N E. Mutations at the SPINDLY locus ofalter gibberellin signal transduction., 1993, 5(8): 887-896.
[30] SUN T P. Gibberellin signal transduction., 2000, 3(5): 374-380.
[31] HIRSCH S, OLDROYD G E D. GRAS-domain transcription factors that regulate plant development., 2009, 4(8): 698-700.
[32] 温玮. 棉花DELLA蛋白的基因克隆与功能的初步鉴定[D]. 海口: 海南大学, 2010.
WEN W. Cloning and functional identification of DELLA protein in cotton [D]. Haikou: Hainan Univeristy, 2010. (in Chinese)
[33] 宋仙萍. 大豆DELLA基因GmGAI2α参与赤霉素信号转导途径的功能分析[D]. 哈尔滨: 东北农业大学, 2013.
SONG X P. Functional analysis of soybean DELLA geneinvolved in gibberellin signal transduction pathway [D]. Harbin: Northeast Agricultural University, 2013. (in Chinese)
[34] 逯久幸. 梅花休眠相关DELLA基因的克隆与功能分析[D]. 北京: 北京林业大学, 2015.
LU J X. Cloning and functional analysis ofgene related to plum dormancy [D]. Beijing: Beijing Forestry University, 2015. (in Chinese)
[35] 杨光, 曹雪, 房经贵, 宋长年, 王晨, 王西成. ‘藤稔’葡萄VvGAI基因的克隆、亚细胞定位及时空表达分析. 园艺学报, 2011, 38(10): 1883-1892.
YANG G, CAO X, FANG J G, SONG C N, WANG C, WANG X C. Cloning, subcellular localization and spatiotemporal expression of agene from grapevine ‘Fujiminori’.,2011, 38(10): 1883-1892. (in Chinese)
[36] 张颜. 黄瓜中GA信号转导因子CsGAIP和CsGAMYB1的克隆与功能分析[D]. 北京: 中国农业大学, 2014.
ZHANG Y. Cloning and functional analysis of GA signal transduction factorsand(in Chinese)
[37] ZENTELLA R, ZHANG Z L, PARK M, THOMAS S G, ENDO A, MURASE K, FLEET C M, JIKUMARU Y, NAMBARA E, KAMIYA Y, SUN T. Global analysis of DELLA direct targets in early gibberellin signaling in., 2007, 19(10): 3037-3057.
[38] EMANUELSSON O, VON HEIJNE G. Prediction of organellar targeting signals., 2001, 1541(1/2): 114-119.
[39] UEGUCHI-TANAKA M, ASHIKARI M, NAKAJIMA M, ITOH H. GIBBERELLIN INSENSITIVE DWARF1 encodes a soluble receptor for gibberellin., 2005, 437(7059): 693.
[40] HEDDEN P, PHILLIPS A L. Gibberellin metabolism: New insights revealed by the genes., 2000, 5(12): 523-530.
Cloning and Function Analysis of Gibberellin InsensitiveGene in Nantongxiaofangshi (Linn. cv. nantongxiaofangshi)
JIANG MengTing, ZHU Ning, GONG HongYong, HOU YingJun, YU XinYi, QU ShenChun
(College of Horticulture, Nanjing Agricultural University, Nanjing 210095)
【】In this study, the full-length sequence of gibberellin insensitive gene () was obtained from the leaf of Nantongxiaofangshi (Linn. cv. nantongxiaofangshi), named as. The subcellular localization and expression characteristics ofgene were analyzed. Thengene was transformed into plant tobacco, and the morphological and physiological indicators of the transgenic tobacco plants were determined. Our study would provide a theoretical basis for the future research ofgene.【】The full-length sequence ofgene was cloned from Nantongxiaofangshi by RT-PCR, 3’ RACE and 5’ RACE using the labeledgene as the original sequence of high-throughput transcriptome sequencing of Nantongxiaofangshi (Unpublished). Sequence characteristics were analyzed by bioinformatics. The expression characteristics ofgene in five different phenological stages of Dafangshi and Nantongxiaofangshi, and the expression level ofgene in different tissues of Nantongxiaofangshi was detected by real-time quantitative PCR (qRT-PCR). The transient expression vector pCAMBIA-GFP-1302-was constructed and was transiently infected with tobacco to analyze the subcellular localization ofgene.gene driven by the 35S promoter was constructed and delivered into plant tobacco by Agrobacterium-mediated transformation approach. Transgenic plants were identified by using GUS staining and RT-PCR. After transplanting, the plant height, internode length, leaf aspect ratioand the content of GA1and GA4in transgenic tobacco plants were measured at the first flowering stage.【】1 827 bp ofwas cloned from Nantongxiaofangshi, the nucleotide sequence ofgene shared 72%-80% in homology compared with kiwifruit (KF588651.1), light skin (MF149049.1), pear (KX078214.1), apple (FJ535245.1) and grape (MG738718.1).gene containing DELLA and GRAS conserved special domain, belonging to DELLA protein gene family.gene encoding a putative protein about 608 amino acids, the relative molecular mass ofgene was 66.5 KD, the theoretical isoelectric point was 5.54, and the instability coefficient iwas 50.41, without obvious hydrophobic region, without transmembrane domain and signal peptide. Phylogenetic analysis showed that thegene had close relationship with grape. qRT-PCR result showed that the expression level ofgene in five different phenological stages of Nantongxiaofangshi was higher than that of Dafangshi.gene showed tissue expression specificity in different tissues of Nantongxiaofangshi, which had the highest expression in old leaves, followed by young leaves and shoot tips, while it had the lowest expression in fruitlet. The green fluorescent signal of the pCAMBIA-GFP- 1302-fusion protein was located in the nucleus, indicating thatgene localized in the nucleus. After GUS staining and RT-PCR detection, 5 transgenic tobacco lines ofgene were obtained. The GA1content of transgenic tobacco leaves were increased, the GA4content were decreased, the total content of GA1and GA4weredecreased, and the transgenic tobacco plants showed plant dwarfing phenotypes with shortened internodes, reduced leaf aspect ratio, and delayed flowering.【】genehad tissue expression specificity;gene localized in the nucleus, the expression level ofgene in Nantongxiaofangshi was higher than that of Dafangshi at the five different phenological periods. It was speculated thatmay cause plant dwarfing by reducing GA4content.
Nantongxiaofangshi;; gene cloning; subcellular localization; tissue specific expression
10.3864/j.issn.0578-1752.2019.19.012

2019-04-18;
2019-07-25
国家公益性行业(农业)科研专项经费项目(201203047)
蒋梦婷,E-mail:2016104025@njau.edu.cn。
渠慎春,E-mail:qscnj@njau.edu.cn
(责任编辑 赵伶俐)
