雌二醇、壬基酚和三丁基锡对斑马鱼雌激素响应基因表达的影响*
2019-10-12范家诚崔晓莹武亚男李正炎
范家诚,崔晓莹,武亚男,李正炎,2**
(1.中国海洋大学环境科学与工程学院,山东 青岛 266100;2.中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100)
在天然水环境中,不同类型的环境激素类污染物往往同时存在,仅测试单一污染物的雌激素效应可能忽略物质间存在的交互效应[1]。因此,研究环境激素类污染物的生物效应及其作用机制时应当考虑这些污染物间的相互作用,这可能涉及不同的作用机制。大多数的环境激素可以通过结合细胞核内的特定受体,如芳香烃受体、雄激素受体和甲状腺受体等,诱导或抑制受体的表达,进而对生物体内关键激素的调节产物造成差异性表达[2-3]。对环境雌激素类污染物而言,其典型作用机制是作为配体与雌激素受体(Estrogen receptor,ER)结合,并通过雌激素应答元件调节响应基因的转录过程[4]。ER在哺乳动物中具有2种亚型,ERα和ERβ。ERα是雌激素受体基因esr1表达的产物,它可以在肝脏和脑等组织中表达。另外,硬骨鱼类具有2种ERβ亚型[5-6],即分别被esr2b和esr2a基因编码的ERβ1和ERβ2。有研究表明,在雌激素作用下,ERs的基因在肝脏中的表达会明显上调[7]。所以,ERs的基因可以作为生物体内雌激素活性检测的典型生物标志物。
除ERs的基因外,卵黄蛋白原(Vitellogenin,Vtg)也常常作为生物标志物,用于分析鱼类等动物体内的雌激素活性。Vtg是在肝脏中合成的一种卵黄前体蛋白,已有研究指出,成年雄性斑马鱼[8]和幼体斑马鱼[9]可在外源性雌激素的诱导作用下合成卵黄蛋白原,且卵黄蛋白原基因mRNA的转录也会产生明显上调[10]。斑马鱼基因组中存在7种形式的Vtg基因,vtg1~vtg7,其中vtg1的表达量最高,这也使得vtg1成为研究雌激素效应的一个重要基因[11-12]。
斑马鱼具有典型脊椎动物所具有的内分泌、生殖和神经系统以及类似的发育模式,其基因组、蛋白组和转录组信息也不断趋于清晰和完整,斑马鱼体内的类固醇激素的类型、类固醇的受体、合成酶及生成途径和哺乳动物基本相同[13],因此,斑马鱼经常作为雌激素效应检测的模式生物[14]。
17β-雌二醇(17β-Estradiol,E2)是一种天然雌激素,其对雄性斑马鱼具有明显的雌激素效应[15],它作为一种阳性对照化合物,已广泛用于评估某些新型污染物的雌激素效应。作为壬基酚聚氧乙烯醚的主要降解产物,壬基酚(Nonylphenol,NP)是一种典型的环境拟雌激素,它可以模拟天然雌激素,对稀有鮈鲫(Gobiocyprisrarus)产生雌激素效应[16]。而三丁基氯化锡(Tributyltin chloride,TBT)作为一种环境抗雌激素,可以在mRNA表达、性激素表达、组织器官指数和生殖行为等不同生物学水平上,抑制稀有鮈鲫的雌激素效应[17]。本研究选取Vtg基因vtg1和ERs基因esr1、esr2a、esr2b作为雌激素响应基因,初步探讨了3种环境雌激素类污染物在单独及共同暴露条件下对斑马鱼肝脏组织中4种基因mRNA表达的影响,为自然环境中多种环境激素共存环境下的生态风险评估提供科技支撑。
1 材料与方法
1.1 实验材料
性成熟的雄性斑马鱼(5~6月龄,体长(2.65±0.05)cm,湿重(0.33±0.02)g)购于青岛市某花鸟鱼市场,实验前室内驯养两周,驯养条件如下:水温(27±1)℃、光照14 h(L):10 h(D),每天换水1/3,早晚各饲喂颗粒型热带鱼粮(Porpoise,江门)一次。
17β-雌二醇(E2,CAS:50-28-2,>97.0%,上海TCI)、壬基酚(NP,CAS:84852-15-3,美国Sigma-Aldrich)、三丁基氯化锡(TBT,CAS:1461-22-9,99%,北京J&K)
1.2 实验方法
1.2.1 斑马鱼暴露过程 E2、NP和TBT的单独暴露:预先进行各污染物单独暴露,各污染物暴露浓度分别为:E2:5、10、25、50、100 ng/L;NP:10、25、50、100、200 μg/L;TBT:10、25、50、100、200 ng/L。每种污染物单独暴露各设5个浓度组,1个空白及1个溶剂对照组(0.05%乙醇)。
E2、NP和TBT的联合暴露:根据3种污染物单独暴露的实验结果,分别在3种污染物可以造成目的基因mRNA显著性差异表达的浓度范围内,各选取一个高浓度和一个低浓度,设置联合暴露浓度,各实验组暴露浓度如下:
E2和NP暴露组:10 ng/L E2+25 μg/L NP,10 ng/L E2+100 μg/L NP,50 ng/L E2+25 μg/L NP,50 ng/L E2+100 μg/L NP;
E2和TBT暴露组:10 ng/L E2+25 ng/L TBT,10 ng/L E2+100 ng/L TBT,50 ng/L E2+25 ng/L TBT,50 ng/L E2+100 ng/L TBT;
NP和TBT暴露组:25 μg/L NP+25 ng/L TBT,25 μg/L NP+100 ng/L TBT,100 μg/L NP+25 ng/L TBT,100 μg/L NP+100 ng/L TBT;
E2、NP和TBT暴露组:10 ng/L E2+25 μg/L NP+25 ng/L TBT,10 ng/L E2+25 μg/L NP+100 ng/L TBT,10 ng/L E2+100 μg/L NP+25 ng/L TBT,10 ng/L E2+100 μg/L NP+100 ng/L TBT,50 ng/L E2+25 μg/L NP+25 ng/L TBT,50 ng/L E2+25 μg/L NP+100 ng/L TBT,50 ng/L E2+100 μg/L NP+25 ng/L TBT,50 ng/L E2+100 μg/L NP+100 ng/L TBT。
联合暴露共设20个浓度组及1个空白及1个溶剂对照组(0.05%乙醇)。
斑马鱼的暴露在水温(27±1)℃、光照14 h(L)∶10 h(D)连续曝气条件下进行。暴露容器为40 cm×25 cm×40 cm玻璃缸,玻璃缸中加入20 L经24 h连续曝气除氯的自来水,并在每个玻璃缸中添加毒物至对应暴露浓度,混匀。每组随机放入实验用斑马鱼16尾,每天更换全部暴露液并饲喂颗粒型热带鱼粮(Porpoise,江门)。暴露进行至第14天后,对各组斑马鱼进行取样(每组样本数n=4)。
1.2.2 组织保存和总RNA提取 将斑马鱼放置于冰面上进行活体解剖,并根据性腺形态对其进行性别确认,然后取雄性斑马鱼的肝脏组织置于冻存管中,并加入RNA保存剂(Takara,大连),保存在-80 ℃超低温冰箱中备用。RNA提取前,从冰箱中取出冻存的肝脏样本,采用组织研磨器捣碎匀浆。总RNA提取操作参照TRIzolTMReagent(Invitrogen,美国)试剂说明书进行,提取的总RNA溶于50 μL DNase/RNase-free ddH2O中,置于-80 ℃超低温冰箱中保存。提取完成后,取1 μL RNA溶液,利用NanoDrop 2000紫外-可见分光光度计(Thermo Fisher,美国)对其进行浓度测定与纯度校验,并取5 μL RNA溶液进行1%琼脂糖凝胶电泳分析,通过观察电泳条带的清晰度,检验RNA完整性。
1.2.3 逆转录过程 选取通过上述检验的RNA样本,根据测得的总RNA浓度,取1 μg总RNA,参照PrimeScriptTMRT reagent Kit with gDNA Eraser(Takara,大连)试剂盒说明书构建20 μL的逆转录反应体系,反应条件为:37 ℃ 15 min,85 ℃ 5 s,4 ℃结束反应。逆转录反应产物置于-20 ℃冰箱中保存。
1.2.4 定量PCR引物设计 根据NCBI网站GenBank数据库中斑马鱼内参基因actb1和4种雌激素响应基因vtg1、esr1、esr2a和esr2bmRNA的蛋白质编码区序列,设计对应引物(见表1)。全部引物由上海生工生物工程股份有限公司进行合成,使用前按照合成说明书,加入DNase/RNase-free ddH2O将其稀释至8 μmol/L,并置于-20 ℃冰箱中保存。
1.2.5 实时荧光定量PCR反应 以逆转录产物cDNA作为扩增模板,取2 μL cDNA溶液置于96孔板中,参照SYBR®Premix Ex TaqTMII(Takara,大连)试剂盒说明书构建20 μL的反应体系,并使用Roche LightCycler®480 System(Roche,美国)进行mRNA表达量的检测,具体反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃延伸与侦测荧光30 s,共计40个循环;熔解曲线:95 ℃ 5 min,60 ℃ 1 min,95 ℃继续;50 ℃降温30 s。每个样本重复进样3次。反应结束后确认扩增曲线和熔解曲线,并记录达到阈值时的循环数CT。

表 1 雌激素响应基因的实时荧光定量反应特异性引物Table 1 Gene-specific primers for qPCR analysis of mRNAs of selected estrogen-responsive genes
1.2.6 引物特异性验证 分析实时荧光定量PCR的熔解曲线,观察熔解温度Tm值与特异性吸收峰的生成情况,避免非特异性扩增和二级结构对实验结果的影响。并取5 μL扩增产物进行3%琼脂糖凝胶电泳分析,用以比较扩增产物的分子量是否与设计结果一致。经验证,设计的引物工作性能良好,扩增过程中没有产生二级结构且扩增产物准确。
1.3 数据分析
通过比较目的基因和内参基因的扩增效率,确立采用2-ΔΔCT相对定量分析方法[18],采用公式(1)对实验结果CT值进行归一化处理。目的基因的相对表达量以平均值±标准误差表示,并使用SPSS 22进行单因素方差分析(ANOVA),采用Duncan法进行实验组之间表达量的多重比较。
相对mRNA表达量=2-ΔΔCT。
(1)
其中:ΔΔCT=[CT(目的基因)-CT(内参基因)]暴露组-[CT(目的基因)-CT(内参基因)]对照组。
2 结果
2.1 E2和NP联合暴露对斑马鱼雌激素响应基因mRNA表达的影响
研究结果表明,E2和NP的联合暴露可以显著诱导vtg1和esr1mRNA的表达(见图1)。当两者都处在较高浓度时(E2 50 ng/L、NP 100 μg/L),vtg1和esr1mRNA的相对表达量分别为溶剂对照组的81 208和13.57倍,远大于两者单独暴露时相对表达量之和(P<0.05)。另外,E2和NP联合暴露对esr2bmRNA的表达的诱导作用与NP单独暴露时的诱导作用相比无显著性差异(P>0.05),对esr2amRNA的表达也没有显著性影响(P>0.05)。
2.2 E2和TBT联合暴露对斑马鱼雌激素响应基因mRNA表达的影响
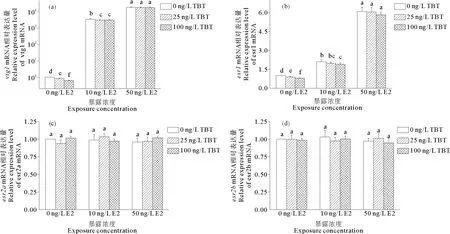
在E2和TBT联合暴露的条件下,vtg1和esr1mRNA的表达情况与E2单独暴露时相比无显著性差异(见图2)。只有当E2浓度较低时(10 ng/L),TBT才能抑制E2对vtg1和esr1mRNA表达的诱导作用(P<0.05)。而esr2a和esr2bmRNA在E2和TBT联合暴露下的相对表达量,为溶剂对照组的0.95倍至1.03倍,与溶剂对照组相比均无显著性差异(P>0.05)。
2.3 NP和TBT联合暴露对斑马鱼雌激素响应基因mRNA表达的影响
NP和TBT的联合暴露对vtg1和esr1mRNA的表达产生的诱导作用远低于NP单独作用时所产生的诱导作用(见图3)。当TBT处于较高浓度(100 ng/L),且NP为25和100 μg/L时,vtg1mRNA的相对表达量分别为溶剂对照组的2.97和7.79倍,相较于NP单独暴露时的4.34和12.27倍,均具有显著性的下降(P<0.05)。对于esr1mRNA表达的影响亦是如此,在上述相同条件下,esr1mRNA的相对表达量分别为溶剂对照组的1.45和2.35倍,相较于NP单独暴露时所产生的2.18和3.63倍,也表现出了显著性的下降(P<0.05)。至于两者联合暴露对esr2a和esr2bmRNA表达的影响,则与NP和E2联合暴露时的结果类似。

(雌激素响应基因的相对表达量是以actb1为内参基因,使用相对定量法对目的基因mRNA的表达量进行归一化的结果,并表示为平均值±标准误差的形式。采用Duncan法对单因素方差分析的结果进行事后多重比较,不同的小写字母表示暴露组间具有显著性差异,P<0.05。Values were normalized againstactb1as a housekeeping gene,and represent mean mRNA expression value ± S.E.M.(n=4)relative to those of the controls.Means of exposures not sharing a common lowercase letter are significantly different atP<0.05 as assessed by one-way ANOVA followed by the Duncan’s test.)
图 1 E2和NP联合暴露14 d的雄性斑马鱼肝脏中vtg1(a)、esr1(b)、esr2a(c)和esr2b(d)mRNA的表达情况
Fig.1 Expression of hepaticvtg1(a),esr1(b),esr2a(c)andesr2b(d)mRNA in adult male zebrafish exposed to various concentrations of E2 and NP for 14 days
(雌激素响应基因的相对表达量是以actb1为内参基因,使用相对定量法对目的基因mRNA的表达量进行归一化的结果,并表示为平均值±标准误差的形式。采用Duncan法对单因素方差分析的结果进行事后多重比较,不同的小写字母表示暴露组间具有显著性差异,P<0.05。Values were normalized againstactb1as a housekeeping gene,and represent mean mRNA expression value ± S.E.M.(n=4)relative to those of the controls.Means of exposures not sharing a common lowercase letter are significantly different atP<0.05 as assessed by one-way ANOVA followed by the Duncan’s test.)
图 2 E2和TBT联合暴露14 d的雄性斑马鱼肝脏中vtg1(a)、esr1(b)、esr2a(c)和esr2b(d)mRNA的表达情况
Fig.2 Expression of hepaticvtg1(a),esr1(b),esr2a(c)andesr2b(d)mRNA in adult male zebrafish exposed to various concentrations of E2 and TBT for 14 days

(雌激素响应基因的相对表达量是以actb1为内参基因,使用相对定量法对目的基因mRNA的表达量进行归一化的结果,并表示为平均值±标准误差的形式。采用Duncan法对单因素方差分析的结果进行事后多重比较,不同的小写字母表示暴露组间具有显著性差异,P<0.05。Values were normalized againstactb1as a housekeeping gene,and represent mean mRNA expression value ± S.E.M.(n=4)relative to those of the controls.Means of exposures not sharing a common lowercase letter are significantly different atP<0.05 as assessed by one-way ANOVA followed by the Duncan’s test.)
图3 NP和TBT联合暴露14 d的雄性斑马鱼肝脏中vtg1(a)、esr1(b)、esr2a(c)和esr2b(d)mRNA的表达情况
Fig.3 Expression of hepaticvtg1(a),esr1(b),esr2a(c)andesr2b(d)mRNA in adult male zebrafish exposed to various concentrations of NP and TBT for 14 days
2.4 E2、NP和TBTB联合暴露对斑马鱼雌激素响应基因mRNA表达的影响
在E2、NP和TBT三种物质联合暴露的条件下,esr1、esr2a和esr2bmRNA的表达情况与TBT浓度之间的关联程度均相对较小(见图4)。而对于vtg1mRNA的表达情况来说,当E2和NP都处于较低浓度(E2 10 ng/L、NP 25 μg/L),且TBT的浓度为25和100 ng/L时,vtg1mRNA的相对表达量分别为溶剂对照组的6 354和6 262倍,相较于E2和NP两者联合暴露时的6 782倍,具有显著性的下降(P<0.05)。在此基础上升高NP浓度,使其达到100 μg/L,低浓度的TBT(25 ng/L)则不再能抑制E2和NP对vtg1mRNA表达的诱导作用(P>0.05),此时只有当TBT处于较高浓度时(100 ng/L),vtg1mRNA的相对表达量为溶剂对照组的13 566倍,相较于E2和NP两者联合暴露时的14 905倍,才具有显著性的下降(P<0.05)。
3 讨论
E2是一种天然类固醇雌激素,其对雄性斑马鱼具有明显的雌激素效应,前人研究已证实其可以诱导雄性斑马鱼肝脏vtg1和esr1mRNA的表达[19-20]。而NP则可以通过模拟天然雌激素的功能对斑马鱼产生雌激素效应,但其雌激素活性比E2低3~4个数量级,是一种相对较弱的ER激动剂[21]。本研究中,E2和NP的联合暴露对雄性斑马鱼肝脏中vtg1和esr1mRNA表达的影响结果与前期研究报道结果相似[22],即:一种相对较弱的ER激动剂与E2共同作用往往呈现协同或相加效应[23]。至于esr2a和esr2b这2种ER基因,尽管其翻译产物ERβa和ERβb都可以与天然雌激素[24]或其他雌激素配体结合[25],但两者的表达模式不同于esr1,且两者间也有所不同,多数研究表明雌激素对两者的转录没有显著影响[26]。但也有研究指出,另一种ER激动剂双酚A(Bisphenol A,BPA)对ERα和ERβ都能发挥作用[27],并且能被ER抑制剂所阻断。

(雌激素响应基因的相对表达量是以actb1为内参基因,使用相对定量法对目的基因mRNA的表达量进行归一化的结果,并表示为平均值±标准误差的形式。采用Duncan法对单因素方差分析的结果进行事后多重比较,不同的小写字母表示暴露组间具有显著性差异,P<0.05。Values were normalized againstactb1as a housekeeping gene,and represent mean mRNA expression value ± S.E.M.(n=4)relative to those of the controls.Means of exposures not sharing a common lowercase letter are significantly different atP<0.05 as assessed by one-way ANOVA followed by the Duncan’s test.)
图4 E2、NP和TBT联合暴露14 d的雄性斑马鱼肝脏中vtg1(a)、esr1(b)、esr2a(c)和esr2b(d)mRNA的表达情况
Fig.4 Expression of hepaticvtg1(a),esr1(b),esr2a(c)andesr2b(d)mRNA in adult male zebrafish exposed to various concentrations of E2,NP and TBT for 14 days
这与本研究的结果相类似,即,BPA和NP都可以诱导ERα的调控基因esr1和ERβb的调控基因esr2b的表达。因此,猜测本研究中NP对雄性斑马鱼肝脏中ERs的基因表达所表现出的诱导作用,可能与BPA的作用机制相同。
另外,作为环境抗雌激素,TBT与上述两种物质的作用机制不尽相同。有研究指出,TBT可以通过抑制芳香化酶Cyp19的活性,继而抑制体内E2的生成过程,降低生物体内E2的含量并产生抗雌激素效应[28]。本研究中,只有在与较低浓度的E2联合暴露或与较低浓度的E2和NP三者联合暴露时,TBT在较高浓度下才可以抑制E2对雄性斑马鱼肝脏中vtg1mRNA表达的诱导效应。当TBT和NP联合暴露时,其对雄性斑马鱼肝脏中vtg1和esr1mRNA表达又会产生显著的抑制作用。另外,在E2、NP和TBT三者联合暴露的情况下,TBT对雄性斑马鱼肝脏中esr1mRNA表达不产生显著的抑制作用。同时,实验结果也表明,esr1对雌激素的响应不如vtg1敏感。因此,在三者联合暴露的情况下,只有较为敏感的基因才能对TBT做出明显响应。上述实验结果中,TBT的抗雌激素效应与E2浓度间呈现出了很强的相关性,这为前文提出的TBT可以通过降低生物体内E2水平来产生抗雌激素效应这一作用机理提供了佐证。不过也有研究表明,除了降低生物体内雌激素水平之外,抗雌激素还具有其他作用机制,包括竞争受体结合位点[29],加速雌激素的代谢[30],降低ER含量[31],抑制ER转录活性[32]以及ER和其他核受体的交互应答[33]等。更有进一步研究指出,TBT也可以作为芳香烃受体(Aryl hydrocarbon receptor,AhR)激动剂,参与ER-AhR抑制性交互应答,继而产生抗雌激素效应[34]。由此可见,仅凭Vtg和ER两类生物标志物的基因无法详细阐明TBT的抗雌激素效应机制,需要补充AhR和芳香化酶等其他生物标志物的相关基因,以及这些基因在不同组织中表达情况的实验进行验证。
综上所述,天然雌激素E2、环境拟雌激素NP和环境抗雌激素TBT的联合暴露可以诱导雄性斑马鱼肝脏中卵黄蛋白原基因和雌激素受体基因的表达,且3种污染物可能具有不同的作用机制。本研究以斑马鱼作为受试生物,在E2、NP和TBT联合暴露的情况下,分别对成年雄性斑马鱼进行了为期14 d的暴露,采用实时荧光定量PCR的检测方法,研究了不同污染物组合下,成年雄性斑马鱼肝脏中四种雌激素响应基因mRNA的表达情况,为今后探索多种环境雌激素类污染物共存条件下的生物效应和生态风险提供了科学依据。
