硫化氢合成酶抑制剂金丝桃素的体内外抗结肠癌作用研究
2019-10-11尹春丽牛卫宁
尹春丽,骞 婧,王 军,牛卫宁*
1西安文理学院生物与环境工程学院,西安 710065;2西北工业大学生命学院,西安 710072
胱硫醚-β-合成酶(cystathionine-β-synthase,CBS)是体内催化合成气体信号分子硫化氢(H2S)的三种酶之一[1,2],硫化氢在哺乳动物体内参与多种生物学过程[3,4]。近期研究表明在结肠癌、卵巢癌和乳腺癌中CBS来源H2S浓度的升高促进了肿瘤细胞的增殖和迁移[5-7]。通过RNA干扰或加入抑制剂降低CBS活性则抑制了肿瘤细胞的增殖,减少了体内肿瘤的生长[8,9],这些发现表明CBS可能是一个潜在的抗肿瘤靶点。因此,研发高效的CBS选择性抑制剂具有重要的意义。
氨基氧乙酸(AOAA)是目前唯一被广泛使用的CBS抑制剂。AOAA通过不可逆结合磷酸吡哆醛(pyridoxal 5′-phosphate,PLP)辅因子抑制酶活性,因此AOAA是PLP依赖酶的广谱性抑制剂[10]。另外,在生理条件下抑制CBS活性需要高浓度的AOAA(1~10 mmol/L),因此AOAA作为CBS抑制剂存在选择性差和抑制作用弱的不足[11]。在作者实验室前期研究中,通过高通量筛选天然产物化合物文库获得几个CBS选择性抑制剂,其中来源于中草药贯叶连翘(HypericumperforatumL.)的化合物金丝桃素(hypericin)对CBS活性具有强的抑制作用[12]。金丝桃素是一种天然的光敏剂,经光激活产生单线态氧可以诱导肿瘤细胞凋亡并抑制其生长,同时金丝桃素对肿瘤组织具有特异的亲和力,也被广泛用于肿瘤的光动力学诊断中[13-15]。然而,金丝桃素作为CBS抑制剂的抗肿瘤活性并不清楚。本论文研究了金丝桃素作为CBS抑制剂的体内外抗结肠癌活性。
1 材料与仪器
1.1 材料
金丝桃素(纯度≥98%)购自成都曼斯特生物科技有限公司;二甲基亚砜(DMSO)、同型半胱氨酸、氨基氧乙酸(AOAA)和炔丙基甘氨酸(PAG)购自美国Sigma公司;CCK-8细胞活性检测试剂盒购自日本Dojindo公司;CBS抗体购自武汉爱博泰克生物科技有限公司;人结肠癌细胞HT29购自美国典型菌种保藏中心(ATCC);亲和层析柱GSTrap FF和HisTrap FF 购自美国GE公司;其他所有试剂均为分析纯。
1.2 仪器
多功能酶标仪(SynergyTMH1,Biotek,美国);蛋白质转印系统(Bio-rad,美国);化学发光成像系统(TanonTM5200,北京原平皓生物技术有限公司,中国);超声波细胞破碎仪(宁波新芝生物科技股份有限公司,中国);恒温震荡摇床(上海智城分析仪器制造有限公司,中国);大容量高速冷冻离心机(湖南湘仪离心机仪器有限公司,中国);二氧化碳培养箱(Thermo,美国)。
2 实验方法
2.1 人胱硫醚-β-合成酶(CBS)和人胱硫醚-γ-裂解酶(CSE)的表达纯化
人CBS的表达纯化根据作者以前发表的文献进行[1,12]。重组大肠杆菌发酵液(6 L)经离心后得到菌体,然后将菌体重悬于500 mL 裂解液中(50 mmol/L 磷酸盐缓冲液,pH7.4)并使用超声波细胞破碎仪破碎。随后,在4 ℃下 12 000 rpm离心30 min获得上清液,上清液过预先平衡的GSTrap FF亲和层析柱,然后使用平衡缓冲液(50 mM Tris-HCl,pH8.0)洗脱除去杂蛋白。在层析柱中加入凝血酶(5 U/mg重组蛋白)4 ℃柱上酶切16 h,收集CBS蛋白储存于-80 ℃备用。聚丙烯酰胺凝胶电泳(SDS-PAGE)检测结果表明重组CBS纯度大于90%。人胱硫醚-γ-裂解酶(CSE)的表达纯化参照作者发表的文献进行[12]。
2.2 硫化氢(H2S)含量测定
使用亚甲蓝法测定反应液中H2S的含量[11]。当测定CBS重组蛋白催化合成H2S的实验时,反应液(200 μL)包含 50 mmol/L HEPES 缓冲液 (pH7.4)、 0.4 mmol/L Pb(NO3)2、 2 mmol/L 同型半胱氨酸和 5 μg CBS 蛋白。当测定HT29细胞裂解液催化产生H2S的实验时,使用冰冷的磷酸盐缓冲液(PBS)洗涤培养的HT29细胞3次,然后将收获的细胞在液氮/水浴中冻融5次破碎,反应液200 μL包含180 μL细胞裂解液和2 mmol/L 同型半胱氨酸。在反应液中加入2 mmol/L半胱氨酸底物开始反应,在37 ℃孵育30 min后加入25 μL 20 mmol/L的N,N-二甲基-1,4-苯二胺(溶解于7.2 mol/L HCl)和25 μL 30 mmol/L的FeCl3(溶解于1.2 mol/L HCl)终止反应。孵育15 min后反应液在12 000 rpm离心10 min获得上清液。转移上清液至96孔板中,在670 nm波长下测量吸光度。使用标准浓度的Na2S溶液制作H2S浓度与吸光度标准曲线图,根据标准曲线计算样品中H2S浓度。
2.3 金丝桃素对CBS活性的影响
使用亚甲蓝法测定不同剂量金丝桃素对CBS活性的影响,金丝桃素抑制CBS活性的半抑制浓度(IC50)被测定,反应混合物总体积为200 μL,包括2 mmol/L 半胱氨酸、2 mmol/L 同型半胱氨酸、5 μg CBS、 0.4 mmol/L Pb(NO3)2和体积分数为5%的DMSO。以未加金丝桃素的反应混合物作为对照。
2.4 小干扰RNA(siRNA)介导的CBS基因沉默
为了研究哺乳动物细胞中CBS蛋白是否是金丝桃素作用的靶标,通过RNA干扰技术抑制CBS基因的表达,siRNA的序列如下所示。5′-GGAAGAAGUUCGGCCUGAATT-3′,5′-GGAACUACA UGACCAAGUUTT-3′和5′-CCAUUGACUUGCUGAA CUUTT-3′,随机的siRNA被作为阴性对照。所有siRNA序列的设计和合成由生工生物工程(上海)股份有限公司完成。当HT29细胞生长到30%~40%融合度时,使用转染试剂Lipofectamine 2000(Invitrogen公司)进行siRNA转染,转染后的细胞在37 °C继续培养48 h。
2.5 细胞活力检测
HT29细胞在DMEM培养基(Life Technologies公司)中37 °C,φB=5% CO2进行培养,培养基包含φB=10%的胎牛血清(Biological Industries公司)和青霉素-链霉素溶液(Sigma公司)。使用CCK-8细胞活性检测试剂盒测定金丝桃素抑制HT29细胞增殖的IC50值。接种HT29细胞于96孔板中(每孔包含1×104个细胞),培养24 h后更换含有不同浓度金丝桃素的新鲜培养基继续培养24 h,然后加入CCK8溶液在37 °C孵育2 h,在450 nm测定吸收度。以不包含金丝桃素的样品作为对照,计算不同浓度金丝桃素存在条件下的细胞存活率。
2.6 体内抗肿瘤活性
BALB/c裸鼠购自中国医学科学院实验动物科学研究所,动物实验由西北工业大学实验动物福利与伦理委员会批准进行(批准号:2018017)。将HT29 细胞(每毫升1×107个细胞,100 μL)皮下接种于5周龄雌性小鼠的右前肢腋窝。使用游标卡尺每三天测定肿瘤的体积(肿瘤体积=0.5×长×宽2),当肿瘤体积达到约100 mm3时,所有小鼠被随机分成5组(每组6只),分别为溶剂对照组(包含φB=5%的DMSO和ρB=5 g/L的羧甲基纤维素钠溶解于PBS缓冲液中)、阳性药物AOAA对照组(10 mg/kg·d)、金丝桃素低(5 mg/kg·d)、中(10 mg/kg·d)和高剂量组(30 mg/kg·d),小鼠每周注射药物6次,连续给药2周。
2.7 Western blot法检测细胞CBS蛋白表达水平
使用冰冷的PBS溶液洗涤细胞3次,然后加入裂解液(50 mmol/L Tris-HCl pH7.4,150 mmol/L NaCl,ρB=5 g/L的脱氧胆酸钠,φB=1%的NP40和蛋白酶抑制剂)裂解细胞,在4 °C下12 000 rpm离心10 min获得上清液,BCA法测定蛋白浓度并进行SDS-PAGE电泳,然后进行转膜,封闭。加入兔源CBS一抗(1∶1 000)4 °C过夜孵育,加二抗孵育2 h(1∶5 000),使用天能TanonTM化学发光成像系统进行分析拍照,使用 Image J软件分析Western-blot条带灰度值进行相对定量。
2.8 数据分析
采用GraphPad Prism version 6.0 软件对数据进行统计学分析,数据表示为平均值±标准偏差(SD),P< 0.05为差异有统计学意义。
3 结果与分析
3.1 金丝桃素选择性抑制CBS活性
作者实验室前期通过高通量筛选天然产物文库获得了几种CBS抑制剂,其中金丝桃素(图1A)对CBS活性的抑制作用最强[12]。本研究中使用亚甲蓝方法测定不同浓度金丝桃素对CBS和CSE活性的影响,结果如图1B所示。在底物2 mmol/L半胱氨酸和2 mmol/L同型半胱氨酸存在的条件下,金丝桃素抑制CBS活性的IC50为7.9 ± 1.42 μmol/L。另外,测定了AOAA(目前普遍使用的CBS抑制剂)对CBS产H2S活性的影响,结果如图1C所示,IC50为8.2 ± 1.14 μmol/L,表明金丝桃素对CBS活性的抑制效果和AOAA基本一致。另外,为了评估金丝桃素抑制CBS的选择性,分别测定了不同浓度金丝桃素对CSE(另一种H2S合成酶)活性的影响,结果表明金丝桃素对CSE仅有非常微弱的抑制活性,IC50为83.0 ± 16.68 μmol/L(图1D),以上结果表明金丝桃素对CBS活性的抑制具有较高的选择性(相对于CSE)。
3.2 金丝桃素抑制HT29细胞的增殖
作者前期研究表明在HT29细胞中CBS蛋白存在高表达,而另一种H2S合成酶CSE表达量则非常低[16]。在本研究中使用亚甲蓝法测定HT29细胞裂解液中CBS和CSE蛋白的产H2S活性,反应液中加入PAG(普遍使用的CSE特异性抑制剂)或AOAA(CBS和CSE的抑制剂)。结果如图2A所示,未加抑制剂的HT29细胞裂解液产H2S活性为36.6 ± 1.13 nmol/h·mg 蛋白,当在细胞裂解液中加入2 mmol/L PAG或1 mmol/L AOAA后,H2S产生活性分别为33.1 ± 1.04 nmol/h·mg蛋白和6.3 ± 0.35 nmol/h·mg蛋白。因此,计算得知CSE来源的H2S产率为3.5 nmol/h·mg蛋白,CBS来源的H2S产率为26.8 nmol/h·mg蛋白,CBS来源H2S产率超过CSE来源H2S产率的8倍,以上结果表明CBS是HT29细胞中催化合成H2S的主要酶。另外,当在细胞裂解液中加入0.5 mmol/L金丝桃素后,H2S产生活性为7.7 ± 0.62 nmol/h·mg蛋白,表明金丝桃素和AOAA均能显著抑制细胞裂解液中CBS的产H2S活性。

图1 金丝桃素和AOAA剂量依赖性地抑制CBS活性Fig.1 Dose-dependent inhibition of CBS activity by hypericin and AOAA注: A.金丝桃素的化学结构;B.不同浓度金丝桃素对CBS活性的抑制曲线及其IC50值;C.不同浓度AOAA对CBS活性的抑制曲线及其IC50值;D.不同浓度金丝桃素对CSE活性的抑制曲线及其IC50值。Note:A.Chemical structure of hypericin;B and C.Dose-response curves of hypericin and AOAA versus CBS activity;D.Dose-response curves of hypericin versus CSE activity.
Szabo等研究表明CBS蛋白的高表达在促进结肠癌细胞增殖过程中起关键作用[5],因此本研究测定了金丝桃素和AOAA对HT29细胞增殖的影响。结果如图2B所示,金丝桃素抑制HT29细胞增殖的IC50值为22.2 ± 2.25 μmol/L。然而,目前普遍使用的CBS抑制剂AOAA对HT29细胞增殖的抑制作用非常微弱,其IC50值为152.5 ± 35.68 μmol/L。

图2 金丝桃素和AOAA对HT29人结肠癌细胞活力的影响Fig.2 Effects of hypericin and AOAA on the viability of HT29 human colon cancer cells注:A.不同抑制剂对HT29细胞裂解液催化合成H2S的影响;B.不同浓度金丝桃素对HT29细胞活力的影响;C.不同浓度AOAA对HT29细胞活力的影响。Note:A.The H2S-producing activities of CBS and CSE in the HT29 cell lysate were measured in the presence of PAG,AOAA or hypericin.*P<0.05,**P<0.01,***P<0.001;B.Effect of hypericin on the viability of HT29 colon cancer cells;C.Effect of AOAA on the viability of HT29 colon cancer cells.
AOAA作为一种极性小分子,细胞膜透性可能较差,这可能是导致AOAA对HT29细胞增殖抑制作用较弱的原因。
3.3 细胞内CBS可能是金丝桃素的靶标之一
为了研究在哺乳动物细胞中CBS蛋白是否作为金丝桃素作用的潜在靶标,利用siRNA干扰HT29细胞内CBS蛋白的表达,结果如图3A所示。Western blot结果表明与对照组相比siRNA干扰后细胞内CBS蛋白表达量减少到44%。接下来测定了金丝桃素对siRNA干扰后HT29细胞增殖的影响,结果如图3B所示。金丝桃素抑制细胞增殖的IC50为55.8 ± 5.30 μmol/L,是金丝桃素抑制未处理HT29细胞增殖IC50值的2.5倍。同时,AOAA抑制siRNA干扰后HT29细胞增殖的IC50值增加到304.5 ± 63.01 μmol/L(图3C)。这些结果表明在哺乳动物细胞内CBS蛋白可能是金丝桃素的靶标之一。

图3 金丝桃素对siRNA干扰后HT29细胞活力的影响Fig.3 Effects of hypericin on the viability of HT29 cells with siRNA-mediated knockdown of CBS.注:A.使用阴性对照siRNA(NC siRNA)或CBS靶向的siRNA(CBS siRNA)转染HT29细胞,细胞裂解液进行western blot 分析,使用甘油醛-3-磷酸脱氢酶(GAPDH)作为内参;B.不同浓度金丝桃素对siRNA干扰HT29细胞活力的影响;C.不同浓度AOAA对siRNA干扰HT29细胞活力的影响。Note:A.HT29 cells were transfected with a negative control siRNA (NC siRNA) or a CBS targeted siRNA (CBS siRNA) for 48 h;then,cell lysates were used for immunoblotting analysis.Glyceraldehyde 3-phosphate dehydrogenase (GAPDH) was used as the loading control;B.The IC50 value of hypericin against HT29 cells after the siRNA mediated knockdown of CBS was determined using the CCK-8 assay;C.The IC50 value of AOAA against HT29 CBS knockdown cells.
3.4 金丝桃素体内抗肿瘤活性
为了研究金丝桃素体内抗肿瘤活性,本研究建立了人结肠癌裸鼠原位移植瘤模型。当肿瘤体积达到约100 mm3时,注射高(30 mg/kg·d)、中(10 mg/kg·d)、低剂量(5 mg/kg·d)金丝桃素和AOAA(阳性药物对照组)进行2周给药。实验结果表明和溶剂对照组相比AOAA处理组(10 mg/kg·d)的小鼠体重显著性降低,说明目前普遍使用的CBS抑制剂AOAA对小鼠具有一定的毒副作用,但是各种剂量金丝桃素处理组(5~30 mg/kg·d)的小鼠体重与溶剂对照组相比均无显著性变化(表1)。
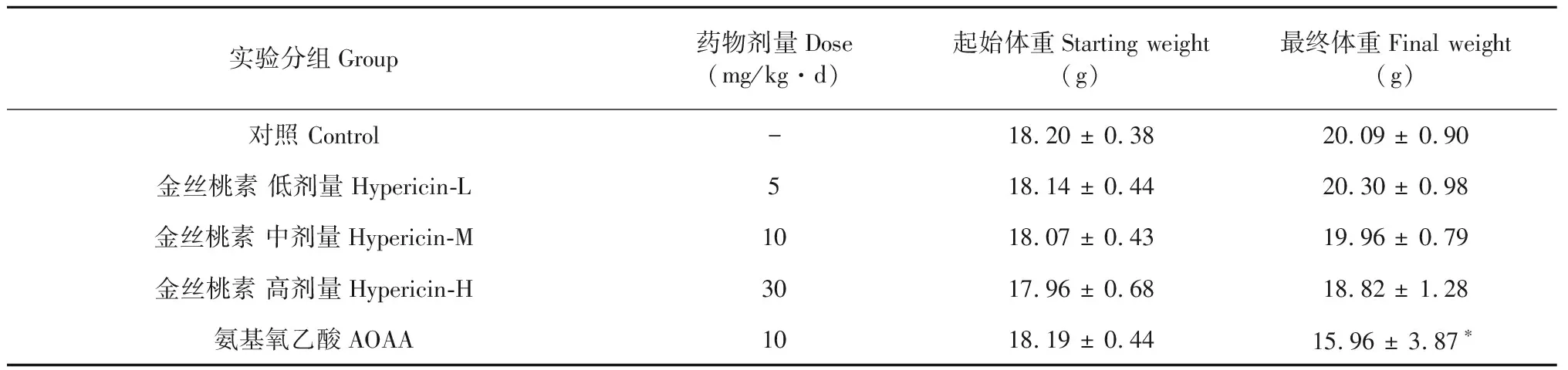
表1 不同药物处理对小鼠体重的影响
注:*P<0.05 表示和对照组相比,体重差异有统计学意义。
Note:Compared with control,*P< 0.05.
小鼠给药2周后被处死,剥离瘤体并称重。结果表明与溶剂对照组相比不同剂量的金丝桃素(5~30 mg/kg·d)与AOAA处理组均显著地抑制了肿瘤的生长(图4A-C),并且金丝桃素剂量依赖性地抑制肿瘤的生长。相对于溶剂对照组30 mg/kg·d剂量的金丝桃素以及AOAA处理分别使肿瘤重量减少了68%和86%(图4D),表明金丝桃素和AOAA均具有显著的抗结肠癌作用。然而,需要指出的是AOAA的体内抗肿瘤活性可能并不完全归因于其作为CBS的抑制剂。首先,CBS蛋白主要在细胞质中表达,AOAA必须透过细胞膜才能抑制CBS活性,继而抑制肿瘤生长。然而本研究表明AOAA仅有非常弱的抑制HT29结肠癌细胞增殖活性,其IC50值为152.5 ± 35.68 μmol/L(图2C)。其次,AOAA是PLP依赖酶的广谱性抑制剂,对CBS的选择性较差[10,11],AOAA在体内可能还有其它的靶标。综上所述,本研究结果表明金丝桃素在体内外均具有显著的抗结肠癌活性。

图4 金丝桃素抑制人结肠癌裸鼠移植瘤生长Fig.4 Hypericin inhibits tumor growth in human colon cancer xenograft models.注:A.不同给药处理2周的肿瘤外观(每组6只小鼠);B.不同给药处理肿瘤体积的变化情况;C.不同给药处理2周肿瘤的体积;D.不同给药处理2周肿瘤的重量。Note:A.The macroscopic appearance of tumors in BALB/c nude mice 14 days after treatment (n=6 per group);B and C.Hypericin treatment significantly reduced the tumor volume after the s.c.injection of HT29 cells in human tumor xenograft models.Each data point represents the mean ± SD (n=6);D.Mean tumor weight (±SD).*P< 0.05,**P< 0.01,***P< 0.001.
AOAA是目前唯一一种被广泛使用的CBS抑制剂,但其存在抑制作用弱和选择性差的不足,抑制HT29细胞增殖的IC50值高达152.5 ± 35.68 μmol/L。同时,本研究发现10 mg/kg·d剂量的AOAA对小鼠也具有一定的毒副作用,因此急需获得高效的CBS选择性抑制剂。金丝桃素是从金丝桃属植物中分离得到的一种天然光敏剂[17],被广泛用于肿瘤的诊断和光动力学治疗研究中[18,19],金丝桃素介导的光动力学治疗可以增强化疗药物顺铂对结肠癌细胞的抑制作用[20]。然而,金丝桃素作为硫化氢合成酶抑制剂的抗肿瘤活性未见报道。本研究结果表明金丝桃素作为CBS的选择性抑制剂在体内外均具有显著的抗结肠癌活性。综上所述,金丝桃素能作为CBS的选择性抑制剂用于结肠癌的治疗研究中。
