毛喉鞘蕊花提取物对大鼠哮喘模型炎症介质的影响及机制研究
2019-10-11彭小芝马朝芝涂仪军尤朋涛刘焱文
彭小芝,马朝芝,夏 雨,涂仪军,尤朋涛,2,刘焱文,2*
1湖北中医药大学药学院;2湖北中医药大学 中药资源与中药化学湖北省重点实验室,武汉 430065
哮喘(asthma)是一种由多种细胞组分及复杂细胞因子参与的对过敏性与非过敏性因素做出特异性反应的一种慢性气道炎症性疾病,其中IL-4、IL-17A和IFN-γ是参与调节哮喘气道炎症反应的重要细胞因子,这些细胞因子由辅助性T细胞(thelper cell,Th)分泌并调节炎症反应发展[1-3]。研究表明,许多炎症介质的合成和释放都依赖于丝裂原活化蛋白激酶(MAPK)通路的激活,MAPK通路参与了炎症因子产生、分化、凋亡等生理病理过程,阻断其级联反应,可减轻炎症症状[4,5]。因此,哮喘防治的关键在于对哮喘发病各环节分子机制的深入研究,从而从病因学、基因水平研制出针对哮喘的靶向治疗药物。
一直以来,支气管扩张药和皮质激素类药物是治疗哮喘的主要药物,但由于其长期服用易产生耐受性或不良反应,所以临床应用受到了一定的限制。因此,积极寻找更加安全有效的抗哮喘药物具有重要的实际意义。据《新华本草纲要》介绍,毛喉鞘蕊花味辛、性凉,具有散寒解表、祛痰止咳的功能,有降压、止痛、扩呼吸系统疾患[6-8]。课题组前期发现, CFE对呼吸道疾病具有良好的防治作用,对卵清蛋白致豚鼠扩张支气管、扩张血管和强心作用,可用于治疗感冒消炎、肺结核等哮喘有一定治疗作用[9]。本实验在此基础上,以大鼠作为研究对象,采用OVA诱导大鼠的哮喘模型,观察不同给药剂量CFE 对大鼠哮喘症状的改善情况,通过检测过敏性哮喘模型大鼠血清和BALF中IFN-γ、IL-4和IL-17A的含量水平,比较肺组织p-ERK、p-JNK和 p-p38的表达水平,检测CFE调控 MAPK信号通路上相关蛋白的表达,探讨其抑制哮喘炎症的作用机制,为过敏性哮喘的临床治疗提供依据,为相关基础和临床研究提供实验依据。
1 实验材料
1.1 实验动物
SPF级SD大鼠60只,体重160~180 g,雄性,购自湖北省疾病预防控制中心,动物质量合格证编号:SCXK(鄂)2015-0018。
1.2 材料与试剂
毛喉鞘蕊花(采摘于湖北省通城,经湖北中医药大学生药教研室吴和珍教授鉴定为唇形科鞘蕊属植物毛喉鞘蕊花正品);卵清蛋白(Ovalbumin,OVA)(美国Sigma公司);阿拉伯胶(上海麦克林生化科技有限公司);地塞米松(天津天药药液股份有限公司);氢氧化铝(分析纯,国药集团化学试剂有限公司);HE染液(碧云天生物技术有限公司);IL-4、IL-17A、IFN-γ ELISA试剂盒(武汉伊莱瑞特生物科技股份有限公司);MAPK抗体试剂盒(美国Cell Signaling Technology公司);ECL试剂盒(美国Bio-Rad公司)。
1.3 主要仪器
XR-YLS-8A多功能诱咳引喘仪(上海欣软信息科技有限公司);多功能酶标仪(瑞士Tecan公司);凝胶电泳电转仪(美国Bio-Rad公司);正置光学显微镜(日本Nikon Eclipse E100);成像系统(日本Nikon DS-U3)。
2 方法
2.1 毛喉鞘蕊花提取物制备
将毛喉鞘蕊花药材打碎成粗粉,置于渗漉桶内,用70%的乙醇浸泡过夜,次日以2 mL/min左右的速度开始进行渗漉,收集到的滤液进行减压浓缩,最终置于水浴锅上浓缩,得到浸膏(每克含4.24 g生药)。置冰箱中保存备用,用时将浸膏取出,置40~50 ℃的水浴中轻轻振摇均匀,称取适量的浸膏,用1%阿拉伯胶配制成相应浓度混悬液混匀备用,供实验动物灌胃使用。
2.2 动物模型建立
60只SD大鼠,随机分为5组,每组各12只,即空白组、模型组、地塞米松组、CFE高剂量组、CFE低剂量组。实验第1天和第8天向每只(除空白组)大鼠腹腔及皮下注射新鲜配制的OVA混悬液(100 mg OVA + 100 mg AL(OH)3生理盐水混悬)1 mL致敏,空白组给予同等剂量生理盐水。第15 天将各组大鼠置于雾化仪中,除空白组以生理盐水气雾攻击外,其余各组均喷入1%OVA生理盐水溶液雾化,自然吸入以诱发哮喘,每天1次,每次30 min,连续14天,以呼吸急促深快,烦躁呛咳,四肢搔抓,点头运动及粪便增多等症状的出现为激发成功。
2.3 给药方法
于实验第15天开始灌胃给药(1 mL/100 g),每次雾化吸入激发前1小时给予药物干预,空白组与模型组给予生理盐水,地塞米松组给予地塞米松2 mg/kg,CFE高剂量组、CFE低剂量组分别给予毛喉鞘蕊花提取物12.8、6.4 g/kg,每天1次,连续给药14天。
2.4 标本收集和处理
各组大鼠均在末次激发后24 h内取材。0.4%戊巴妥钠腹腔麻醉(1 mL/100 g 体重)后采集标本。外周血血清采集:将大鼠麻醉,固定、剖腹,分离腹主动脉,取血,2 500 rpm,离心10 min,分离得血清,负80 ℃冻存待测。支气管肺泡灌洗液(BALF)采集:将大鼠麻醉,分离出气管及肺组织,结扎右肺,用大鼠灌胃针头插入气管并结扎,抽取3 mL生理盐水对左肺进行灌洗,重复三次,将所得灌洗液收集于10 mL离心管,2 500 rpm,离心10 min,取上清分装待测。
2.5 肺组织标本制备及病理学检查
将大鼠麻醉,迅速打开胸腔,分离肺组织,取右肺组织,用4%甲醛固定24 h后常规石蜡包埋、切片。HE染色后,进行病理图像分析。
2.6 ELISA法检测血清和BALF中IL-4、IL-17A和IFN-γ含量
按ELISA试剂盒说明书进行操作,在终止反应后5 min内,酶标仪于450 nm波长处检测各孔吸光度,计算IL-4、IL-17A和IFN-γ含量。
2.7 Western blot法检测肺组织p-ERK、p-JNK和p-p38MAPK蛋白表达
取部分肺组织,剪碎,滴加RIPA裂解液(含PMSF),冷冻研磨成匀浆,冰上孵育30 min裂解,离心15 min,取上清液。BCA蛋白定量分析盒检测蛋白浓度,上样到SDS-PAGE胶,电泳分离,将蛋白转移至NC膜上(300 mA恒流,60 min)。转膜完成后,5% BSA封闭液室温封闭2 h,TBST洗涤10 min(3次),分别使用p-ERK、p-JNK和p-p38(1∶1 000)及GAPDH (1∶10 000)一抗,4 ℃孵育过夜,TBST洗涤10 min (3次),将NC膜与二抗(1∶2 000)室温孵育1h,TBST洗涤10 min(3次),ECL试剂盒化学发光法检测蛋白条带,曝光、显影、定影后,凝胶图像处理系统对蛋白条带进行分析,计算目的蛋白相对表达。
2.8 统计学处理

3 结果
3.1 CFE改善OVA诱导的大鼠肺组织病理形态学变化
如图1所示,空白组大鼠气道上皮结构完整,支气管管壁光滑,上皮纤毛细胞排列整齐,管腔内未见上皮细胞脱落,肺组织形态结构清晰完整;模型组大鼠气道明显狭窄,支气管杯状上皮细胞排列紊乱,结构不完整,纤毛细胞脱落明显,固有层明显增厚,黏膜层明显增厚;与模型组相比,给药组大鼠固有层增厚程度较轻,黏膜层增厚较模型组降低,其中地塞米松组大鼠支气管结构完整,管壁细胞排列紊乱,上皮细胞及杯状细胞脱落减少,管径正常;CFE高剂量组、CFE低剂量组支气管黏膜上皮细胞及杯状细胞增生减少,支气管稍变形,管壁及平滑肌厚度明显降低,以上变化均随药物剂量加大更显著。
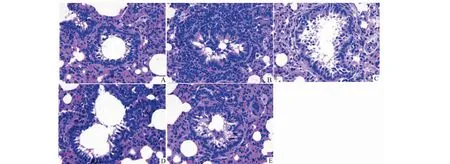
图1 各组大鼠肺组织HE染色Fig.1 HE staining results of lung tissue of rats in different groups注:A~E分别为空白组、模型组、CFE低剂量组、CFE高剂量组、地塞米松组。Notes:A-E were blank group,model group,low dose CFE group,high dose CFE group,Dexamethasone group.
3.2 CFE减轻OVA对大鼠血清和BALF中IL-4、IL-17A和IFN-γ含量的影响
如图2所示,与模型组比较,地塞米松组和CFE高剂量组、CFE低剂量组IL-4、IL-17A含量均有不同程度降低(P<0.05,P<0.01),IFN-γ含量升高(P<0.05)。在血清和BALF中,CFE高剂量组IL-4含量显著降低(P<0.01),含量接近于空白组,IL-17A含量明显降低(P<0.05),IFN-γ含量水平有显著性差异(P<0.05);CFE低剂量组IL-17A、IFN-γ含量无显著性差异。血清中地塞米松组IL-4、IL-17A含量明显降低(P<0.05),而在BALF中IL-4、IL-17A中含量变化无显著性差异,IFN-γ在血清和BALF中含量明显升高(P<0.05)。

图2 各组大鼠血清和BALF中IL-4、IL-17A和IFN-γ含量Fig.2 The levels of IL-4,IL-17A and IFN-γ in serum and BALF in different groups注:A~E分别为空白组、模型组、CFE低剂量组、CFE高剂量组、地塞米松组;与模型组比较:*P<0.05,** P<0.01。Notes:A-E were blank group,model group,low dose CFE group,high dose CFE group,Dexamethasone group;Compared with the model group:*P<0.05,**P<0.01.
3.3 CFE调控OVA诱导大鼠中MAPK相关通路蛋白表达
如图3所示,与模型组比较,地塞米松组和CFE高剂量组、CFE低剂量组p-ERK、p-JNK及p-p38MAPK蛋白表达均有不同程度的降低。CFE高低剂量组p-ERK蛋白表达均有显著降低 (P<0.01),CFE高剂量组p-JNK及p-p38MAPK蛋白表达均有显著降低(P<0.05),而CFE低剂量组p-JNK及p-p38MAPK蛋白表达无显著性差异,地塞米松组p-ERK、p-JNK及p-p38MAPK蛋白表达有显著降低(P<0.05)。
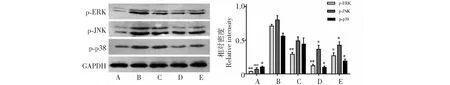
图3 各组大鼠肺组织p-ERK、p-JNK及 p-p38蛋白表达Fig.3 The expressions of p-ERK、p-JNK and p-p38 proteins in lung tissues of different groups注:A~E分别为空白组、模型组、CFE低剂量组、CFE高剂量组、地塞米松组;与模型组比较:*P<0.05,**P<0.01。Notes:A-E were blank group,model group,low dose CFE group,high dose CFE group,Dexamethasone group;Compared with the model group:*P<0.05,**P<0.01.
4 结论
现有研究表明, 作为哮喘炎症反应的调节器, Th1、Th2、Th17等Th淋巴细胞亚群主要通过分泌细胞因子来实现其功能[10]。Th17细胞可产生IL-17A, IL-17A是一种具有强大的招募中性粒细胞的前炎性细胞因子,与许多炎症反应和自身免疫性疾病的发生和发展有关。它能够促进多种细胞释放炎性因子,它可以促使气道黏液腺分泌大量黏液,增加气道的高反应性,从而在哮喘气道重塑的过程中发挥重要的作用[11],IL-4则是具有多种生物学效应的前炎性Th2细胞因子代表[12],而IFN-γ是作为一种Th1 型细胞因子,具有强大的免疫调节作用,研究证实IFN-γ在胞内细菌感染时有一定的保护作用,并参与自身免疫病的发生[13]。在过敏性哮喘中,IFN-γ与气道单核细胞及中性粒细胞浸润有关,并能抑制Th2细胞产生IL-4,对哮喘有一定的保护作用[14]。本研究显示CFE高、低剂量组均能明显上调大鼠血清和BALF中IFN-γ水平,下调IL-4和IL-17A水平,证实CFE可通过调节Th1细胞与Th2细胞之间的动态平衡,抑制血清和BALF中IL-17A以降低气道高反应性,达到抗炎和调节免疫的作用,从而对过敏性哮喘起到治疗作用。
MAPK信号通路是细胞中一条重要的分子通路,由多种同工酶组成,包括细胞外调节蛋白激酶(ERK),c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK) 和p38MAPK等。JNK通路和p38MAPK通路主要对炎性细胞因子和多种类型的细胞应激信号进行转导,而ERK通路主要对细胞的生长、分裂和分化信号进行转导,他们之间可以通过不同因素刺激激活,形成不同的转导通路,激活不同的转录因子,介导不同的生物学效应,通路间可产生相互协同或抑制作用[15]。经CFE干预治疗后,大鼠肺组织p-ERK、p-JNK及p-p38 蛋白表达显著下降,表明CFE能通过调控MAPK信号通路蛋白表达减轻哮喘气道炎症,延缓支气管病理性损伤。
综上所述,毛喉鞘蕊花提取物能抑制哮喘炎症发生,其对哮喘炎症反应的保护作用可能与下调机体的IL-4、IL-17A,上调IFN-γ等细胞因子和炎性反应介质有关,其作用机制可能是通过调节MAPK信号通路相关蛋白表达来干预炎症发生发展,从而阻断炎症级联反应,改善哮喘症状,发挥治疗作用。
