苹果类泛素蛋白MdRAD23C2基因的分离及功能鉴定
2019-10-10豆芳芳龚小庆邹养军
豆芳芳,龚小庆,邹养军
(1 西北农林科技大学 园艺学院/旱区作物逆境生物学国家重点实验室,陕西 杨凌 712100;2 广元市农业科学研究院,四川 广元 628017)
类泛素蛋白RAD23(radiation sensitivity protein-23),是UBL-UBA家族中的一种转运蛋白,其主要功能为蛋白损伤修复[1-2]和蛋白酶体降解[3-5]。该类蛋白中有4个明显的结构域,包括2个可以结合泛素或泛素化蛋白的UBA结构域[6-9],1个与蛋白酶体受体结合的UBL结构域(如Rpn1、Rpn10、Rpn13等)[10-11],以及1个位于2个UBA结构域之间的RAD4/XPC结构域[4]。在2个UBA结构域中,起主要调控作用的是位于C端中心区域的UBA1结构域,靠近C端末尾的UBA2区域缺失并不影响RAD23的泛素结合功能[12];而RAD23的UBL结构域磷酸化可以显著改变其与蛋白酶的互作效应[13]。
RAD23蛋白最早发现于酵母(Saccharomycescerevisiae)中,功能为参与DNA的损伤修复[14-15]。UV射线造成核酸损伤时,RAD23蛋白将富集到受损位点,参与核酸的损伤修复[5],RAD4与RAD23互作可以提高拟南芥对UV射线的抗性[16]。此外,酵母RAD23蛋白还会导致光敏性皮肤疾病加重[17]。除了参与核酸修复,RAD23蛋白还是26S蛋白酶系统(UPS)的关键组分,其可将泛素化底物运送至蛋白酶体,促使后者降解错误折叠的蛋白[18-19]。在模式植物拟南芥中的研究也证实,RAD23蛋白是UPS系统不可或缺的组分,负责将底物蛋白运送至26S蛋白酶体,是拟南芥生长发育必需的蛋白[20]。同时,由于RAD23缺乏蛋白酶体起始结构域,不会被蛋白酶体降解,因此能在体内稳定存在[21-22]。RAD23蛋白中这些特定的结构域,使其能选择性地与靶蛋白特定位点结合,参与调控蛋白的泛素化过程,从而为蛋白酶体精确降解靶蛋白奠定基础。
目前,出芽酵母、人类、水稻、玉米、拟南芥和松树中的RAD23基因家族已被分离鉴定。苹果(Malusdomestica)作为多年生木本植物中重要的果树植物,有关其RAD23基因和功能的研究甚少。因此,本试验克隆了苹果MdRAD23C2基因,将其转入烟草,研究其抗旱功能,以期为抗旱苹果新品种的培育奠定基础。
1 材料与方法
1.1 材 料
苹果为栽植于西北农林科技大学园艺场的1年生秦冠(Malusdomesticacv.‘Qinguan’)幼苗。野生型烟草(Nicotiananudicaulis)种子由华中农业大学刘继红教授馈赠。
本氏烟草(Nicotianabenthamiana)种子由西北农林科技大学旱区作物逆境生物学国家重点实验室保存。
RNAiso Plus试剂盒、大肠杆菌Top10感受态、DNA胶回收试剂盒、质粒抽提试剂盒、快速DNA提取试剂盒,均购自北京天根生化科技有限公司;D2000 DNA分子Marker、BamHⅠ、KpnⅠ、克隆载体pMD19-T、PrimeSTAR MAX Premix(2×)、rTaqTM、T4-DNA连接酶、DNA A-Tailing Kit、SYBR®Premix ExTaqTMⅡ (Tli RNaseH Plus),均购自TaKaRa生物工程有限公司;RevertAidTMFirst Strand cDNA Synthesis Kit、Gateway®BP Clonase®Ⅱ Enzyme mix、Gateway®LR Clonase®Ⅱ Enzyme mix,均购自赛默尔科技(中国)有限公司;MDA试剂盒、超氧阴离子和过氧化氢测定试剂盒,均购自南京建成生物科技有限公司;其他试剂均购自上海源叶生物科技有限公司。GV3101菌株、pDONR222载体、pGWB405载体、pCAMBIA2300载体,均由西北农林科技大学旱区作物逆境生物学国家重点实验室保存。
共聚焦显微镜,LFM150 META,德国;Stepone Plus System PCR仪,ABI,美国。引物合成及测序均由西安擎科生物有限公司完成。
1.2 方 法
1.2.1 苹果材料的逆境处理 选择长势一致的1年生秦冠(Malusdomesticacv.‘Qinguan’)幼苗,置于不同逆境下处理,并于相应时间点取样,取样位置为自顶端而下5~8片叶。干旱处理前,将所用材料浇水至饱和,自然干旱0,4,6,8,10 d取样,对照组土壤含水量保持在50%左右。盐处理时,用200 mmol/L NaCl浇灌材料,于0,1,3,6,12,24 h取样,对照组喷施蒸馏水。碱胁迫处理时,用1 mol/L Na2CO3/NaHCO3(体积比为1∶1)配成碱性水溶液(pH=8.5)浇灌材料,于0,1,3,6,12,24 h取样,对照组喷施蒸馏水。ABA处理时,以100 mmol/L ABA进行叶面喷施,于0,1,3,6,12,24 h取样,对照组喷施蒸馏水。所取样品置于液氮中速冻,-80 ℃保存待用。
1.2.2 苹果材料RNA提取 用RNAiso Plus试剂盒提取不同逆境处理秦冠叶片的总RNA,采用RevertAidTMFirst Strand cDNA Synthesis Kit反转录合成cDNA,-20 ℃保存待用。
1.2.3MdRAD23C2基因克隆 根据苹果基因组检索序列设计引物MdRAD23C2-S/A,在引物上分别加入BamHⅠ和KpnⅠ酶切位点(表1),以干旱处理的秦冠叶片cDNA为模板进行PCR扩增。反应体系为:12.5 μL PrimeSTAR MAX Premix(2×),1 μL cDNA,1 μL正向引物,1 μL反向引物,并以离子水补充至25 μL。反应条件为:94 ℃ 2 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min(共35个循环)。PCR反应结束后,将扩增产物用1.0%的琼脂糖凝胶进行电泳检测并切胶回收,经测序确认目标序列,将该基因命名为MdRAD23C2。
1.2.4MdRAD23C2序列生物信息学分析 登录GDR网站,将拟南芥氨基酸(AtRAD23C,AT3G02540)进行序列Blastp,可得到苹果蛋白序列(genome database of rosaceae;GDR;http://www.rosaceae.org)。在PLAZA(https://bioinformatics.psb.ugent.be/plaza/versions/plaza_v3_dicots/)网站上进行Blastp,下载与MdRAD23C2同源性较高的不同物种的氨基酸序列,利用DNAMAN 6.0软件对这些氨基酸进行多序列比对;利用MEGA 5.0软件,通过Neighbor-joining方法构建系统进化树,设置Bootstrap数值为1 000。利用NCBI数据库(http://www.ncbi.nlm.nlm.gov/)获得MdRAD23C2全长基因组序列;MdRAD23C2发挥功能主要依靠其启动子区域的顺式作用元件,因此选取MdRAD23C2基因起始密码子前的1 500 bp片段为启动子区域,用于预测其顺式作用元件。
1.2.5MdRAD23C2的逆境响应分析 设计基因特异引物MdRAD23C2-F/R(表1),以不同逆境处理的秦冠叶片cDNA为模板,使用SYBR®Premix ExTaqTMⅡ (Tli RNaseH Plus)进行实时定量PCR分析,内参基因为β-actin(表1)。反应体系为:5 μL SYBR®Premix ExTaqTM,0.5 μL cDNA,0.2 μL正向引物,0.2 μL反向引物,加去离子水补充至10 μL。反应条件为:95 ℃ 30 s;95 ℃ 5 s,56 ℃ 10 s,72 ℃ 15 s,共 40 个循环。每个样品重复4次。用2-ΔΔCT法计算MdRAD23C2相对表达量。

表1 本试验所用引物序列
注:引物MdRAD23C2-S/A序列中的下划线部分分别为BamHⅠ和KpnⅠ酶切位点。
Note:The under lined zones of MdRAD23C2-S/A indicateBamHⅠ andKpnⅠ digestion sites,respectively.
1.2.6 MdRAD23C2蛋白的亚细胞定位 利用Gateway技术构建MdRAD23C2::GFP融合表达载体。根据目标序列设计带有attb位点的引物MdRAD23C2-attb1/attb2(表1),扩增获得目标片段。利用BP反应将目标片段克隆至中间载体pDONR222上,经测序确认序列无误后,通过LR反应将目标片段从中间载体pDONR222重组克隆至表达载体pGWB405(带有GFP蛋白标签)上,以构建MdRAD23C2::GFP融合表达载体。利用农杆菌介导转化法,将构建成功的融合表达载体在生长4周的本氏烟草(Nicotianabenthamiana)表皮细胞中瞬时表达。注射2~3 d后,用共聚焦显微镜观察融合蛋白的表达。
1.2.7MdRAD23C2过表达载体的构建 在测序正确的PCR回收产物3′端添加A碱基后连接pMD19-T克隆载体,培养16~24 h后,进行菌落PCR检测,同时提取质粒。用BamHⅠ和KpnⅠ双酶切pCAMBIA2300载体和目标载体质粒,电泳回收pCAMBIA2300线性片段和目标载体片段。将回收的片段进行重组连接,构建pCAMBIA2300-MdRAD23C2过表达载体。将重组的过表达载体用冻融法转化农杆菌,用于烟草转化。
1.2.8 农杆菌侵染烟草及阳性植株的筛选 将野生型烟草(Nicotiananudicaulis)种子于4 ℃下春化3 d后,用体积分数70%乙醇表面灭菌30 s,HClO灭菌10 min,之后用灭菌水清洗3次,重悬于0.1%琼脂糖溶液中,播种在MS培养基上。光照培养箱中培养温度为(25±2) ℃,光照条件为:16 h光照(55~75 μmol/(m2·s)),8 h黑暗。
待烟草生长4周,采用叶盘法进行烟草转化,获得再生植株。分别用快速DNA提取试剂盒和RNAiso Plus试剂盒提取烟草再生植株叶片的DNA和RNA,以MdRAD23C2-F/R(特异引物)和35S-F/MdRAD23C2-A(载体引物)引物对转基因烟草DNA水平进行检测,以35S-F/MdRAD23C2-A引物对转基因烟草RNA水平进行检测,鉴定出阳性转基因株系。将获得的阳性烟草株系生根移栽,收获种子用于后续试验。
1.2.9 转基因烟草的抗旱能力 将转基因烟草和野生型烟草种子于4 ℃下春化3 d后直接播种于育苗基质中,待露白后播于营养钵中,每个营养钵4株。待生长4周后,选取长势一致的烟草幼苗进行干旱胁迫。干旱处理前,将所用材料浇水至饱和,至水能够自然渗出为止。每个株系28株,干旱处理2周。
干旱处理2周后,待烟草出现萎蔫时,按徐新娟等[23]的方法测定相对电导率,按Liu等[24]的方法测定叶绿素a、b及总叶绿素含量,采用MDA试剂盒、超氧阴离子和过氧化氢试剂盒测定MDA、超氧阴离子和过氧化氢含量。二氨基联苯胺(diaminobenzidine,DAB)和氮蓝四唑(tetranitroblue tetrazolium chloride,NBT)染色参考龚小庆[25]的方法进行,待烟草叶片有明显染色现象时(DAB褐色、NBT蓝色),置于甘油/乳酸/无水乙醇脱色液(三者体积比为1∶1∶3)中,沸水煮沸10 min,蒸馏水清洗3次,再置于体积分数80%乙醇中,继续脱色至叶片完全脱绿,用蒸馏水清洗,铺于玻璃板上,拍照保存,以观察烟草叶片的染色程度。
2 结果与分析
2.1 MdRAD23C2的克隆及序列分析
PCR扩增结果显示,以秦冠苹果叶片cDNA为材料,克隆得到一条长1 000~2 000 bp的条带(图1),与预期片段大小一致。经测序分析,MdRAD23C2序列长1 146 bp,编码381个氨基酸。将不同物种RAD23C蛋白的氨基酸序列进行比对,用MEGA 5.0软件构建系统进化树发现,同源氨基酸序列的一致性达68.84%(图2),2个苹果与梨的RAD23C蛋白亲缘关系最近,与水稻、玉米的亲缘关系较远(图3)。预测的MdRAD23C2启动子区域顺式作用元件包括AE-box(光响应元件)、ARE(厌氧诱导元件)、TATC-box(赤霉素响应元件)、CGTCA-motif(茉莉酸响应元件)、ERE(乙烯响应元件)、MBS(干旱诱导元件)和P-box(赤霉素响应元件)(表2)。

M.Marker;1.扩增序列

黑色区域为完全一致的氨基酸残基,灰色区域为相似度在50%以上的氨基酸残基;MdRAD23C1.苹果;MdRAD23C2.苹果;AtRAD23C.拟南芥;OsRAD23C.水稻;PyRAD23C.梨;ZmRAD23C.玉米The black region represents exactly same amino acid residues,and the gray region represents more than 50% similarity; MdRAD23C1.Malus Domestica;MdRAD23C2.Malus Domestica;AtRAD23C.Arabidopsis thaliana;OsRAD23C.Oryza sativa;PyRAD23C.Pyrus bretschneideri;ZmRAD23C.Zea mays
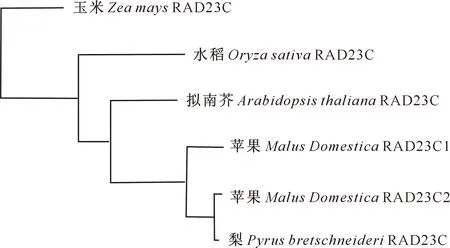
图3 不同植物RAD23C的系统进化分析
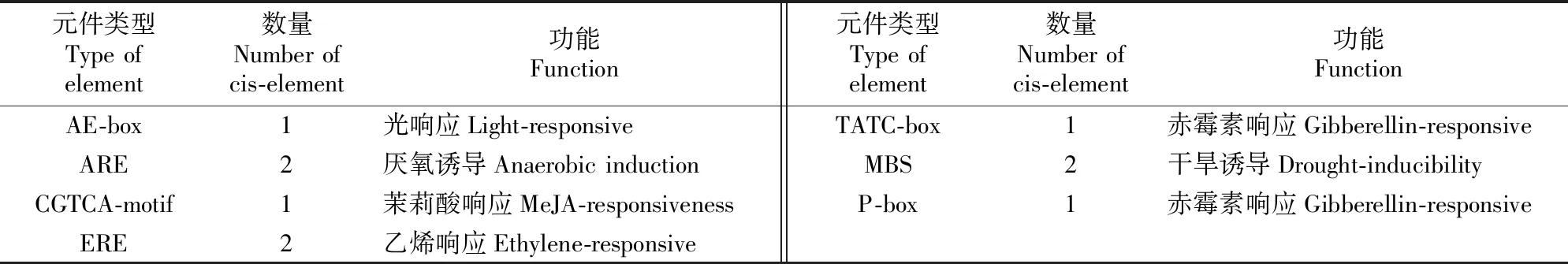
元件类型Type of element数量Number of cis-element功能Function元件类型Type of element数量Number of cis-element功能FunctionAE-box1光响应Light-responsiveTATC-box1赤霉素响应Gibberellin-responsive ARE2厌氧诱导Anaerobic induction MBS2干旱诱导Drought-inducibility CGTCA-motif1茉莉酸响应MeJA-responsiveness P-box1赤霉素响应Gibberellin-responsiveERE2乙烯响应Ethylene-responsive
2.2 MdRAD23C2的逆境响应分析
利用实时定量PCR分析MdRAD23C2对不同逆境的响应,结果显示,MdRAD23C2可被干旱诱导表达,4 d时MdRAD23C2相对表达量约为起始表达量的11倍(图4-A);盐胁迫也可明显诱导MdRAD23C2表达,12 h时MdRAD23C2相对表达量约为起始表达量的5倍(图4-B);碱胁迫亦能诱导MdRAD23C2的表达(图4-C);但ABA基本不能诱导MdRAD23C2的表达(图4-D)。

A.干旱胁迫;B.盐胁迫;C.碱胁迫;D.ABA胁迫
2.3 MdRAD23C2蛋白的亚细胞定位
将构建的MdRAD23C2::GFP融合蛋白在本氏烟草叶片中瞬时表达,结果如图5所示。图5显示,GFP蛋白的荧光分布于整个细胞,而融合蛋白的荧光分布于细胞核和细胞膜中,表明MdRAD23C2既可定位于细胞核,也可定位于细胞膜。
2.4 转MdRAD23C2基因烟草的鉴定
如图6所示,在阳性转基因烟草植株中可扩增出目标条带,而非阳性转化植株中无此条带。最后确定1,3,10和13号株系为转基因株系。选取3和10号株系2个转基因株系分别标记为C3和C10。
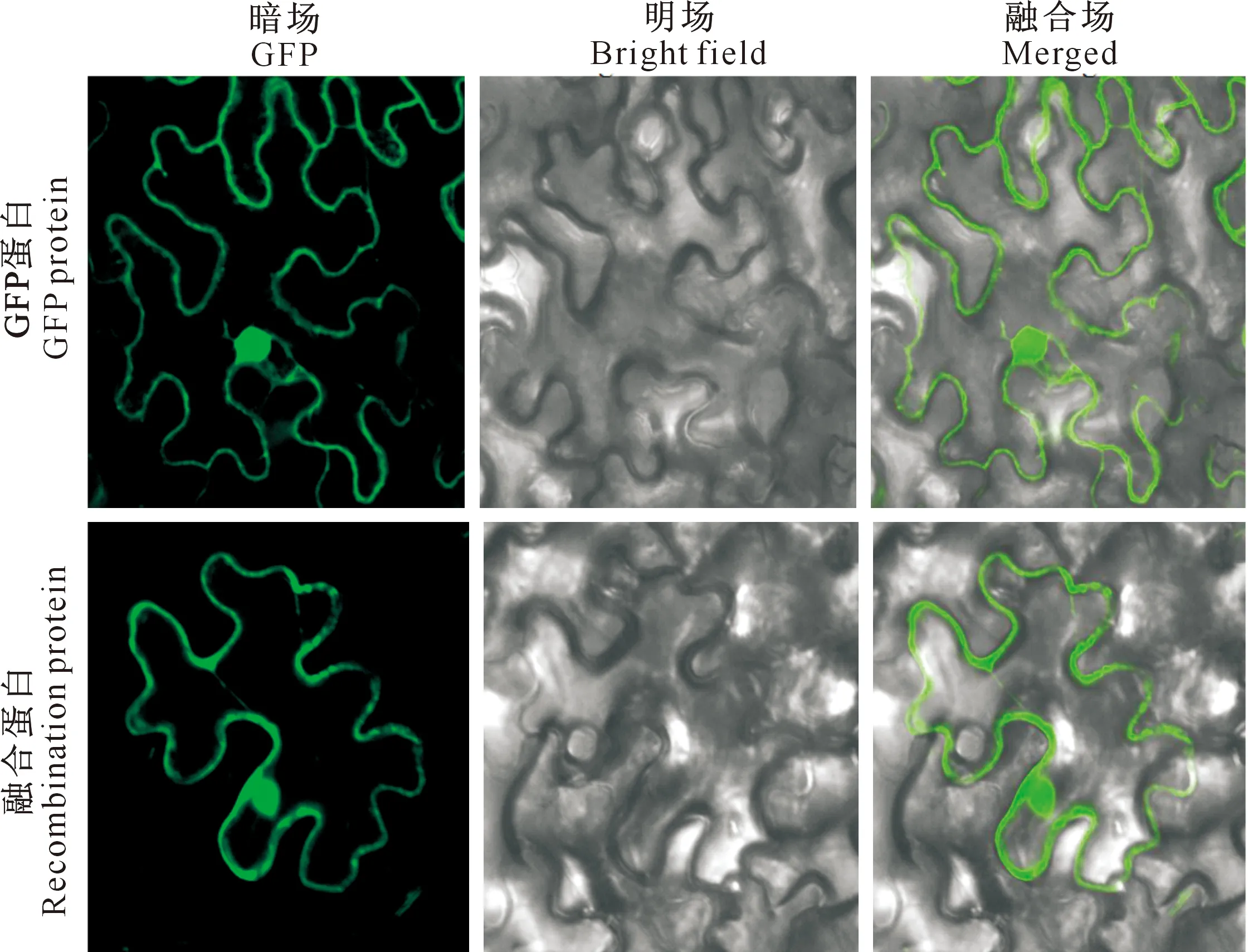
图5 苹果MdRAD23C2蛋白的定位分析

“+”和“-”分别代表阳性和阴性对照,1~14代表不同株系。A.DNA水平;B.RNA水平“+” and “-” indicate positive and negative controls,1-14 show different lines,respectively. A.Identification via DNA;B.Identification via RNA
2.5 转MdRAD23C2基因烟草对干旱胁迫的响应
MdRAD23C2对转基因烟草抗旱性的影响见图7和图8。图7显示,对生长4周的转基因烟草和野生型烟草进行干旱处理,2周后野生型烟草萎蔫情况明显。图8显示,干旱胁迫下转基因烟草的相对电导率和丙二醛含量均极显著低于野生型烟草,而叶绿素含量极显著高于野生型烟草,说明转基因烟草在干旱胁迫下细胞受到的伤害较小,对干旱胁迫有一定的耐受能力。

WT.野生型烟草;C3和C10.转基因烟草。下图同WT.Wild-type tobacco;C3 and C10.Transgenic tobacco plants.The same below 图7 MdRAD23C2转基因烟草抗旱处理2周后的生长状况

图柱上标不同字母表示不同株系间有极显著差异(P<0.01)。下图同Different letters mean highly significant difference between tobacco plants (P<0.01).The same below
图9,10显示,干旱胁迫下MdRAD23C2过表达转基因烟草中活性氧积累明显少于野生型;干旱处理野生型烟草叶片DAB染液中有较大面积深褐色染色,NBT染液中则有更明显的蓝色显色。干旱胁迫下野生型烟草中超氧阴离子及过氧化氢的积累极显著高于转基因株系。该结果表明,MdRAD23C2过表达降低了干旱胁迫对转基因烟草的氧化伤害,增强了转基因烟草对干旱胁迫的耐受性。
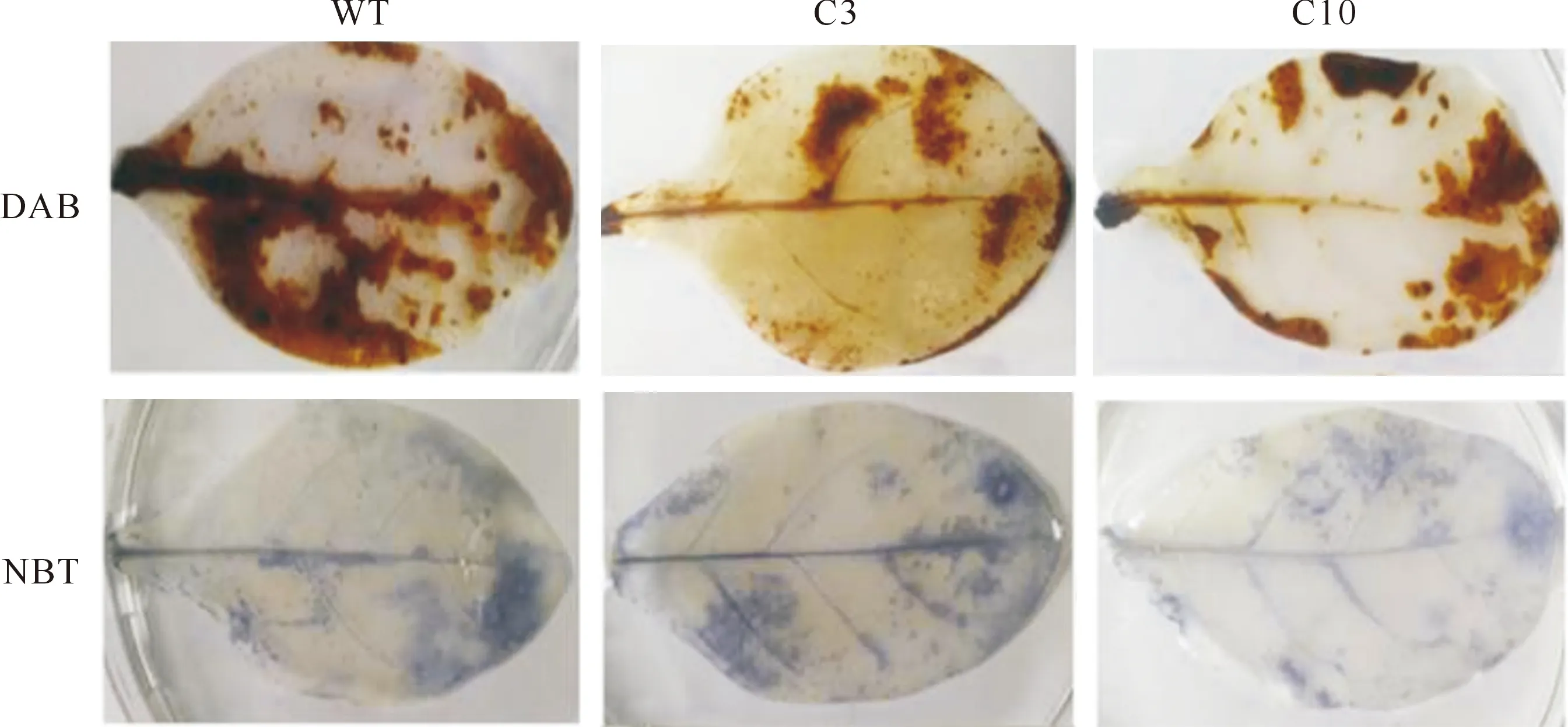
图9 MdRAD23C2过表达转基因烟草的DAB和NBT染色结果

图10 MdRAD23C2过表达对转基因烟草超氧阴离子和过氧化氢含量的影响
3 讨 论
本研究通过PCR扩增分离得到苹果MdRAD23C2,其编码区长1 146 bp,编码381个氨基酸,该蛋白定位于细胞核和细胞膜中。苹果MdRAD23C2启动子区域含有许多与胁迫响应相关的顺式作用元件,如AE-box、TATC-box、P-box、CGTCA-motif、ERE、MBS和ARE。本试验结果表明,MdRAD23C2可以响应干旱、盐、碱等逆境胁迫,这与Wang等[26]的试验结果一致,表明该基因或许在植物应答逆境胁迫中发挥着重要的功能,但对ABA胁迫无响应,这与水稻RAD23参与ABA信号调控[27-28]的研究结果不一致。可能是由于苹果启动子区域不含响应ABA的ABRE元件所致。
相对电导率和MDA含量可以表征膜的受损程度。本研究发现,MdRAD23C2转基因烟草质膜的相对透性和MDA含量显著降低,总叶绿素含量显著增加。同时,MdRAD23C2过表达也可降低转基因烟草中过氧化氢及超氧阴离子的积累,减轻氧化伤害。活性氧积累会引起蛋白功能受损,阻断DNA复制和转录,造成细胞死亡或异常蛋白[29];干旱条件下转基因烟草耐旱性增强,可能也与XPC/RAD4结构域参与核酸损伤修复有关[30]。
MdRAD23C2作为UPS系统中的转运蛋白,极有可能通过降解特定的靶蛋白参与植物对干旱胁迫的响应。因而未来将通过筛选MdRAD23C2的互作基因,进一步验证该基因的生物学功能,以揭示MdRAD23C2在植物干旱胁迫响应中的功能机制。
