奶山羊IL-6与TGF-β1融合蛋白的制备及其活性检测
2019-10-10董佳易倪思璐张煜琛陈德坤
庞 明,董佳易,倪思璐,管 雄,张煜琛,陈德坤
(1西北农林科技大学 动物医学院,陕西 杨凌 712100;2陕西省咸阳市食品药品检验检测中心,陕西 咸阳712000)
近几年来,国内奶山羊养殖数量不断增加,养殖地区也突破原有的省份并不断向国内多个地区辐射[1]。受自然牧草资源的限制,目前我国奶山羊饲养模式主要以舍饲养殖为主[2],这种饲养模式有很多优点,但其养殖群体中多种疫病的发生率也明显高于放牧养殖群体,其中严重影响奶山羊养殖经济效益的疫病主要有乳房炎、传染性胸膜肺炎和羊口疮等[3-5],这些疫病以奶山羊乳房、肺脏和口唇部呈现严重的病理性炎症反应为主要特征,在奶山羊舍饲养殖群体中普遍流行。国内奶山羊隐性乳房炎检出率为30%~85%[6],羊口疮的检出率为15%~90%[4,7],羊传染性胸膜炎的发病率为19%~90%[5]。造成这种现状的主要原因是针对性防控措施不得力,其根源在于对这些疫病病原的免疫防御机制不清楚。
在炎症性疫病发病过程中,受促炎性细胞因子和趋化因子的影响,多种免疫细胞被募集到炎症部位,通过吞噬和分泌作用清除病原微生物。伴随这一过程的是反应部位自身组织细胞也会受到损伤并发生病理学变化,进而影响到机体生理功能的正常发挥。大量研究表明,作为典型的促炎性细胞因子之一,白细胞介素6 (Interleukin-6,IL-6)水平在炎症过程中会显著升高,其增高幅度与炎症反应的严重程度呈正相关[8]。与此相反,转移生长因子-β(Transforming growth factor-β,TGF-β)则属于炎症反应抑制性细胞因子,TGF-β分为TGF-β1、TGF-β2和TGF-β3,其中TGF-β1在机体炎症反应过程中起重要的免疫调节作用[9]。令人感兴趣的是,当微环境中的IL-6和TGF-β水平同时有所升高时,就会介导一种新发现的T细胞亚群,即Th17细胞的产生[10-11]。
有研究指出,Th17细胞在炎症疾病发生过程中发挥着至关重要的作用,Th17细胞可以通过分泌IL-17等细胞因子来募集、活化中性粒细胞到达炎症部位并清除病原体,从而介导免疫反应维持机体自稳[12-13]。有研究证明,在小鼠模型中,TGF-β1和IL-6共刺激可使小鼠Th(辅助性T细胞)分化为Th17细胞[11,14],而在体外只需要IL-1和IL-6细胞因子即可诱导人Th17的产生[15-16]。在奶山羊的炎症发病过程中,IL-6和TGF-β1等主要炎症相关细胞因子的作用及其与Th17细胞分化的关系等至今未得到阐明,尤其是奶山羊乳房炎、羊口疮等炎症疫病的病原免疫防御机制问题至今尚不清楚,给针对性地制定这些疫病的高效防控措施带来了困难。基于此,本研究对奶山羊IL-6和TGF-β1基因进行了克隆表达,并对其表达产物的活性进行了检测,旨在为IL-6和TGF-β1等细胞因子在奶山羊炎性疾病中的作用机制研究提供有益的参考资料,进而为奶山羊疫病防控措施的制定提供参考依据。
1 材料与方法
1.1 材 料
雌性22月龄健康萨能奶山羊,购自陕西咸阳某羊场。大肠杆菌 DH5α和BL21 (DE3)、质粒pET-32a,由西北农林科技大学动物医学院兽医免疫学实验室保存。Total RNA提取试剂盒、限制性核酸内切酶(BamH Ⅰ、XhoⅠ和EcoR Ⅰ)、T4连接酶、SYBR Premix ExTaqTMⅡ试剂盒和镍柱纯化试剂盒,均购自TaKaRa生物技术有限公司。刀豆蛋白A(ConA),购自Solarbio科技有限公司。SanPrep柱式DNA胶回收试剂盒、SanPrep 柱式质粒DNA小量抽提回收试剂盒,均购自生工生物工程有限公司。FastKing RT Kit (With gDNase),购自天根生化科技有限公司。pClone007 Blunt Simple Vector Kit,购自擎科生物技术有限公司。
1.2 试验方法
1.2.1IL-6与TGF-β1基因的RT-PCR扩增 根据NCBI中收录的山羊TGF-β1(GenBank号为:NM_001314142.1)和IL-6(GenBank号为:NM_001285640.1)mRNA CDS区序列,分别用NCBI中Primer blast在线工具和Primer 5.0设计引物(表1),并由Invitrogen公司合成。
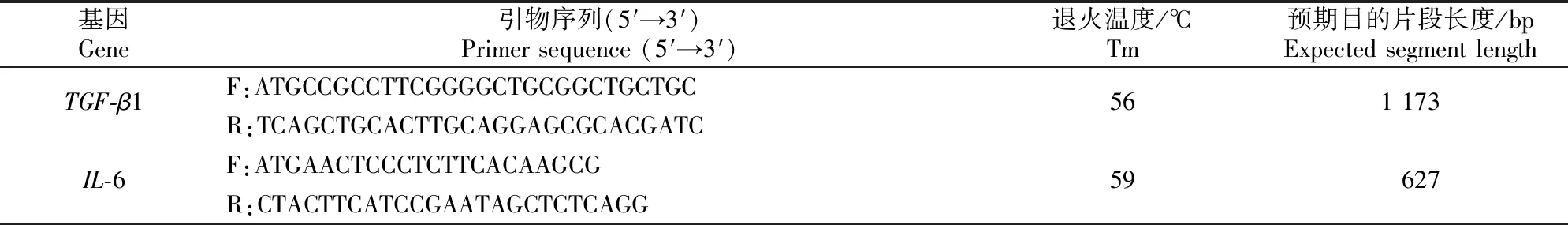
表1 用于扩增奶山羊IL-6和TGF-β1基因的引物
采集奶山羊外周血,常规方法[17]分离外周血单个核细胞(Peripheral blood mononuclear cell,PBMCs),加入ConA至终质量浓度为20 μg/mL,培养72 h。收集PBMCs,按照Total RNA提取试剂盒说明书提取总RNA。以提取的总RNA为模板,采用RT-PCR方法扩增IL-6和TGF-β1基因,试验以ddH2O代替模板的处理为阴性对照。RT-PCR体系为25 μL,具体体系按照FastKing RT Kit试剂说明书进行配制。RT-PCR反应条件为:50 ℃反转录30 min;扩增反应程序为:94 ℃ 5 min;94 ℃ 60 s,56或59 ℃(TGF-β1 56 ℃,IL-6 59 ℃)退火30 s,72 ℃延伸90 s,共32个循环;72 ℃延伸10 min。取5 μL PCR产物,用2%琼脂糖凝胶进行电泳,紫外凝胶成像系统观察记录结果后,切下含目的片段的琼脂胶,采用SanPrep柱式DNA胶回收试剂盒进行胶回收。
1.2.2IL-6与TGF-β1基因克隆载体的构建 将RT-PCR扩增的IL-6和TGF-β1基因片段与pClone007 Blunt-end Simple Vector连接,具体操作按照pClone007 Blunt Simple Vector说明书进行。将连接产物转化感受态DH5α,培养后挑取单菌落,接种于4 mL含50 μg/mL氨苄(Amp)抗性的LB液体培养中,37 ℃振荡培养12 h,取1 μL进行PCR鉴定,试验同时以ddH2O代替模板的处理为阴性对照。将菌液PCR为阳性的单克隆菌液送擎科生物技术有限公司测序。
1.2.3IL-6与TGF-β1基因原核表达载体的构建 根据NCBI中收录的山羊TGF-β1和IL-6基因mRNA CDS区序列,结合载体图谱及Primer 5.0软件预测的信号肽序列,用Primer 5.0软件设计引入酶切位点的引物,其扩增产物不包含信号肽。引物由Invitrogen公司合成,其相关信息见表2。

表2 用于扩增奶山羊去信号肽IL-6和TGF-β1基因的引物
注:GGATCC、CTCGAG、GAATTC分别为BamH Ⅰ、XhoⅠ、EcoR Ⅰ限制性内切酶酶切位点。
Note:GGATCC、CTCGAG、GAATTCisBamH Ⅰ,XhoⅠ,EcoR Ⅰ restriction enzyme cutting site respectively.
将克隆载体阳性菌液8 000 r/ min离心3 min,收集菌体沉淀,用SanPrep柱式质粒DNA小量抽提回收试剂盒提取质粒。以提取的质粒为模板,PCR扩增去信号肽的TGF-β1和IL-6基因,PCR体系为25 μL:Mix 12.5 μL,上、下游引物各1 μL,DNA模板1 μL,ddH2O 9.5 μL,反应程序同1.2.1节。用限制性内切酶BamH Ⅰ/XhoⅠ双酶切TGF-β1 PCR扩增产物和表达载体pET-32a,用XhoⅠ/EcoRⅠ双酶切IL-6 PCR扩增产物和表达载体pET-32a,分别纯化回收PCR产物与表达载体pET-32a片段,T4连接酶连接,构成原核表达载体pET-32a-TGF-β1和pET-32a-IL-6。将连接产物转化至感受态大肠杆菌 BL21(DE3),用Amp抗性LB平板(Amp 50 μg/mL)筛选、PCR筛选,获得阳性克隆送擎科生物技术有限公司测序。
1.2.4 重组蛋白IL-6与TGF-β1的诱导表达和纯化 将鉴定含有正确重组质粒的大肠杆菌BL21(DE3) 菌液,按体积比1∶100的比例接种到含50 μg/mL Amp的LB培养基中,37 ℃培养箱中过夜培养;取过夜培养菌液按体积比1∶50接种至4 mL LB培养基,37 ℃振荡培养出现云雾样,加入IPTG至终浓度为1 mmol/L,37 ℃诱导4 h;收集3 mL菌液,8 000 r/min离心3 min后取上清,用PBS洗涤沉淀2次,最后用100 μL PBS(pH 7)悬浮。取5 mL诱导重组菌液,8 000 r/min离心3 min,取沉淀的菌体用PBS洗涤2次,将沉淀重悬于0.5 mL热解缓冲液中,超声(300 W,工作10 s,间歇10 s)裂解20 min,12 000 r/min离心15 min,将上清液移入新的EP管中。取收集的上清液用镍柱纯化试剂盒进行蛋白纯化,具体操作按镍柱纯化试剂盒说明书进行。取诱导表达样品及纯化后的样品,加入5×SDS上样缓冲液,水浴煮沸10 min,进行SDS-PAGE电泳鉴定,同时以未诱导重组菌液、诱导空载体菌液为对照。
1.2.5 IL-6与TGF-β1重组蛋白的免疫学活性检测 调整PBMCs密度为1×106mL-1,加入24孔细胞培养板,每孔100 μL,然后每孔再加入20 μg/mL的ConA 50 μL。将上述PBMCs分为对照组、IL-6组、TGF-β1组和IL-6+TGF-β1组,其中对照组加入50 μL的培养液,IL-6组细胞每孔加入25 μL的 1 ng/mL重组蛋白IL-6和25 μL培养液,TGF-β1组细胞每孔加入25 μL的10 ng/mL重组蛋白TGF-β1和25 μL培养液,IL-6+TGF-β1组细胞每孔加1 ng/mL重组蛋白IL-6和10 ng/mL重组蛋白TGF-β1各25 μL。各组细胞培养72 h后,提取总RNA,检测核酸质量浓度。调整核酸质量浓度为200 ng/μL,使用600 ng RNA反转录得到cDNA。以甘油醛-3-磷酸脱氢酶基因(GAPDH)为内参,采用SYBR实时荧光定量PCR法(qRT-PCR)检测IL-17 mRNA的表达水平。根据NCBI中收录的IL-17(GenBank号为:NM_002190.3)和GAPDH(GenBank号为:NM_014364.5) mRNA CDS区序列,在线设计IL-17和GAPDH基因引物(表3)。qRT-PCR反应体系为15 μL,具体体系按照SYBR Premix ExTaqTMⅡ 试剂盒说明书进行配制。qRT-PCR反应条件为两步法,先95 ℃预变性15 min,再进行PCR反应(95 ℃ 10 s,60 ℃ 32 s,40个循环)。

表3 用于IL-17与GAPDH基因扩增的引物
2 结果与分析
2.1 IL-6与TGF-β1基因的RT-PCR扩增
RT-PCR扩增结果(图1)显示,成功在500~750 bp扩增出了IL-6的预期片段(图1-A),在1 000~2 000 bp扩增出了TGF-β1的预期片段(图1-B)。

A.IL-6基因;B.TGF-β1基因。M.2000DL Marker;1.阴性对照;2.IL-6基因扩增产物;3.TGF-β1基因扩增产物
2.2 IL-6与TGF-β1基因克隆载体的鉴定
PCR鉴定结果(图2)显示,成功获得了627 bp的IL-6(图2-A)和1 173 bp的TGF-β1(图2-B)目的片段,测序鉴定结果表明与预期长度相符。由此表明,IL-6和TGF-β1核酸片段已成功插入到克隆载体中,获得了碱基序列和片段长度与预期结果完全一致的克隆载体,IL-6和TGF-β1基因克隆载体构建成功。
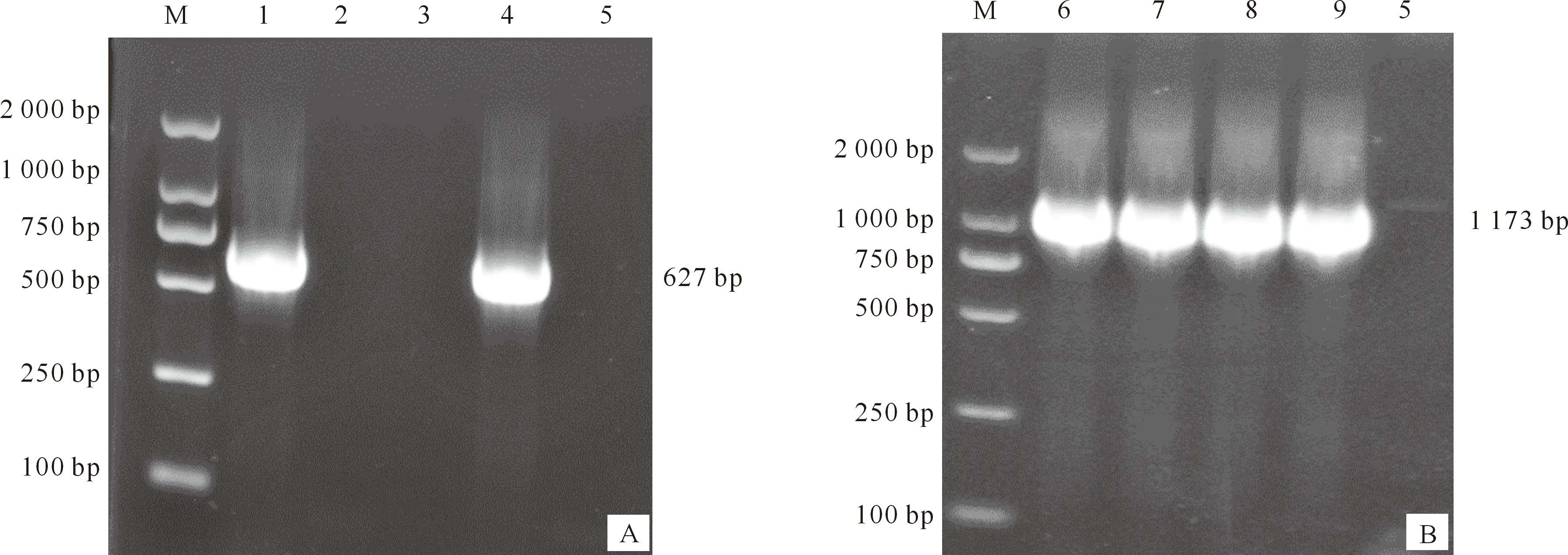
A.IL-6克隆载体;B.TGF-β1克隆载体。M.2000DL Marker;1,4.阳性菌落;2,3.假阳性菌落;5.阴性对照;6~9.阳性菌落
2.3 IL-6与TGF-β1基因原核表达载体的鉴定
pET-32a-IL-6表达载体经PCR鉴定获得了339 bp的去信号肽IL-6目的片段(图3-A),pET-32a-TGF-β1表达载体经PCR鉴定获得了552 bp的去信号肽TGF-β1目的片段(图3-B)。测序鉴定结果表明获得了预期长度的序列。上述结果表明,IL-6和TGF-β1基因片段已成功插入到表达载体pET-32a中,获得了碱基序列和片段长度与预期结果完全一致的表达载体,pET-32a-IL-6和pET-32a-TGF-β1表达载体构建成功。

A.IL-6表达载体;B.TGF-β1表达载体。M.2000DL Marker;1~4.阳性菌落;5.阴性对照;6~9.阳性菌落
2.4 IL-6与TGF-β1重组蛋白的表达与纯化
SDS-PAGE鉴定结果(图4)显示,IL-6与TGF-β1诱导表达产物分别在分子质量约33和44 ku处出现目的条带,与预期结果一致,表明重组菌能够表达出奶山羊IL-6和TGF-β1融合蛋白;纯化结果(图4)表明,获得了较纯的IL-6和TGF-β1融合蛋白。

M.蛋白Marker;1.未诱导的pET-32a-IL-6重组菌;2.诱导的pET-32a空载体;3.诱导的pET-32a-IL-6重组菌;4.纯化的IL-6重组蛋白;5.未诱导的pET-32a-TGF-β1重组菌;6.诱导的pET-32a-TGF-β1重组菌;7.纯化的TGF-β1重组蛋白
2.5 IL-6与TGF-β1重组蛋白对PBMCs的体外诱导作用
从real-time PCR结果(图2)可以看出,用重组蛋白IL-6和TGF-β1分别单独刺激奶山羊PBMCs,均不能使IL-17 mRNA相对表达量升高,而TGF-β1和IL-6共刺激则可使IL-17 mRNA相对表达量极显著升高,表明制备出了可明显促进PBMCs的IL-17 mRNA表达水平升高的奶山羊IL-6和TGF-β1重组蛋白。
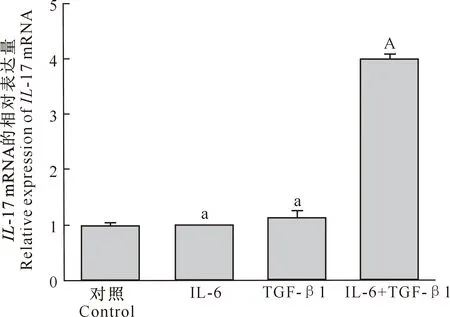
与对照组相比,图柱上标a表示差异不显著(P>0.05),标A表示差异极显著(P<0.01)Compared with the control group,a indicates insignificant difference (P>0.05),and A indicates extremely significant difference (P<0.01)
3 讨 论
IL-6和TGF-β是机体免疫反应过程中非常重要的2种细胞因子[18-20]。IL-6主要由纤维母细胞、单核/巨噬细胞、T淋巴细胞、B淋巴细胞、上皮细胞等分泌,在T、B淋巴细胞和单核细胞的分化增殖以及抗感染反应、炎症反应等过程中发挥着重要作用[21-23]。TGF-β可由机体多种细胞分泌,单独的TGF-β在机体免疫调节中发挥着重要作用[24-25],其与IL-6协同作用则可诱导Th17分化,产生效应Th17细胞,分泌IL-17从而介导组织局部或者系统性的炎症反应[26-28]。IL-17(IL-17A)是一种重要的促炎性细胞因子,其与带有IL-17受体的靶细胞结合,可以激活天然免疫细胞和组织细胞,诱导促炎性细胞因子和趋化因子的分泌,募集大量中性粒细胞到达病原所在组织并清除病原体[12-13]。有充分的研究资料表明,在TGF-β1和IL-6的共同作用下,小鼠Th细胞能够分化形成Th17细胞[11,14]。也有研究结果显示,体外培养系统中,只需要IL-1和IL-6就足以诱导人效应Th17细胞的产生[15-16]。但更深入的研究结果揭示,TGF-β仍是人Th17细胞产生必不可少的细胞因子[28-29]。本研究结果表明,原核表达的奶山羊IL-6和TGF-β1在体外协同作用,具有促进奶山羊PBMCs合成产生IL-17 mRNA的效应,且IL-17 mRNA的表达量显著升高,提示原核表达的IL-6和TGF-β1具有免疫活性。同时也表明,在奶山羊Th17细胞的分化中,TGF-β1和IL-6仍属于关键的细胞因子,与小鼠、人Th17细胞分化条件基本一致, 这为进一步探讨奶山羊抗感染免疫、炎症性疫病等机理提供了很好的试验材料。
