FAdV-4 NP株F1蛋白原核表达及多克隆抗体的制备
2019-10-09屈贵蜀彭尧舜许丽惠王全溪
陈 媛,屈贵蜀,彭尧舜,许丽惠,王全溪
(福建农林大学动物科学学院,福建福州350002)
禽腺病毒(fowl adenovirus,FAdV)是腺病毒科禽腺病毒属中的一员.按照基因组的群特异抗原,分为5个群(A-E)和 12 个血清型(1~7、8a、8b、9~11)[1],其中,Ⅰ群血清 4 型禽腺病毒(fowl adenovirus serotype 4,FAdV-4)以侵害肝脏为主,并在肝细胞中形成核内包涵体.近年来,世界各地都爆发安卡拉病[2],这是由FAdV-4引起的以心包积水、肝脏坏死为主要特征的传染性疾病,故又被称为肝炎—心包积水综合征(hydropericardium hepatitis syndrome,HHS)[3].研究表明,引起安卡拉病与包涵体肝炎的病毒虽然都是FAdV-4,但是病毒的主要结构蛋白的基因存在较大变异[4].1987年FAdV-4首次在巴基斯坦被报道,而后印度[5]、韩国[6]也报道了FAdV-4的流行;中国在2007年发现少数该病毒,2015年后FAdV-4在中国呈现大面积爆发的趋势.
FAdV为无囊膜、双股线状的DNA病毒,其核衣壳由五邻体(penton)、六邻体(hexon)和纤突蛋白(fi-ber)等主要结构蛋白构成[7].有研究证明,纤突蛋白在病毒感染过程中扮演着重要的角色.缺少fiber2蛋白,会影响病毒的复制过程,也会使机体产生中和抗体的量降低[8];而缺少fiber1(F1)蛋白,会减弱野生型病毒与宿主细胞膜上受体的结合程度,但病毒仍能感染宿主并进行复制[9];同时,F1蛋白参与病毒的扩散,其产生蛋白的免疫原性较强,可作为研发基因疫苗的候选蛋白[10].因此,对F1蛋白结构及其功能的研究具有十分重要的意义.
本试验先对F1基因序列进行优化,构建FAdV-4 F1蛋白的重组质粒,获得F1基因的高表达蛋白,并得到高效价的多克隆抗体,为后期深入研究FAdV-4奠定基础.
1 材料与方法
1.1 材料
FAdV-4 NP株,由本实验室分离鉴定并保存;DH-5α感受态细胞、pet-32a载体购自兰博利德试剂有限公司,高纯度质粒小提中量试剂盒、DNA提取试剂盒购自福州轩创生物技术公司,KpnI QuickCut、BamHI QuickCut限制性内切酶购自兰博利德试剂有限公司,羊抗兔IgG(二抗)、完全弗氏佐剂(complete freundadjuvant)、不完全弗氏佐剂(incomplete freundadjuvant)购自北京全式金生物技术有限公司,新西兰黄兔购自福建农林大学派尼尔兔园.
1.2 F1基因的扩增
从NCBI上下载FAdV-4 F1基因的序列(KU991797.1),用DNAman软件设计一对特异性引物:FAdV-4 F1(F)5′-CGAGGTACCTTAGATAGCGTTACCGGCGTTCTGA-3′(KpnI);FAdV-4 F1(R)5′-CGGGATCCGGTGAACGCGATCGCATCGCT-3′(BamHI).提取FAdV-4病毒的DNA模板,经PCR扩增,并纯化PCR产物,送上海生工生物工程股份有限公司测序,然后分析序列表达效率,优化密码子.
1.3 重组质粒pET-32a-F1的构建、鉴定
在PCR仪上用限制性内切酶KpnI和BamHI分别对纯化的PCR产物和pET-32a进行双酶切2 h,后81℃灭活30 min,16℃连接6 h.然后转到DH-5α感受态细胞中,隔天挑菌进行PCR扩增、测序,提取质粒进行酶切鉴定[11].鉴定正确后,将重组质粒转到BL21中,进行PCR验证.
1.4 序列优化前后表达效率对比
分别构建优化前后的F1基因重组质粒,转化BL21,扩大培养,200 r·min-1、37℃摇床中孵育4 h后,设诱导组1和诱导组2(IPTG终浓度为1 mmol·L-1),再孵育3 h,收集菌液进行离心,用PBS重悬沉淀,加蛋白Buffer于沸水煮10 min,再经SDS-PAGE电泳分析.
1.5 F1重组蛋白诱导表达体系的优化及纯化
重新摇菌,保持温度 37 ℃、时间 5 h 不变,分别加入 0.1、0.3、0.5、0.7、0.9、1.2 mmol·L-1IPTG 进行诱导,筛选最佳诱导浓度;保持浓度为 0.3 mmol·L-1、温度 37 ℃不变,将孵育时间设为 1、3、5、7、9 h 取样,筛选最佳诱导时间;保持浓度为0.3 mmol·L-1、时间5 h不变,将F1蛋白置于4、25、37、50℃孵育,筛选最佳诱导温度.将待纯化的蛋白依次经过40、80、120、200、250 mmol·L-1咪唑洗脱,并收集液体,经SDS-PAGE电泳,确定最佳洗脱浓度.
1.6 F1基因多克隆抗体的制备、Western blot鉴定及血清效价的检测
1.6.1 F1基因多克隆抗体的制备及Western blot鉴定 将纯化后的F1蛋白和完全弗氏佐剂以1∶1混合,皮下注射于新西兰黄兔(首次免疫);15 d后进行二次免疫(步骤同首次免疫);二次免疫15 d后,将F1蛋白和不完全弗式佐剂以1∶1混合进行第3次免疫;第3次免疫4 d后于兔子心脏采血,8000g下离心5 min,收集血清,以F1蛋白(已纯化)为抗原,待检兔血清为一抗,进行Western blot鉴定.
1.6.2 间接酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)法检测F1基因多克隆抗体血清效价 ①包被抗原:用碳酸盐缓冲液包被F1抗原(15 mg·mL-1),至于4℃冰箱过夜.②洗涤:倒掉包被液,并置于干净的纱布上拍干,用含有0.05%吐温的PBS洗涤3次,每次3 min.③封闭:每孔加入200 μL封闭液(含5%BSA的PBST缓冲液),37℃下封闭1 h.④洗涤:步骤同②.⑤加待检血清:将待检的兔血清按照1 ∶1000、1 ∶2000、1 ∶4000、1∶8000……1 ∶16384000进行稀释,同时设置空白对照、阴性对照,37℃下孵育1 h.⑥洗涤:步骤同②.⑦加酶标二抗:每孔加100 μL羊抗兔(IgG)(1∶5000稀释),37℃下孵育1 h.⑧洗涤:步骤同②.⑨加底物显色:每孔加100 μL TMB显色液,37℃下闭光显色30 min.⑩终止反应:每孔加100 μL H2SO4终止液.结果判定:酶标仪检测样品光密度(D450nm),以空白孔调零,当阳性血清与阴性血清的比值(P/N)≥2.1 时,结果为阳性; 当 1.5≤P/N<2.1 时,结果可疑;P/N<1.5 时,结果为阴性.将结果用Excel绘制成折线图.
2 结果与分析
2.1 F1基因序列优化结果
密码子优化结果见图1,更多的红色密码子意味着更适合宿主密码子偏好,将有更高的表达效率.优化序列提高了GC含量,消除了不利的峰,满足了目标宿主密码子适应指数(codon adaptation index,CAI)的最高表达谱,使最终的蛋白表达效率大大提升.
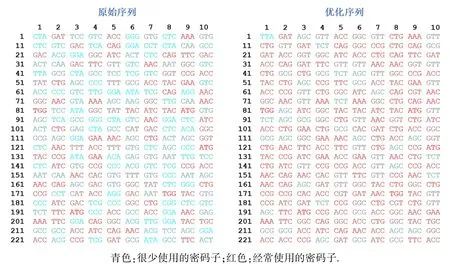
图1 序列优化前后对比图Fig.1 Sequences before and after optimization
2.2 F1基因的扩增及重组质粒的构建
扩增F1基因得到与预期大小一致的片段,约为699 bp(图2A);分别以F1基因(上、下游)、T7(上、下游)、F1的上游+T7的下游、T7的上游+F1的下游为扩增引物,进行 PCR 鉴定,在699、1400、778、1320 bp处能看到特异性条带(图1B);对重组质粒进行单、双酶切,单酶切的条带位置低于无酶切的重组质粒,在双酶切质粒750 bp的位置能明显看到F1的片段大小(图1C),表明F1基因已成功连接至载体.
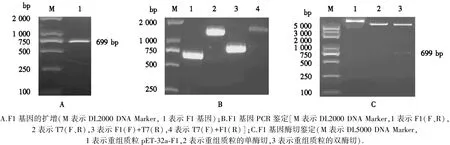
图2 F1基因的扩增及重组质粒的鉴定Fig.2 Amplification of F1 gene and identification of recombinant plasmid
2.3 密码子优化前后的诱导效率
F1基因序列未优化组和优化组同时做以下处理:吸取诱导后的菌液离心,蛋白变性,煮沸后进行SDSPAGE电泳,结果如图3所示.在45 ku位置附近能明显看到F1基因序列优化后的蛋白表达量比未优化的蛋白表达量多,且条带较粗.
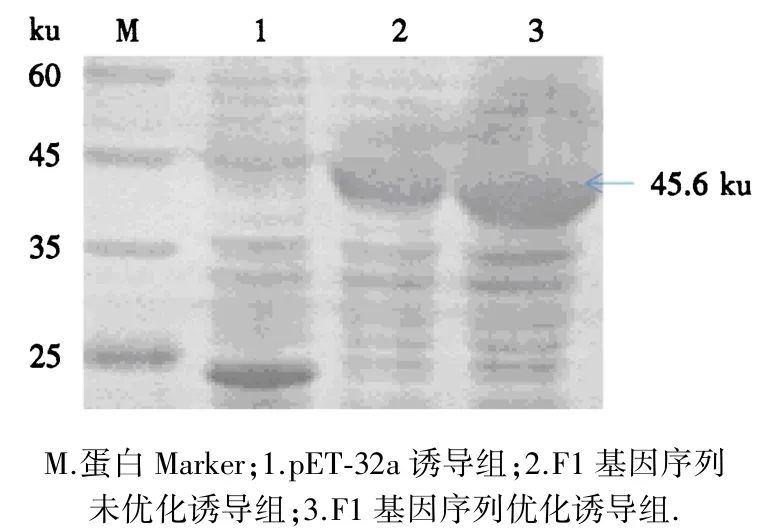
图3 SDS-PAGE电泳结果Fig.3 Electrophoresis results of SDS-PAGE
2.4 诱导条件的优化结果
保持温度和时间不变,IPTG浓度为0.3 mmol·L-1时,蛋白条带最粗(图4A);保持浓度和时间不变,在37℃下,蛋白条带最粗(图4B);保持浓度、温度不变,诱导时间为5 h时,蛋白条带最粗(图4C).
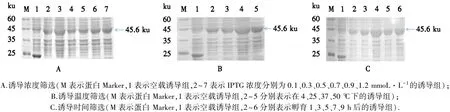
图4 诱导条件的优化结果Fig.4 Optimized expression under induced conditions
2.5 重组蛋白纯化结果
向层析柱中依次加入不同浓度的咪唑对目的蛋白进行洗脱,结果发现,当咪唑浓度为80 mmol·L-1时,蛋白条带量适当,且条带单一、无杂带,洗脱效果最好(图5).
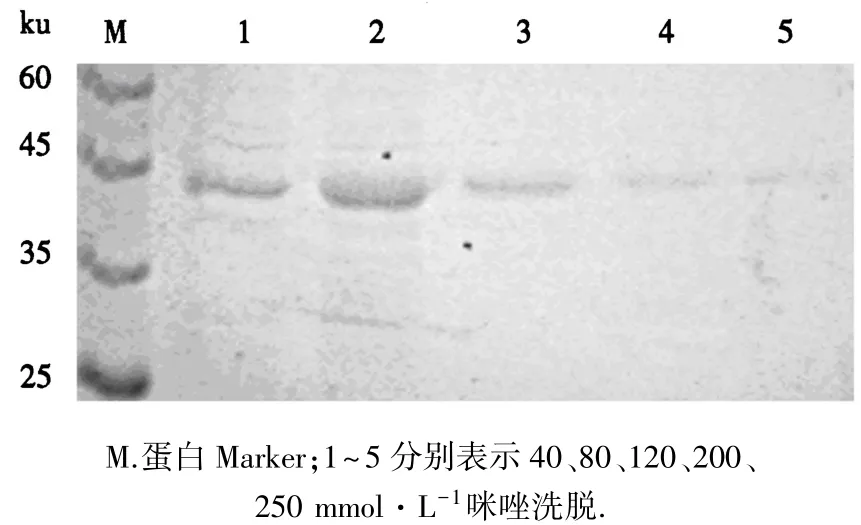
图5 蛋白纯化结果Fig.5 Result of protein purification
2.6 多克隆抗体的Western blot鉴定及血清效价测定
于兔子心脏采血,收集血清并作为一抗,以未注射F1蛋白的兔子血清作为阴性对照,Western blot鉴定结果如图6A所示.在45 ku位置附近能孵育出目的蛋白,说明本试验已成功制备了F1蛋白的多克隆抗体.间接ELISA检测发现,F1基因的抗体效价可达1∶1024000(图6B).
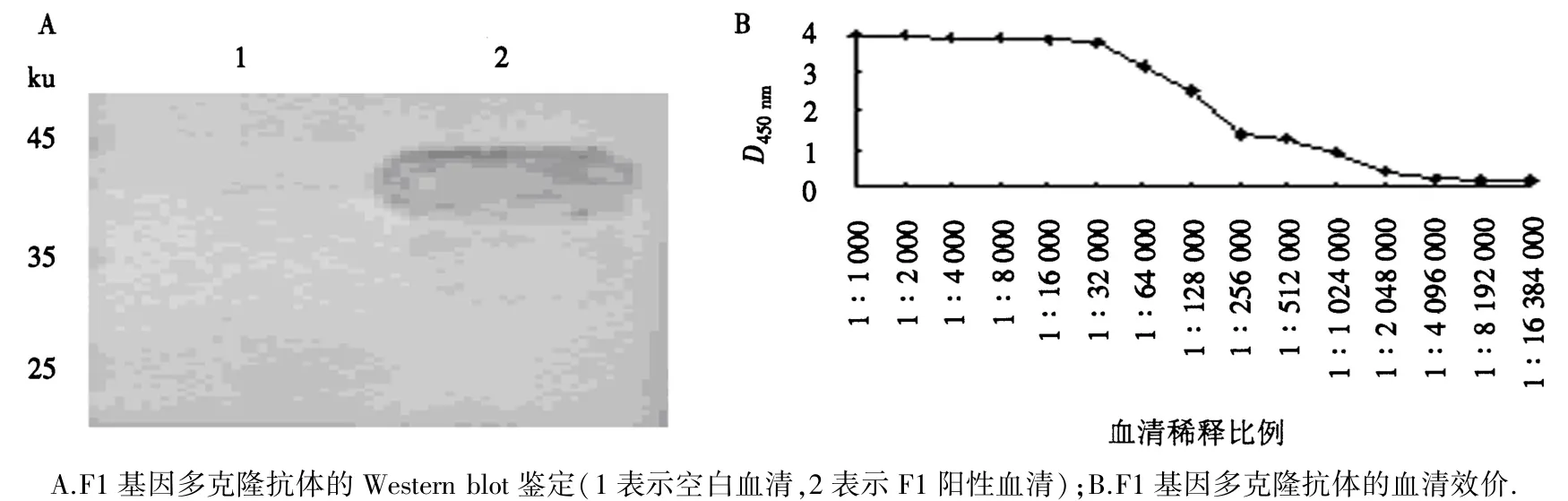
图6 多克隆抗体的鉴定及其血清效价Fig.6 Identification of polyclonal antibodies and serum titer
3 讨论
当前,越来越多的FAdV-4被发现,而针对FAdV的研究大多集中在分子结构方面,其主要结构蛋白的研究多数集中在hexon基因、penton基因以及fiber2蛋白,对F1蛋白的研究相对较少.已有研究证实,hexon基因主要作为种属的鉴定[12],penton基因可以切断病毒和宿主之间的联系[13],fiber2则是在病毒复制过程中起作用;F1也参与病毒感染,但具体的机制尚不明确.目前,有关FAdV-4 F1的原核表达及其多克隆抗体制备还没有详细报告,仅有FAdV 8b纤突蛋白制备的多抗[14].本研究对FAdV-4 F1基因序列进行了优化,获得的F1基因的蛋白表达量明显高于优化前F1基因的蛋白表达量;用高表达的F1蛋白制备的多克隆抗体血清效价高达1∶1024000,说明获得的抗体血清具有很好的效价水平;Western blot鉴定表明,本试验制备的FAdV-4 F1蛋白的多克隆抗体具有良好的特异性.
每个生物体或基因都存在优势密码子和弱势密码子,关于密码子的使用已有研究[15].张相民等[16]和范学政等[17]分别对痘苗病毒中的gag基因和猪瘟病毒E2基因的密码子进行了改造,获得了较高的蛋白表达量.本试验也对FAdV-4 F1基因的密码子进行了优化,将优化过的目的基因转化至表达感受态细胞中,所得的蛋白表达量较未优化的蛋白多,用纯化后的蛋白制备的多抗的效价也更高.可见,密码子的优化有利于生物体将自身的弱势转变为优势,增强其功能,促进其发展.
