大小年毛竹叶抗虫相关基因PhSPL17的表达模式
2019-10-09李玉红林振清朱腾飞黄志明
李玉红,林振清,朱腾飞,黄志明,郭 欣,苏 军
(1.福建农林大学海峡联合研究院基础林学与蛋白质组学研究中心,福建福州350002;2.建瓯市林业局,福建 建瓯 353100)
毛竹(Phyllostachys edulis)的大小年制度是竹林经营管理的基础,大小年现象也与林间病虫害的发生相关[1].生态学层面的研究表明,林间大小年和新竹叶的差异影响叶部食叶害虫种群的生长发育和抗病性,同时对寄生性天敌产生影响[2,3],进而影响毛竹叶部节肢动物群落的分布[4].自然状态下,毛竹在时间尺度上恪守着以2年为周期的换叶节律[1],大小年经营制度基于自然状态下毛竹不同的年龄阶段,在1个换叶周期中毛竹被划分为大年和小年,因此,年龄是毛竹大小年现象及其对叶部节肢动物群落影响的重要因素.植物以miRNA156-SPL为基础控制年龄相关的生长与发育[5],对昆虫取食的响应主要通过次生代谢物质的积累和茉莉酸(jasmonate,JA)途径[6].近期研究表明[7],年龄的增长抑制了JA途径并增加次生代谢物质硫代葡萄糖苷的积累,从而增强了拟南芥的抗虫性,其中SPL9起关键作用.植物特有的SPL蛋白家族在不同物种间保守性较高,模式植物拟南芥中有15个,毛竹的近缘种水稻中有19个,不同的SPL蛋白功能在物种间存在差异[8,9].分析毛竹中SPL表达模式在时间尺度上的变化,对研究毛竹叶部害虫发生的分子生态学机制至关重要.
1 材料与方法
1.1 材料
本研究所用的芽、地下茎、根、茎秆取自于福建农林大学百竹园内科研用毛竹,毛竹叶片取自海峡联合研究院林学中心人工温室,毛竹种子采自福建省建瓯市筹岭村,样品放在液氮中速冻,于-80℃冰箱保存备用.
1.2 方法
1.2.1 大小年竹叶的鉴别 毛竹大小年叶片的甄别参考苏军等方法[4].
1.2.2 毛竹SPL基因家族的鉴定及进化分析 根据已经鉴定的15个拟南芥和19个水稻SPL蛋白序列,利用 BlastP(http://www.bamboogdb.org/page/manual.jsp)检索毛竹基因组数据库.使用 ClustalX(http://bips.u-strasbg.fr/fr/Documentation/ClustalX/)图形化的多序列比对工具,通过引入 15 个拟南芥和 19 个水稻的SPL蛋白序列对毛竹SPL基因家族进行序列对比分析,分析毛竹SPL转录因子家族的保守结构域;然后利用 GeneDoc(http://www.psc.edu/biomed/genedoc/)多序列比对结果的美化工具完善序列比对结果;最后利用 MEGA(http://www.megasoftware.net)进化分析工具构建进化树.
1.2.3 毛竹PhmiR156和PhSPL17在不同组织中的表达分析 通过同源序列比对并参考现有毛竹miRNA研究,从毛竹基因组数据库 Bamboo GBD: Bamboo Genome Database(http://www.bamboogbd.org/)中获得miRNA成熟体序列,筛选PhmiR156序列为:5′-UUGACAGAAGAGAGUGAGCAC-3′[12].毛竹种子、地下茎、芽、根、茎杆、叶片的总 RNA 使用 ZYMO Quick-RNA MicroPrep Kits.R1051(Fast RNA isolation kits for total RNA and small/miRNA from cells and soft tissue)RNA 提取试剂盒提取.每个材料分别取1.0 μg RNA,PhSPL的cDNA使用Takara公司的Prime ScriptTM RT reagent Kit with gDNA Eraser(CAT:RR047A)试剂盒进行反转录合成cDNA的第1条链;PhmiR156的cDNA使用TAKARA公司的Mir-XTMmiRNA First Strand Synthesis Kit(Code No.638315).PhSPL17 实时荧光定量 PCR 的引物利用 Primer 3(http://primer3plus.com/cgibin/dev/primer3plus.cgi),以TIP41(GenBank 登录号:242384689)作为内参基因(表 1),PhmiR156 定量PCR 引物为:phe-miR156(5′-TTGACAGAAG AGAGTGAGCAC-3′),以毛竹PhU6 作为内参基因.实时荧光定量 PCR 根据HieffTMqPCR SYBR®Green Master Mix(Low Rox Plus)(CAT:11202ES08)(上海翊圣生物科技有限公司)和QuantStudio 6 Flex PCR仪的使用说明进行操作.每个样本4个生物学重复,3个技术重复.
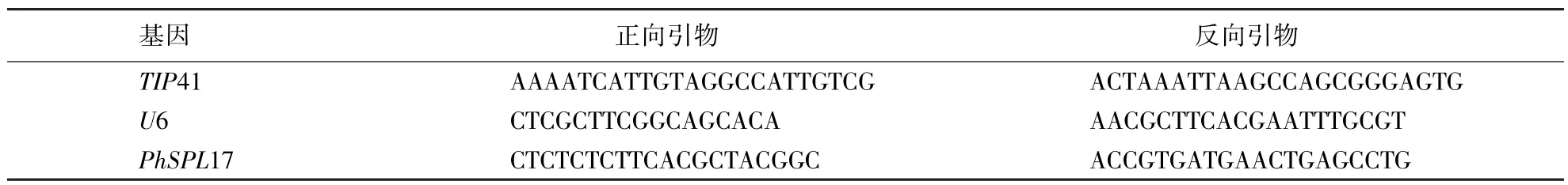
表1 毛竹实时荧光定量引物序列Table 1 Real-time fluorescence quantitative primer sequence of moso bamboo
1.2.4 数据处理与分析 应用Excel 2010和SPSS 19.0软件进行统计学分析,包括采用公式RQ=2-ΔΔt进行PhmiR156及其靶基因PhSPL17相对表达水平的计算分析.
1.2.5 外源细胞分裂素(6-BA)和茉莉酸甲酯处理 将毛竹叶片分别置于含有1.0 μmol·L-16-BA和1.0 μmol·L-1茉莉酸甲酯(methyl jasmonate, MJ)的 B5 培养基[11],分别浸泡 0、0.5、1.0、2.0、3.0、4.0 h,将处理后的叶片置于液氮中速冻,研磨提取叶片总RNA并反转合成cDNA.每个基因的qPCR反应均为4个生物学重复,3 个技术重复(反应方法见“1.2.3”).
2 结果与分析
2.1 毛竹PhSPL基因家族的鉴定
为了系统鉴定毛竹基因组编码的SPL基因家族,利用已知的15个拟南芥和19个水稻SPL基因家族氨基酸序列分别检索毛竹基因组数据库,对得到的类似毛竹SPL基因序列进一步对候选基因的DBD和SPL保守结构域进行分析,最终确定37个毛竹SPL基因(图1).毛竹SPL基因家族成员其氨基酸全长含42~265个氨基酸.通过对毛竹、拟南芥及水稻SPL基因家族氨基酸保守结构域的分析发现,在3个物种中SPL蛋白具有高度的保守性,说明在毛竹、拟南芥和水稻中SPL蛋白发挥的功能可能有相似性.

图1 SPL基因家族蛋白保守区结构域分析Fig.1 Domain structure of conserved regions of SPL gene family proteins
2.2 毛竹PhSPL基因家族进化分析
为了比较毛竹SPL基因家族的同源性,基于拟南芥、水稻和毛竹SPL基因家族的氨基酸序列构建3种植物SPL基因家族进化树(图2).根据与水稻及拟南芥SPL的对应关系对毛竹PhSPL基因进行命名和分组(表2),将毛竹PhSPL基因家族成员分成4组:组Ⅰ(类拟南芥SPL14)、组Ⅱ(类拟南芥SPL3/8)、组Ⅲ(类拟南芥SPL9/15)、组Ⅳ(类拟南芥SPL2/6)(表2).毛竹的PhSPL基因除了PhSPL3-3、PhSPL13和PhSPL10-2之外的34个基因都有对应的水稻或者拟南芥的同源基因.此外,37个毛竹PhSPL基因家族中存在9个姐妹对,分别为PhSPL5-1、PhSPL5-2基因;PhSPL6-1、PhSPL6-2基因;PhSPL8-1、PhSPL8-2基因;PhSPL9-1、PhSPL9-2 基因;PhSPL12-1、PhSPL12-2 基因;PhSPL14-1、PhSPL14-2 基因;PhSPL15-1、PhSPL15-2 基因;PhSPL17-1、PhSPL17-2基因;PhSPL19-1、PhSPL19-2基因.

图2 拟南芥、水稻和毛竹SPL家族蛋白质聚类分析Fig.2 Phylogenetic relationship of SPL family among Arabidopsis, rice and moso bamboo
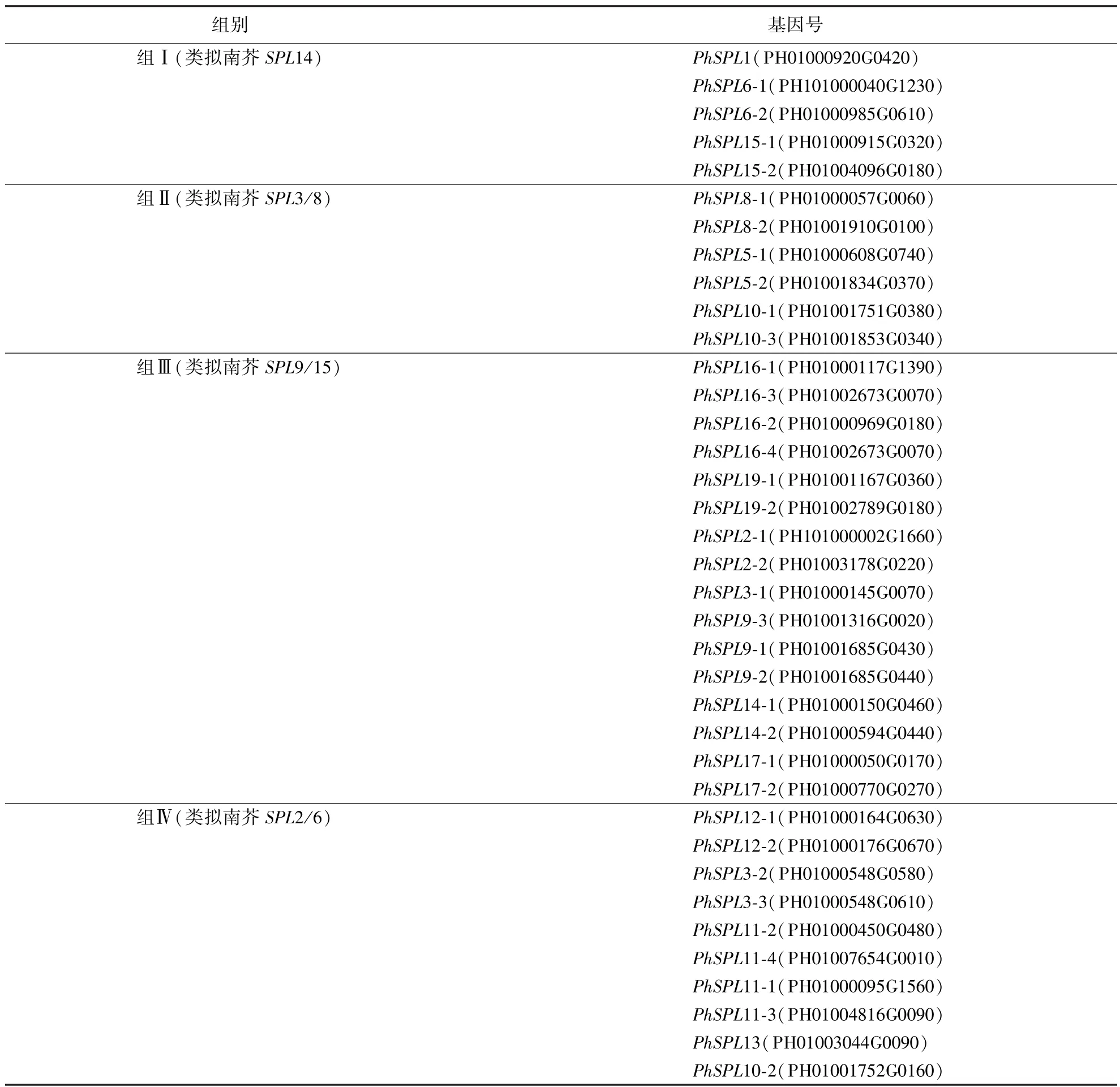
表2 毛竹PhSPL基因家族成员分组情况Table 2 Grouping of PhSPL gene family members and their numbers
2.3 毛竹PhmiR156与PhSPL17在不同组织中的分布
为了探究毛竹PhmiR156与PhSPL17在不同组织中的表达水平,通过RT-qPCR对其种子、地下茎、芽、根、茎秆和叶片中的相对表达量进行分析(图3).结果表明,PhmiR156在芽中的表达量最高,其次是叶片、茎秆、地下茎、根和种子.芽、叶片和茎秆的PhmiR156表达量与地下茎、根和种子存在极显著差异,但这三者无极显著差异;地下茎、根和种子这三者之间存在极显著差异.PhSPL17在种子中的表达量最高,且与其他组织表达量均存在极显著差异;其次是叶片、地下茎、茎秆、根,芽表达量最低.叶片和地下茎两者无极显著差异,但与茎秆、根和芽存在极显著差异.
2.4 PhmiR156与PhSPL17在毛竹叶中的动态变化
本试验分析PhmiR156与PhSPL17在1~5年生毛竹的叶片中的动态变化发现(图4A):PhmiR156在1、2、3 a毛竹叶片中的表达量基本维持在稳定水平,在4 a毛竹叶片中表达量上升,而在5 a毛竹叶片中的表达量显著提升,与1 a毛竹相比,相对表达量达到了14倍多.PhSPL17在1 a毛竹叶片中未表达(图4B),而在2 a毛竹的叶片中,其表达量下调至1/4多;在3 a毛竹的叶片表达量下调相对较少,达到1/3多;4 a毛竹的叶片表达量同样下调至1/3多,但较之3 a毛竹表达量下调较少;5 a毛竹的叶片表达量下调1/2.总的来看,PhSPL17在1~5 a毛竹叶片中的表达量随着年龄的增长呈现出上下波动的趋势,随着大、小年波动,在大年较低.
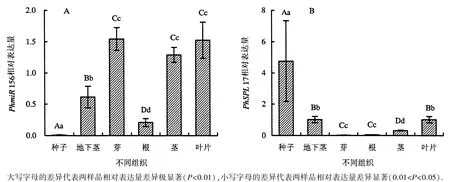
图3 毛竹PhmiR156和PhSPL17在不同组织中的表达Fig.3 Expressions of PhmiR156 and PhSPL17 in different tissues of moso bamboo

图4 叶片中PhmiRNA156和PhSPL17在不同年龄毛竹中的表达Fig.4 Expressions of PhmiRNA156 and PhSPL17 of leaves from moso bamboo at different ages
2.5 外源JA(MJ)和细胞分裂素6-BA对毛竹叶片PhmiRNA156和PhSPL17的影响
植物的生长发育以及抗病虫害与年龄存在着紧密的联系[2],为了检测在毛竹生长过程中PhSPL17是否受到JA(抗虫害)以及细胞分裂素(年龄相关)的调控[6,13],对毛竹叶片进行了MJ(茉莉酸甲酯)和6-BA(6-苄氨基腺嘌呤)的处理.结果显示,PhmiR156和PhSPL17基因的表达受到茉莉酸和细胞分裂素的调控(图5).MJ处理后1 h,PhmiR156表达量基本保持不变;处理2~3 h时,表达量出现下降,但下降不明显;处理4 h时,表达量出现明显的上升,相对表达量达到3倍多(图5A).MJ处理0.5 h时,PhSPL17表达量达到最高,相对表达量接近10倍;随后表达量出现下降,在1 h时,相对表达量上调5倍,直至4 h时,表达量与未处理的表达量持平(图5B).以6-BA处理毛竹叶片0.5 h时,PhmiR156表达量出现下降;在1 h时,PhmiR156不表达;在2 h时,其表达量又上升,上调1倍多;在3 h时,表达量出现了小幅的下调;而在4 h时,又不再表达(图5C).观之6-BA处理后PhSPL17的表达量在前1 h变化较小;2~4 h时,PhSPL17基因表达上调,在3 h时上调5倍,在4 h时上调达10倍(图5D).
3 讨论与结论
对满足自身生长发育和抗性之间的权衡贯穿了植物的整个生活史[15].外界环境对植物抗虫性的影响被广泛研究,然而针对植物内在属性(如年龄)对抗虫性的影响却很少被提及,毛竹林作为病虫害危害极为严重的人工林,毛竹与害虫之间的互相作用更为激烈,是该类型研究难得的材料[1,4].在初步确定毛竹的PhSPL17是随着年龄和换叶节律而变化之后,通过外源茉莉酸甲酯处理人为诱导毛竹的抗性,PhSPL17表达量在很短时间内出现上调并缓慢恢复至正常水平,说明毛竹PhSPL17与抗虫性呈正相关,这也说明大年竹对食叶害虫有耐受性,而小年竹表现出较强的抗虫性[2].

图5 毛竹PhmiR156和PhSPL17在激素处理不同时间的叶片中的表达Fig.5 Changes in expression of PhmiR156 and PhSPL17 in moso bamboo leaves treated with hormones along time
由于植物所处环境的复杂性,很难具体指出某种环境信号改变着植物的年龄[14].毛竹大小年现象的形成同样受到诸多环境因素的影响[1],研究不同环境因素对毛竹PhSPL17表达量的影响是探寻大小年对毛竹与昆虫间关系的分子基础.近期,SPL与JAZ间的互作如何影响植物的抗虫性被揭示[7].初步研究显示,与拟南芥中不同,毛竹通过PhSPL17在转录水平调节毛竹的JAZ影响毛竹的抗虫性(未发表).以上内容的研究为解释毛竹林虫害大发生提供重要的分子生态学依据.
非编码的miR156的表达量被证实随着植物的年龄增长而下降,从而减弱对SPL表达的抑制,使得SPL表达量呈现负相关[14].生物信息学分析显示,毛竹、拟南芥和水稻中的SPL有较高的同源性,特别是SPL domain;预测表明,毛竹PhmiR156的靶位点最大可能是毛竹PhSPL17[12].在种子、芽和叶片中,毛竹PhmiR156和PhSPL17的相对表达量正好相反,也很大程度说明了毛竹中的miR156-SPL元件与大多数植物相似表达量呈负相关.然而,在年龄层面来看,叶片中PhmiR156的表达量在前5年并没有随着年龄的增长而下降反而上升;PhSPL17的表达量随着毛竹的换叶节律而波动上升.由此看来,毛竹叶片中PhSPL17表达量随着年龄和换叶节律而变化,但是PhmiR156并不直接参与塑造该变化.外源细胞分裂素处理后,毛竹叶片中PhmiR156表达量的不规则变化也表明其与年龄的相关程度并不高;反观PhSPL17的表达量在6-BA处理后明显上调,表现出典型的年龄相关性.
