青蒿虎酯对人急性髓系白血病原代细胞及其细胞株K562增殖和凋亡的影响研究
2019-10-09王朦贾国存成怡冰王海军刘炜郭亚琼
王朦,贾国存,成怡冰,王海军,刘炜,郭亚琼
急性髓系白血病(AML)是一组临床及生物学特征均具有异质性的恶性疾病,好发于儿童,占急性白血病的20%~25%[1]。随着危险度分层指导个体化治疗的广泛应用,儿童AML的预后较以往大幅改善,诱导化疗总体完全缓解率可达85%~90%,且5年总生存率已上升至60%~75%[2]。但仍有部分AML患儿诱导化疗病情难以缓解或出现复发,AML长期治疗仍面临着高复发率、治疗相关死亡风险、化疗相关毒副作用等多重挑战[3-4]。青蒿素为我国学者首次从菊科植物黄花蒿中提取的化合物,青蒿琥酯为青蒿素类衍生物,为中国自主研发的具有倍半萜结构的青蒿素类抗疟特效药。近年来,大量实验研究发现其对白血病、口腔癌、膀胱癌、宫颈癌等多种疾病均具有较强的抑制作用[5-6],对白血病也有高度敏感性,且毒副作用小、易耐受,并与传统化疗药物不存在交叉耐药作用[7],这为研究开发经济、有效的AML治疗药物提供了新的线索。基于此,本文拟观察不同浓度的青蒿琥酯对AML原代细胞与细胞株K562的增殖抑制及促凋亡作用,以期为进一步明确AML的发病机制及青蒿琥酯的临床应用提供理论依据。
1 材料与方法
1.1 研究材料 AML儿童纳入标准:(1)经细胞形态学、组织化学染色及流式细胞免疫学分型确诊;(2)初治或复发AML;(3)患儿家属均对本研究内容知情且签署知情同意书;(4)临床诊治资料完善。
采用密度梯度法分离2016年10月—2018年10月于河南省儿童医院血液科就诊的符合纳入标准的24例初治或复发AML患儿的骨髓液4~5 ml,加入抗凝离心管(含肝素0.3 ml),取等体积磷酸缓冲盐溶液(PBS)将骨髓液稀释,充分混匀。取淋巴细胞分离液4~5 ml加入干燥离心管中,再缓慢将稀释后的骨髓液加入分离液上层,2500 r/min离心20 min(离心半径为15 cm),取中间单个核细胞层,移入干洁离心管中,用PBS漂洗2次,1000 r/min离心5 min(离心半径为15 cm),弃上清液,37 ℃、95%饱和湿度、5% CO2条件下RPMI 1640培养基中培养,每3 d换液1次。调整密度为1×106/ml,取处于对数生长期、细胞活性>95%的细胞进行实验。入选的24例初治或复发AML患儿FAB分型均为M1型,其中男13例,女11例;年龄(7.2±1.6)岁;正常核型AML 8例,异常核型AML 16例。
AML细胞株K562购自中国医学科学院基础医学研究所细胞资源中心。培养于含10%胎牛血清、100 μg/ml链霉素、100 μg/ml青霉素的RPMI 1640培养液中,置于37 ℃、5%CO2培养箱中培养,1~2 d换液。
1.2 主要仪器与试剂 5417低温高速离心机(德国Eppondoff公司);倒置显微镜、激光共聚焦显微镜(日本Olympus公司);FACSCaliber流式细胞仪(美国BD公司)。
注射用青蒿琥酯粉针剂(广西桂林南药股份有限公司);RPMI1640细胞培养基(美国Gibco公司);胎牛血清;四甲基偶氮唑盐(MTT)(美国Sigma公司)。
1.3 药物配置及实验分组 无菌条件下,将青蒿琥酯粉针剂加入所附5% NaHCO3溶液1 ml中,振摇1 min使其充分溶解,注入RPMI 1640培养液5 ml,充分混匀,则青蒿琥酯浓度为10 mg/ml。取上述青蒿琥酯液1 ml加入终体积为10 ml的RPMI 1640培养液中,充分混匀,则青蒿琥酯浓度为1 mg/ml;参照此方法分别配备3种浓度(12.5、25.0、50.0 μg/ml)的青蒿琥酯液均于-20 ℃冰箱保存备用。
AML原代细胞及细胞株K562均分为对照组和实验组(依次为对照组1和实验组1,对照组2和实验组2),其中对照组1及对照组2不予青蒿琥酯干预,实验组1和实验组2分别添加终浓度为12.5、25.0、50.0 μg/ml的青蒿琥酯液(分别记为终浓度12.5、25.0、50.0 μg/ml实验亚组1及终浓度12.5、25.0、50.0 μg/ml实验亚组2)。
本研究价值:
(1)当前仍有部分急性髓系白血病(AML)患儿经常规治疗后出现复发或难以缓解的现象。青蒿素为我国学者首次从菊科植物黄花蒿中提取的化合物,青蒿琥酯为青蒿素类衍生物,为中国自主研发的具有倍半萜结构的青蒿素类抗疟特效药。但现阶段青蒿琥酯对白血病细胞的增殖抑制及促凋亡作用机制尚不清楚。
(2)王朦等得出青蒿琥酯能够有效抑制AML原代细胞、细胞株K562的增殖并诱导其凋亡,该结果为青蒿琥酯作为AML治疗新的靶点提供了实验依据,有望推动青蒿琥酯的进一步研究。
(3)本研究虽然证实青蒿琥酯能够有效抑制AML原代细胞及细胞株K562的增殖并诱导其凋亡,但其具体机制仍未阐述,尚需进一步研究。
1.4 采用细胞计数法观察AML原代细胞、细胞株K562细胞生存情况 分别吸取干预前、干预后24 h、干预后48 h、干预后72 h悬浮细胞10 μl置入干燥塑料离心管,加入0.2%台盼蓝染色液10 μl混匀,染色约1 min,经过染色的细胞悬液从细胞计数板的一侧缓慢加入细胞计数板,使悬液充满盖玻片,静置3 min。在低倍显微镜下(×100)观察计数板细胞数。其中呈蓝色染色的细胞为死亡细胞,而不染色的细胞为活细胞。细胞存活率=(细胞总数-蓝色细胞数)/细胞总数×100%。
1.5 采用MTT法检测AML原代细胞、细胞株K562生长抑制情况 各组加入不同浓度青蒿琥酯液后继续在细胞培养箱中孵育,一板孵育48 h,一板孵育72 h。每板在终止培养前4 h每孔加入50 μl浓度为5 mg/ml的MTT,继续孵育4 h,使MTT还原为甲臜,取出96孔板,置于平板离心机,1000 r/min离心5 min(离心半径为15 cm),弃上清液,每孔加二甲基亚砜150 pl,于微型混合器振荡10 min,使结晶完全溶解,置酶联免疫检测仪下测定吸光度(A)值。细胞生长抑制率(%)=(1-A干预/A对照)×100%。
1.6 采用流式细胞术检测AML原代细胞、细胞株K562凋亡情况 各组细胞分别在培养24 h、48 h、72 h后收集,取1×106个细胞,用预冷的PBS洗2次,然后加入10 μl的AnnexinV缓冲液悬浮细胞,各管中分别加入5 μl AnnexinV,5 μl 碘化丙啶混匀,避光放置15 min,再加AnnexinV缓冲液500 μl,2000 r/min离心5 min(离心半径为15 cm),采用FACSCalibur流式细胞仪检测细胞凋亡情况。
1.7 统计学方法 采用SPSS 19.0统计学软件进行数据分析。符合正态分布的计量资料以(±s)表示,多组间细胞存活率、生长抑制率、凋亡率比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 对照组1及实验组1各亚组干预不同时间点AML原代细胞存活率比较 对照组1及终浓度12.5、25.0、50.0 μg/ml实验亚组1干预24 h AML原代细胞存活率比较,差异无统计学意义(P>0.05);对照组1及终浓度12.5、25.0、50.0 μg/ml实验亚组1干预48 h、72 h AML原代细胞存活率比较,差异有统计学意义(P<0.05)。其中终浓度12.5、25.0、50.0 μg/ml实验亚组1干预48 h、72 h AML原代细胞存活率低于对照组1,差异有统计学意义(P<0.05);终浓度25.0、50.0 μg/ml实验亚组1干预72 h AML原代细胞存活率低于终浓度12.5 μg/ml实验亚组1,差异有统计学意义(P<0.05);终浓度12.5、25.0、50.0 μg/ml实验亚组1干预48 h AML原代细胞存活率两两比较,差异均无统计学意义(P>0.05);终浓度25.0、50.0 μg/ml实验亚组1干预72 h AML原代细胞存活率比较,差异无统计学意义(P>0.05,见表1)。
表1 对照组1及实验组1各亚组干预不同时间点AML原代细胞存活率比较(±s,%,n=3)Table 1 Comparison of survival rates of primary AML cells in control group 1 and experimental subgroup 1 at different intervals
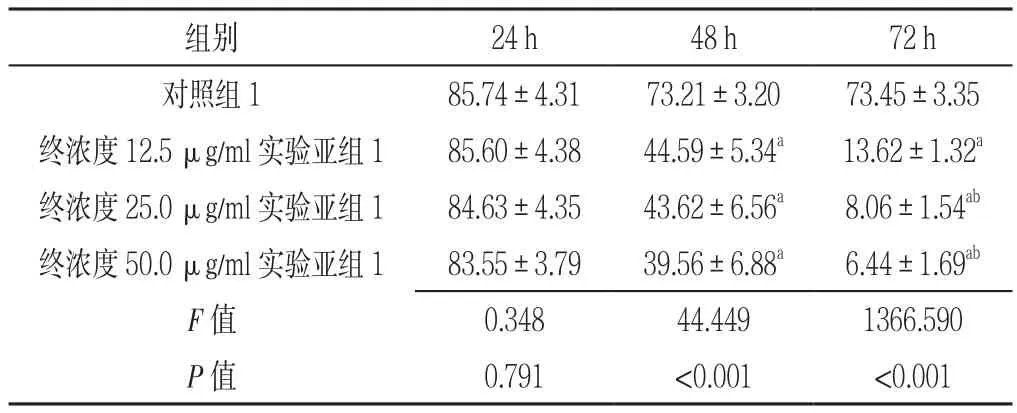
表1 对照组1及实验组1各亚组干预不同时间点AML原代细胞存活率比较(±s,%,n=3)Table 1 Comparison of survival rates of primary AML cells in control group 1 and experimental subgroup 1 at different intervals
注:与对照组1比较,aP<0.05;与终浓度12.5 μg/ml实验亚组1比较,bP<0.05
组别 24 h 48 h 72 h对照组185.74±4.3173.21±3.2073.45±3.35终浓度12.5 μg/ml实验亚组185.60±4.3844.59±5.34a 13.62±1.32a终浓度25.0 μg/ml实验亚组184.63±4.3543.62±6.56a 8.06±1.54ab终浓度50.0 μg/ml实验亚组183.55±3.7939.56±6.88a 6.44±1.69ab F值 0.34844.4491366.590 P值 0.791 <0.001 <0.001
2.2 对照组2及实验组2各亚组干预不同时间点AML细胞株K562存活率比较 对照组2及终浓度12.5、25.0、50.0 μg/ml实验亚组 2干预 24 h AML细胞株K562存活率比较,差异无统计学意义(P>0.05);对照组2及终浓度12.5、25.0、50.0 μg/ml实验亚组2干预48 h、72 h AML细胞株K562存活率比较,差异有统计学意义(P<0.05)。其中终浓度12.5、25.0、50.0 μg/ml实验亚组2干预48 h、72 h AML细胞株K562存活率低于对照组2,差异有统计学意义(P<0.05);终浓度25.0、50.0 μg/ml实验亚组2干预72 h AML细胞株K562存活率低于终浓度12.5μg/ml实验亚组2,差异有统计学意义(P<0.05);终浓度12.5、25.0、50.0 μg/ml实验亚组2干预48 h AML细胞株K562存活率两两比较,差异均无统计学意义(P>0.05);终浓度25.0、50.0 μg/ml实验亚组2干预72 h AML细胞株K562存活率比较,差异无统计学意义(P>0.05,见表2)。
表2 对照组2及实验组2各亚组干预不同时间点AML细胞株K562存活率比较(±s,%,n=3)Table 2 Survival rate of AML K562 cell line at different intervals in control group 2 and experimental subgroup 2

表2 对照组2及实验组2各亚组干预不同时间点AML细胞株K562存活率比较(±s,%,n=3)Table 2 Survival rate of AML K562 cell line at different intervals in control group 2 and experimental subgroup 2
注:与对照组2比较,aP<0.05;与终浓度12.5 μg/ml实验亚组2比较,bP<0.05
组别 24 h 48 h 72 h对照组286.06±7.2275.87±5.4276.20±5.43终浓度12.5 μg/ml实验亚组285.61±5.3341.56±5.01a 12.56±2.01a终浓度25.0 μg/ml实验亚组284.43±4.1137.23±5.30a 7.23±1.30ab终浓度50.0 μg/ml实验亚组284.70±4.7234.23±5.34a 5.23±1.34ab F值 0.11780.762725.746 P值 0.949 <0.001 <0.001
2.3 对照组1及实验组1各亚组干预不同时间点AML原代细胞生长抑制率比较 对照组1及终浓度12.5、25.0、50.0 μg/ml实 验 亚 组 1干 预 24 h、48 h、72 h AML原代细胞生长抑制率比较,差异有统计学意义(P<0.05)。其中终浓度12.5、25.0、50.0 μg/ml实验亚组1干预24 h、48 h、72 h AML原代细胞生长抑制率高于对照组1,差异有统计学意义(P<0.05);终浓度25.0、50.0 μg/ml实验亚组1干预48 h、72 h AML原代细胞生长抑制率高于终浓度12.5 μg/ml实验亚组1,差异有统计学意义(P<0.05);终浓度25.0、50.0 μg/ml实验亚组1干预48 h、72 h AML原代细胞生长抑制率比较,差异无统计学意义(P>0.05,见表3)。
表3 对照组1及实验组1各亚组干预不同时间点AML原代细胞生长抑制率比较(±s,%,n=3)Table 3 Comparison of growth inhibition rates of AML stem cells in control group 1 and experimental subgroup 1 at different intervals
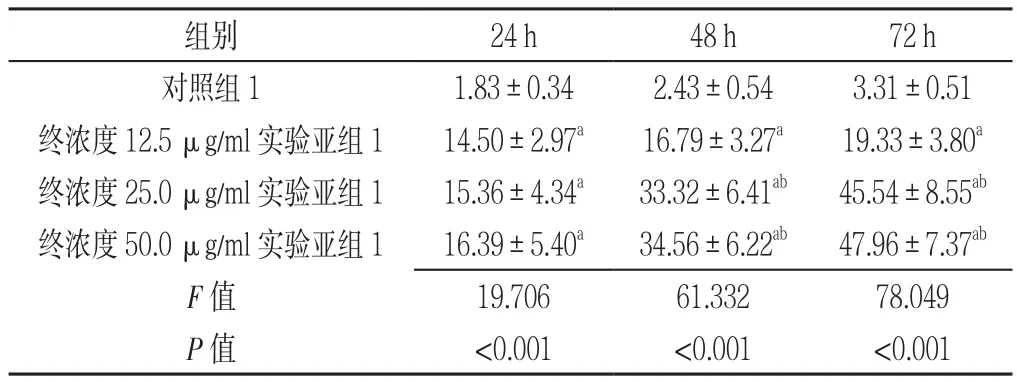
表3 对照组1及实验组1各亚组干预不同时间点AML原代细胞生长抑制率比较(±s,%,n=3)Table 3 Comparison of growth inhibition rates of AML stem cells in control group 1 and experimental subgroup 1 at different intervals
注:与对照组1比较,aP<0.05;与终浓度12.5 μg/ml实验亚组1比较,bP<0.05
组别 24 h 48 h 72 h对照组11.83±0.342.43±0.543.31±0.51终浓度12.5 μg/ml实验亚组114.50±2.97a 16.79±3.27a 19.33±3.80a终浓度25.0 μg/ml实验亚组115.36±4.34a 33.32±6.41ab 45.54±8.55ab终浓度50.0 μg/ml实验亚组116.39±5.40a 34.56±6.22ab 47.96±7.37ab F值 19.70661.33278.049 P值 <0.001 <0.001 <0.001
2.4 对照组2及实验组2各亚组干预不同时间点AML原代细胞生长抑制率比较 对照组2及终浓度12.5、25.0、50.0 μg/ml实 验 亚组 2干 预 24 h、48 h、72 h AML原代细胞生长抑制率比较,差异有统计学意义(P<0.05)。其中终浓度12.5、25.0、50.0 μg/ml实验亚组2干预24 h、48 h、72 h AML原代细胞生长抑制率高于对照组2,差异有统计学意义(P<0.05);终浓度25.0、50.0 μg/ml实验亚组2干预48 h、72 h AML原代细胞生长抑制率高于终浓度12.5 μg/ml实验亚组2,差异有统计学意义(P<0.05);终浓度25.0、50.0 μg/ml实验亚组2干预48 h、72 h AML原代细胞生长抑制率比较,差异无统计学意义(P>0.05,见表4)。
表4 对照组2及实验组2各亚组干预不同时间点AML细胞株K562生长抑制率比较(±s,%,n=3)Table 4 Comparison of the inhibition rate of AML K562 cell growth between control group 2 and experimental subgroup 2 at different intervals
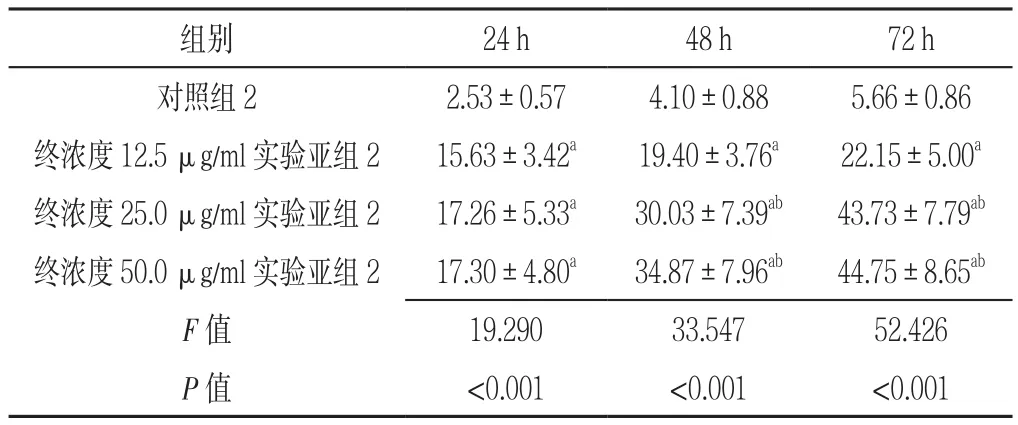
表4 对照组2及实验组2各亚组干预不同时间点AML细胞株K562生长抑制率比较(±s,%,n=3)Table 4 Comparison of the inhibition rate of AML K562 cell growth between control group 2 and experimental subgroup 2 at different intervals
注:与对照组2比较,aP<0.05;与终浓度12.5 μg/ml实验亚组2比较,bP<0.05
组别 24 h 48 h 72 h对照组22.53±0.574.10±0.885.66±0.86终浓度12.5 μg/ml实验亚组215.63±3.42a 19.40±3.76a 22.15±5.00a终浓度25.0 μg/ml实验亚组217.26±5.33a 30.03±7.39ab 43.73±7.79ab终浓度50.0 μg/ml实验亚组217.30±4.80a 34.87±7.96ab 44.75±8.65ab F值 19.29033.54752.426 P值 <0.001 <0.001 <0.001
2.5 对照组1及实验组1各亚组干预48 h AML原代细胞凋亡率比较 对照组1及终浓度12.5、25.0、50.0 μg/ml实验亚组1干预48 h AML原代细胞凋亡率比较,差异有统计学意义(P<0.05)。其中终浓度12.5、25.0、50.0 μg/ml实验亚组1干预48 h AML原代细胞凋亡率高于对照组1,差异有统计学意义(P<0.05);终浓度25.0、50.0 μg/ml实验亚组1干预48 h AML原代细胞凋亡率高于终浓度12.5 μg/ml实验亚组1,差异有统计学意义(P<0.05);终浓度25.0、50.0 μg/ml实验亚组1干预48 h AML原代细胞凋亡率比较,差异无统计学意义(P>0.05,见表5)。
表5 对照组1及实验组1各亚组干预48 h AML原代细胞凋亡率比较(±s,%,n=3)Table 5 Comparison of apoptotic rate of AML stem cells in control group 1 and experimental subgroup 1 after 48 hours of intervention
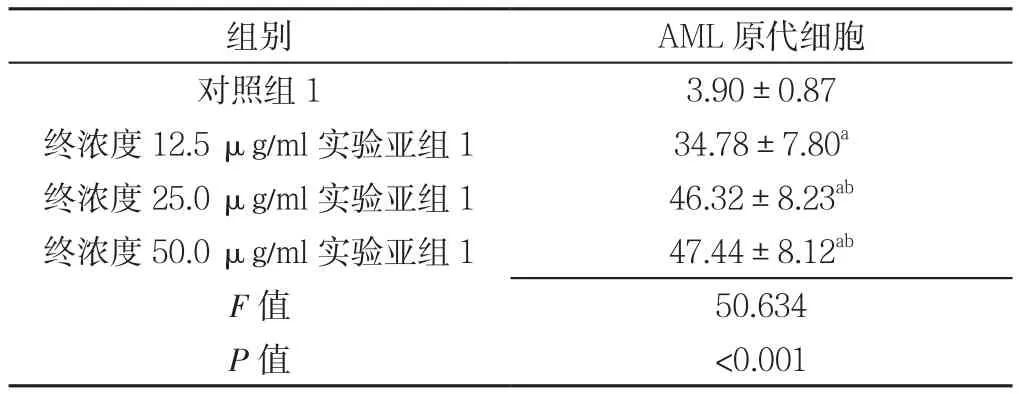
表5 对照组1及实验组1各亚组干预48 h AML原代细胞凋亡率比较(±s,%,n=3)Table 5 Comparison of apoptotic rate of AML stem cells in control group 1 and experimental subgroup 1 after 48 hours of intervention
注:与对照组1比较,aP<0.05;与终浓度12.5 μg/ml实验亚组1比较,bP<0.05;AML=急性髓系白血病
组别 AML原代细胞对照组13.90±0.87终浓度12.5 μg/ml实验亚组134.78±7.80a终浓度25.0 μg/ml实验亚组146.32±8.23ab终浓度50.0 μg/ml实验亚组147.44±8.12ab F值 50.634 P值 <0.001
2.6 对照组2及实验组2各亚组干预48 h AML原代细胞凋亡率比较 对照组2及终浓度12.5、25.0、50.0 μg/ml实验亚组2干预48 h AML原代细胞凋亡率比较,差异有统计学意义(P<0.05);其中终浓度12.5、25.0、50.0 μg/ml实验亚组2干预48 h AML原代细胞凋亡率高于对照组2,差异有统计学意义(P<0.05);终浓度25.0、50.0 μg/ml实验亚组2干预48 h AML原代细胞凋亡率高于终浓度12.5 μg/ml实验亚组2,差异有统计学意义(P<0.05);终浓度25.0、50.0 μg/ml实验亚组2干预48 h AML原代细胞凋亡率比较,差异无统计学意义(P>0.05,见表6)。
表6 对照组2及实验组2各亚组干预48 h AML细胞株K562凋亡率比较(±s,%,n=3)Table 6 Comparison of apoptotic rate of AML K562 cell in control group 2 and experimental subgroup 2 after 48 h of intervention
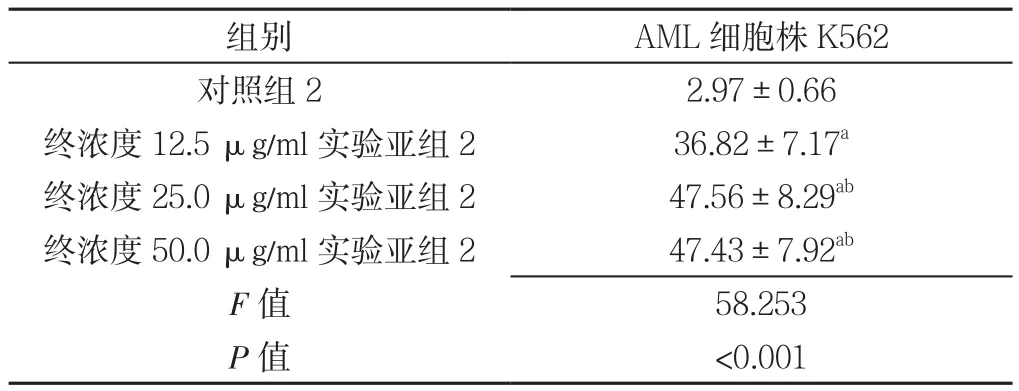
表6 对照组2及实验组2各亚组干预48 h AML细胞株K562凋亡率比较(±s,%,n=3)Table 6 Comparison of apoptotic rate of AML K562 cell in control group 2 and experimental subgroup 2 after 48 h of intervention
注:与对照组2比较,aP<0.05;与终浓度12.5 μg/ml实验亚组2比较,bP<0.05
组别 AML细胞株K562对照组22.97±0.66终浓度12.5 μg/ml实验亚组236.82±7.17a终浓度25.0 μg/ml实验亚组247.56±8.29ab终浓度50.0 μg/ml实验亚组247.43±7.92ab F值 58.253 P值 <0.001
3 讨论
针对白细胞增殖、分化和凋亡的不同信号转导途径,临床已相应研究不同作用途径的抗白血病药物,化学合成的抗白血病药物虽然疗效确切,但毒副作用明显,易产生多药耐药性,使许多患者不能耐受,尤其对儿童白血病,耐受性限制了诸多药物的使用。从祖国庞大的中药宝库中寻找、开发高效、低毒的抗白血病制剂有重大临床意义。既往研究显示,雷公藤、青黛、大蒜素、蟾酥、葛根等众多中药成分均有不同程度抗白血病作用[8-10]。青蒿素作为我国学者首次从菊科植物黄花蒿中提取的化合物,青蒿琥酯为青蒿素类衍生物,为中国自主研发的具有倍半萜结构的青蒿素类抗疟特效药,对耐药的肿瘤细胞也有效,且毒副作用小、患者易耐受[11-13]。对于白血病而言,早期陈伟等[14]、彭宇等[15]研究证实青蒿素及其衍生物对HL60白血病细胞有体外抑制作用,细胞凋亡的诱导作用突出;孙艳美等[16]的研究显示,与空白对照组比较,青蒿琥酯50、100 μmol/L处理AML细胞株K56248 h后S期细胞减少,G2期、M期细胞增加;当浓度进一步增加后,G2M期细胞减少,但死亡细胞增加到39.65%,且青蒿琥酯可导致细胞内Bax表达明显增加,由此认为青蒿琥酯可通过诱导细胞凋亡和抑制细胞增殖而发挥抗肿瘤作用,并可能对白血病具有高度敏感性。
本研究主要观察青蒿素类衍生物青蒿琥酯对AML原代细胞、细胞株K562增殖和凋亡的影响,细胞计数结果显示,作为对照的AML原代细胞、细胞株K562在干预48、72 h细胞存活率仍在70%以上,而加入不同浓度青蒿琥酯进行干预的组别干预48 h的细胞存活率均降至50%以下,且明显低于对照;青蒿琥酯终浓度为25.0 μg/ml、50.0 μg/ml的实验组干预72 h后细胞大量死亡,存活率不足10%,明显低于青蒿琥酯终浓度为12.5 μg/ml的实验组及对照组。同时,采用MTT法检测终浓度为12.5、25.0、50.0 μg/ml的青蒿琥酯对AML原代细胞、细胞株K562作用不同时间后发现,对AML原代细胞、细胞株K562的增殖抑制最适的青蒿琥酯浓度为25.0 μg/ml,表明青蒿琥酯能够有效抑制AML原代细胞及细胞株K562的增殖,且与浓度和/或时间均有关,也进一步证实了抑制细胞增殖是青蒿琥酯抗白血病的主要机制之一。此外,本研究各实验组不同浓度青蒿琥酯作用48 h后,AML原代细胞、细胞株K562细胞凋亡率明显高于相应的对照组,其中终浓度为25.0、50.0μg/ml的青蒿琥酯干预后AML原代细胞、细胞株K562细胞凋亡率明显高于12.5 μg/ml,这一点与张萍等[17]结果类似,表明青蒿琥酯能够诱导AML原代细胞及细胞株K562凋亡。李异兴等[18]认为青蒿琥酯主要通过降低线粒体跨膜电位促进细胞内凋亡物质的释放及caspase的激活来诱导细胞凋亡。欧瑞明等[19]认为青蒿琥酯可以通过抑制NF-κB通路或抑制Bcl-2/bax的表达诱导肿瘤细胞凋亡。但青蒿琥酯抑制AML原代细胞及细胞株K562的增殖及诱导细胞凋亡的具体机制仍需进一步探究。
综上所述,青蒿琥酯能够有效抑制AML原代细胞、细胞株K562的增殖并诱导其凋亡,该结果为青蒿琥酯作为AML治疗新的靶点提供了实验依据,有望推动青蒿琥酯的进一步研究,为AML的靶向治疗奠定基石。
