细胞表面壳化的研究进展
2019-10-09浩张利闯徐双梦2杜晶晶
苏 慧 许 浩张利闯 徐双梦 魏 延*,,2杜晶晶,2 黄 棣,2
(1太原理工大学生物医学工程学院生物医学工程系,纳米生物材料与再生医学研究中心,太原 030024)
(2太原理工大学生物医学工程研究所,材料强度与结构冲击山西省重点实验室,太原 030024)
生物矿化是生物体形成无机功能矿物的过程,它普遍存在于自然界[1].目前已知很多生物体都可以在有机基质调控下形成各种各样的矿化结构来满足自身需求,例如一些海洋生物利用生物矿物保护自身不受外界伤害[2],一些植物(硅藻)也可以通过形成二氧化硅细胞壁对自身进行保护等[3].但自然界中大多数细胞并不具有保护功能的壳层,且细胞的稳定性和功能性易受环境影响,因此科学家们提出"仿生矿化"的概念,即用各种材料人为包裹活细胞来实现对细胞的保护并赋予细胞新的功能,Tang等[4]率先在国际上提出"细胞壳化"的概念,为实现细胞功能化提供了一条新思路和行之有效的策略.细胞表面壳化,尤其是单细胞水平的壳化,可以结合高精度的显微成像技术和高灵敏的传感技术,从形态、亚细胞结构、蛋白含量、细胞代谢产物等方面对单细胞进行分析,揭开细胞功能化及其应用的新领域.我们认为,通过为活细胞人工制造壳结构来改进细胞固有的性质或赋予细胞新的功能对人类来说是一个重大的机遇.基于研究重点,本文主要是从单细胞水平综合介绍了目前可进行壳化的细胞种类、壳化的方法以及细胞壳化在环境与生物医学领域的应用,并对该领域的研究前景进行了展望.
1 可壳化的细胞类型
虽然细胞表面功能化的发展史只有短短几十年,但是研究者们已在多种细胞表面实现了功能化(图1).酵母菌因其典型的结构与特性,作为生物模型,较先实现了细胞壳化[5].Diaspro等[6]用聚电解质PAH/PSS包裹单个酵母菌,并研究了酵母菌的代谢功能及其生长特性等.之后在保证酵母细胞存活的情况下,进行荧光标记并导入到草履虫的体内,结果显示在草履虫体内包被的酵母菌虽然未受保护,但用聚电解质在酵母菌表面进行壳化的方法是可取的.Tsukruk等[7]使用了一种pH敏感性的包被层包埋酵母细胞,从而能够通过调节pH值的变化来控制酵母菌的生长.唐睿康课题组[8]研究发现,受多糖细胞壁结构的影响,电荷密度较低导致酵母细胞表面难以直接形成钙矿物层,而通过层层自组装的方法引入功能聚合物聚丙烯酸(PAA)后,可显著提高细胞矿化能力.因PAA具有高密度的羧酸基团,为钙矿物提供了活性成核位点.当吸附的PAA分子位于酵母细胞的最外层时,羧酸基团向水-聚合物界面迁移并结合Ca2+离子.在与钙化溶液接触后,重组的表面诱导钙矿物质的异质成核,细胞的矿化能力大大提高.
在酵母细胞上取得成功后,研究者们又转向原核生物领域,在细菌、孢子、蓝藻、益生菌[9-10]等原核细胞上也实现了聚电解质膜和无机矿物壳的包裹.例如,Mirkin等[11]用单层纳米金颗粒(gold nanoparticles,AuNPs)包被黑曲霉菌、特异青霉菌、毛霉菌和链霉菌的活细胞体;Johnson等[12]报道了一种喷雾干燥的方法,将K12大肠杆菌完全封装在脂质二氧化硅纳米复合材料中,发展了一种新的生物壳化技术;利用基因工程技术在具有非细胞结构的M13噬菌体表面合成混合金钴氧化物外壳也获得了成功[13].
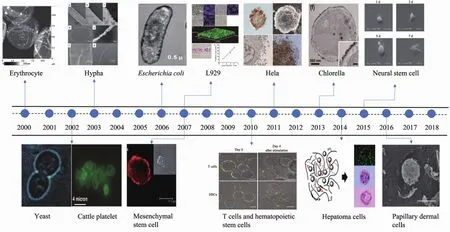
图1 细胞表面功能化的发展过程及所应用的细胞种类[11,15,27-36]Fig.1 Development of cell surface functionalization and the types of cells applied[11,15,27-36]
对于高等真核生物细胞,人们同样尝试利用生物壳工程的技术对其进行表面修饰.早期研究者们在多种类型的动物细胞上实现了包裹,包括人血红细胞、血小板、胰岛细胞、胚胎干细胞、T淋巴细胞等[14-21].匡洁等[22]用海藻酸钠/壳聚糖/海藻酸钠(ACA)微囊包裹肝细胞,并对包裹后肝细胞的功能以及活性进行探索,发现被包埋的肝细胞可在较短的时间实现细胞扩增,外周的微壳对肝细胞的活性无影响,但可阻挡大分子免疫球蛋白,两者结合有利于维持肝细胞白蛋白分泌功能及细胞活性.近年来,人们对间充质干细胞的研究成为新的热点.此前,对间充质干细胞的封装主要是通过制备胶原微球来实现[23],而Etter等[24]利用微流体设备(MFDS)在人间充质干细胞外制备了均相并且力学性能可调的海藻酸盐微球.基于以上多种生物细胞表面修饰取得的成功,研究者们思考,能否采用同样的方法,对难以控制的癌细胞进行某些功能设计?宋旸等[25]用亲水性的琼脂糖包裹大鼠的乳腺癌细胞(SHZ-88),使其在凝胶内部生长,并收集其上清液作用于人类乳腺癌细胞(MCF-7),发现可以有效抑制人MCF-7细胞的生长.本课题组的Wei等[26]通过聚电解质诱导,成功在癌细胞表面形成人工的矿物质外壳,研究发现这种外壳可能会有效地限制癌细胞的迁移和侵袭能力.
2 细胞表面壳化的方法
2.1 层层自组装法
层层自组装(LBL)技术,是上世纪90年代发展起来的一种简易、多功能的表面修饰方法,它借助不同层分子之间的相互作用(如静电力,氢键,配位键等)逐层交替沉积在带电模板上,使层与层之间形成稳定的具有某种特定功能的分子聚集体或超分子结构.这种技术被认为是制备复合薄膜的一种有效手段,已经被广泛应用于细胞表面包裹纳米材料领域[28,37-38](图 2).
许碧超[39]利用带相反电荷的PDDA/PSS在大肠杆菌细胞表面交替沉积形成膜结构,静电作用亦可有效吸附二氧化硅纳米粒子在其表面成壳,实现了单细胞的包埋,虽然聚电解质复合膜能够影响大肠杆菌的形貌,但二氧化硅外壳能够提高细胞抵抗渗透压的能力,且包裹复合膜的大肠杆菌仍然保持了良好的生长、分裂能力.李文龑[40]用层层自组装的方法以明胶/藻朊酸为聚电解质包裹神经干细胞,并证实包被的神经干细胞其存活增殖以及分化不会受到明显的干预,而后利用同样的技术将修饰胰岛素生长因子-1(IGF-1)的藻朊酸跟明胶包裹在细胞表面,IGF-1被持续释放并呈现pH依赖性.雄鹰等[41]用改性的壳聚糖代替聚赖氨酸为聚电解质,制备了由海藻酸钠/壳聚糖包被的SK-OV-3细胞,将其移植到小鼠的腹腔内,结果表明SK-OV-3细胞在小鼠的腹腔内保持良好生长状态.Carter等[42-43]结合氢键LBL法,利用鞣酸(TA)与聚吡咯烷酮(PVPON)包埋活性酵母细胞,且包埋后的酵母细胞活性较高.Yang等[44]运用聚多巴胺与酵母细胞表面蛋白的胺基或巯基的共价键作用在酵母细胞表面包覆成膜,有效地提高了酵母细胞抵抗溶壁酶的能力.
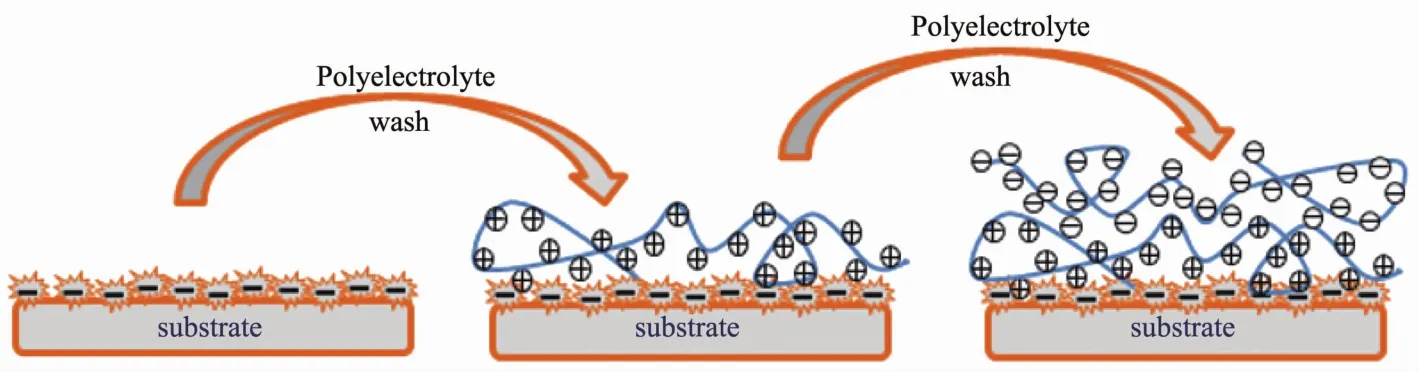
图2 在层层自组装过程中高分子在基底表面吸附过程Fig.2 Polymer adsorption process on the substrate surface during layer upon layer self-assembly
2.2 水凝胶法
生物医用水凝胶是一种含有大量亲水基团而呈现较大的吸水、溶胀特性的三维网状高分子材料,具备良好的生物相容性和生物可降解性;此外,其质地柔软,可模拟机体为细胞粘附、生长等过程提供相似的营养及气体环境.细胞表面水凝胶壳化结构不仅可以降低细胞治疗过程中的免疫排斥反应,而且可以提高细胞的结构稳定性.常被用作细胞表面水凝胶壳化的材料有琼脂、胶原、海藻酸盐、多聚赖氨酸等[23,45-48].
目前,以水凝胶作为细胞外壳化材料修饰干细胞的方法已经得到了较为广泛的应用.商青青等[49]用透明质酸水凝胶包裹骨髓间充质干细胞,通过体外、体内等实验表明透明质酸水凝胶能够提高移植细胞的存活率,且比较移植后4周大鼠的射血分数发现,透明质酸水凝胶修饰的骨髓间充质干细胞移植到载体后,能够有效地促进大鼠心肌梗死后心功能的改善.李会敏[50]以3-丙烯酰胺基苯硼酸(AAPBA)和N-异丙基丙烯酰胺(NIPAM)为原料,马来酰化葡聚糖(Dex-Ma)为交联剂制备了兼具温度敏感性和葡萄糖敏感性的水凝胶材料,并用它来包裹胰岛瘤细胞.研究发现,水凝胶-胰岛瘤细胞复合体系具备糖浓度调控胰岛素分泌模式,为水凝胶体系实现细胞生存环境的仿真提供了可能.
2.3 溶胶-凝胶法
溶胶-凝胶法,是将化合物通过水解、缩聚等反应形成稳定的溶胶体系,经陈化形成凝胶,最后通过干燥、烧结等手段制备出具有纳米亚结构材料的方法.因其反应条件温和,且可以在短时间内实现分子水平的均匀混合,使得其在材料学、催化剂、色谱分析等领域得到了较为广泛的发展.虽然传统溶胶-凝胶法的反应条件已经很温和,但是对于具有活性的生物来说,其反应过程具有一定的刺激性.
丁霖等[51]运用溶胶-凝胶法制备了金纳米粒子-壳聚糖(GNP-CHIT)复合材料,该复合凝胶不仅可以有效地固定K562白血细胞,而且可以在保持细胞活性的基础上,提升细胞与电极之间的电子传递效率.Helen等[52]通过溶胶-凝胶法在细胞与二氧化硅载体材料之间引入了脂质界面,有效地缓解了细胞在SiO2干燥过程中所受到的作用力,从而降低了细胞的失活率.随后,Dickson等[53]和Meunier[54]等利用二氧化硅凝胶良好的光透过性、其介孔结构可传输物质等特性,将它应用于蓝藻、拟南芥细胞等光合作用的研究中,发现形成的二氧化硅凝胶外壳可有效地提高光合作用的效率.
2.4 基因修饰法
基因修饰,就是指利用分子生物学基因工程方法对宿主细胞的DNA序列进行特异性修饰,然后将目的基因导入宿主细胞,从而使宿主细胞的基因型发生改变,并实现特定的可遗传功能化改造.在自然界中,许多天然生物矿物都是由于生物体自身的生物矿化作用产生.例如,鸡蛋壳的形成是由于鸡蛋壳膜所表达的角蛋白硫酸盐诱导碳酸钙沉积成核,使方解石在其表面生长成壳[55].这一现象启示我们可以通过在细胞的可表达基因序列中引入特殊目的基因来促使细胞进行相关表达以赋予细胞新的功能.
Takahashi等[56]借助逆转录酶病毒,将基因注入到人体皮肤细胞,成功将分化的人体皮肤纤维细胞改造成与胚胎干细胞类似的"万能细胞",这种技术能够用于多种疾病的治疗,在生物医学领域产生广泛影响.Müller等[57]将硅矿化基因(Silicatein-α)修饰到大肠杆菌的基因序列中,经过异丙基-β-D-硫代半乳糖苷(IPTG)诱导后的大肠杆菌表达了硅酸盐蛋白,从而实现了活性大肠杆菌能够在硅酸溶液中自发性硅矿化的功能(图3).郑宝玉[58]以人瘦素(human leptin)基因修饰骨质疏松大鼠骨髓基质细胞与β-磷酸三钙(β-TCP)结合构建了组织工程化复合物,该复合物不仅具有体内异位成骨的能力,而且可促进患有骨质疏松症大鼠牙周组织缺损处的再生,为牙周组织工程的研究与治疗提供了支持.基因修饰法因其可遗传性得到了较为广泛的关注,但基因组容量巨大,基因表达的不稳定性也对该方法的应用产生一定的限制.
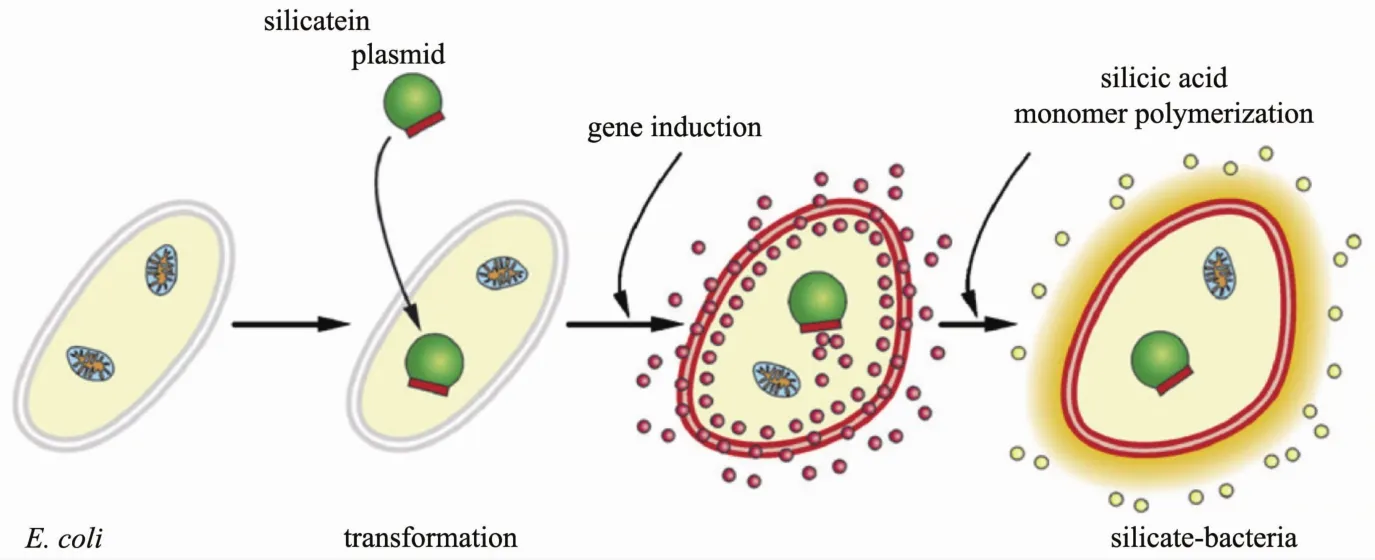
图3 大肠杆菌与聚硅酸盐的封装方案[57]Fig.3 Scheme of encapsulation of E.coli with poly(silicate)[57]
3 细胞表面壳化的材料类型
自从在生物细胞表面进行壳化修饰实现细胞功能化以来,不同种类的材料被用于细胞表面壳化赋予细胞新的功能.细胞表面功能化所包裹的材料主要分为聚合物、无机材料、金属纳米粒子以及生物活性分子等[59].
3.1 聚合物
聚合物因其具有丰富的基团被用于构建细胞表面壳层,早期主要是以细胞为模板而获得多种形状的聚合物胶囊(capsules)进而用在药物缓释、组织工程等领域.其中最常用的聚合物是聚电解质.由于自然界存在的细胞种类各异而形状各异,该技术基于细胞表面的静电性质,需要在带有微弱电荷的细胞表面上进行聚电解质多层自组装 (因为细胞表面电荷在几纳米厚度的层中分布不均匀,第一层吸附的聚电解质不能完全补偿细胞表面这种空间分布的表面电荷),最终在细胞表面形成了聚电解质壳,随后细胞溶解,得到大小和形状可控的聚电解质微胶囊,这在本质上复制了原始细胞的形态.一般来说,聚电解质微胶囊壳层特性会由模板细胞类型、消化过程、聚电解质种类的性质、溶液性质等因素决定.包裹了聚电解质的细胞表面电荷可以反转 (正变负、负变正)、细胞表面可以根据应用要求变得或疏松或致密、细胞表面的渗透性也可调控(0.1~15 nm的孔径)[60-61].聚电解质因所带电荷不同可以分为聚阳离子和聚阴离子两种,其中常用的聚阳离子化合物有:聚二烯丙基二甲基氯化铵(PDDA),聚丙烯胺盐酸盐(PAH),聚乙烯亚胺(PEI),聚多巴胺(PDA),聚赖氨酸(ε-PL)以及壳聚糖(CHI)等;而聚阴离子化合物有:聚苯乙烯磺酸钠(PSS),聚丙烯酸(PAA),聚谷氨酸(Glu)以及明胶(GE)等.
聚合物材料不仅成功用于细胞表面壳层的构筑,还能够作为催化模板,诱导无机纳米材料在细胞表面形成无机壳层.以往的研究发现,电子相互作用是生物矿化的关键因素[62-63].一般认为,在生物定向矿化作用中最活跃的蛋白质含有富含羧基或其他带电官能团的区域[64-65].通过在细胞表面构建带有羧基的聚电解质壳层,将会促进细胞表面生物仿生矿化的发生,这也是获得良好无机壳层的前提.后来的研究中发现,聚电解质包裹细胞之后会改变细胞某些功能,具体的机理目前揭示较少,推测是因为聚电解质影响细胞表面关键蛋白的分泌,进而影响信号分子顺利表达.Diaspro等[5]用层层自组装技术,将PAH/PSS成功封装在酵母细胞表面;Yang等[44]成功地在酵母细胞表面包裹了功能性的多巴胺壳,研究表明,多巴胺包裹的酵母细胞具有良好的生物活性,但相较于未修饰的细胞,细胞分裂的滞后期随着包裹层数的增加而增加;Tabrizin等[28]用天然聚电解质(壳聚糖、海藻酸、透明质酸、寡核苷酸)在大肠杆菌细胞表面进行了壳化;Wu等[66]报道了一种通过明胶和聚乙二醇交联实现对单个Hela细胞纳米封装的温和方法.这些实验均显示出用聚电解质包裹的细胞仍具有良好的生物活性.
3.2 无机材料
自然界的生物在亿万年进化过程中,都有一套完整的保护程序,细胞表面具有细胞膜,一些细胞还有较厚的、力学性能更好的保护壳,例如鸡蛋、硅藻、贝类等.但是一些生物细胞并不具备以上的特征,因表面缺乏可以成壳的基团而无法自身壳化.面对日益严峻的气候变化以及生物医学研究的要求,研究者从自然界得到启发,结合聚合物壳的易操作性,基于生物仿生矿化技术,可先在细胞表面构建聚合物壳层为无机矿物提供成核位点,进而实现无机矿物壳层的包覆[67],保护细胞免受极端环境的刺激,甚至还在细胞贮存、疫苗保存以及异体输血等领域都有较多的应用.目前,应用于细胞表面功能化的无机材料主要有碳酸钙[8,68]、磷酸钙[69-71]、二氧化硅[72-74]、氧化锌、碳纳米管、石墨烯以及四氧化三铁等.这些无机材料因其所具有的特殊理化性质备受关注,例如碳酸钙和磷酸钙是人体主要的钙源,是一些组织器官的组成部分,具有良好的生物相容性,本课题组研究人员制备了多种晶型纳米羟基磷灰石,并研究了其在人体骨修复等领域的应用[75-81];氧化锌具有一定的抗菌性;碳纳米管跟石墨烯具有良好的导电性;四氧化三铁具有较强的磁性等等.由于所选模板细胞不同、所需功能不同,故而沉积的无机材料也不同,研究表明,调控钙矿化的通常 都含有羧基(-COOH)[63,82-85],而调控硅矿化的通常带有(-NH2)或-NH-[68,86-92].
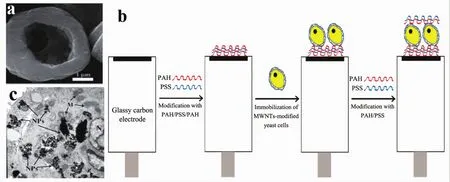
图4 (a)酵母细胞去除后的碳酸钙中空微胶囊的电镜图[93];(b)将酵母细胞固定在玻碳电极上的示意图[68];(c)NP在WSG-Fe3O4-SK-OV-3上分布的透镜图[95]Fig.4 (a)Electron microscopy of calcium carbonate hollow microcapsules removed from yeast cells[93];(b)Schematic representation of the immobilization of yeast cells onto glassy carbon electrodes[68];(c)Lens diagram of NP distribution on WSG-Fe3O4-SK-OV-3[95]
Fakhrullin等[93]还直接将碳酸钙沉积在酵母细胞的细胞壁上,将单个活酵母细胞封装在CaCO3微壳中,制备了细胞-无机核-壳的混合微粒子(图4a),证明了用碳酸钙包覆细胞的可行性.另外Fakhrullin等[68]还用聚电解质逐层组装的方法将碳纳米管包裹在聚电解质PAA/PSS包裹的酿酒酵母细胞的表面,然后又包裹了双层聚电解质(图4b),研究证明,包裹的细胞有良好的生物活性,最后,采用伏安法和电化学阻抗法进行了电化学研究,表明复合聚电解质/多壁碳纳米管涂层的酵母细胞与人工电子受体之间有足够的电子介导作用,从而有可能区分细胞的死活.Xiong等[94]在蓝藻上诱导形成人工仿生硅化外壳,发现并证明被二氧化硅包裹的蓝藻细胞在高光照的条件下体现出更强的光合作用能力,二氧化硅壳层不仅起到了保护细胞的作用,而且有助于生物质的积累,对生物能源的利用有重要的意义.Huang等[69]还用层层自组装的方法制备了由磷酸钙包覆的酵母细胞,通过高温煅烧去除酵母细胞得到粒径均匀的磷酸钙多孔微胶囊,可用于载药或与其他多功能材料结合作为组织工程支架.Dzamukova等[32]报道了利用超顺磁阳离子纳米粒子通过单步生物相容性过程来实现在活的HeLa细胞表面的简单功能化,磁性纳米粒子被固定在细胞膜上,不会穿透细胞质.通过外部磁场的控制,被磁性纳米粒子包裹的HeLa细胞可以在某些特定的位置上进行空间积累,并在这些位置进一步生长.本课题组的Wei等[95]制备了包覆WSG肽的Fe3O4纳米粒(NPS),对其磁化强度与细胞相容性进行测试,并将其组装到癌细胞的表面,结果表明包覆WSG肽的NPS具有靶向肿瘤的特性,可用于肿瘤诊断与治疗领域(图4c).
3.3 金属纳米粒子
金属纳米粒子自发现以来引起了广泛的关注,它所具有的特殊的性质使其在生物细胞表面功能化领域占据重要的地位.不同的金属纳米粒子往往具有不同的功能,在细胞表面包裹这些纳米金属材料可以赋予细胞某些特殊的性质[96],比如金纳米粒子聚集产生从红到蓝的颜色变化被用于DNA的检测[97];纳米银粒子具有广谱的抗菌性能在生物医学等方面具有广泛的应用[98];钯纳米粒子作为Suzuki反应的催化剂越来越受人关注[99].
姚成立等[100]在酵母细胞有氧呼吸的过程中结合维生素C用LBL的方法在其表面制备了银质外壳,结果表明,制备的银质外壳可以有效地保护酵母菌不被化学试剂毒害.Fakhrullin等[101]报道了一种用PAH/PSS在酿酒酵母和曲霉上包裹牛血清白蛋白/DNA和柠檬酸修饰的金和银纳米粒,结果表明,纳米粒子有效地结合在相对带电的聚电解质层之间,改变了细胞壁的形貌和粗糙度,并且被包裹的细胞保留了它们的生存能力.马广磊[102]通过加热还原,紫外还原,水合肼还原等几种不同的方法成功将Ag纳米粒子和Pd纳米粒子包载于酵母细胞和巨大芽孢杆菌细胞中.这个研究可以进一步用于将金属纳米粒子导入巨噬细胞,实现细胞内的金属催化反应,同时酵母细胞为催化剂提供了新的生物载体,与银结合可以形成一种新的具有良好生物相容性的抗菌材料.
3.4 生物分子
生物分子具有生物活性、生物相容性以及可降解性等天然优势且含有丰富的活性基团,有利于与功能基团结合,是细胞表面功能化重要的材料来源,但又因为其稳定性低等缺点限制了它的应用与普及,所以目前关于在细胞表面进行生物分子壳化的报道并不多[71,103-105].
Drachuk等[106]展示了一种高效的封装方法,成功将蚕丝蛋白纳米壳包裹在酵母菌表面(图5).与传统的人工壳层相比,这种蚕丝蛋白纳米壳层有助于细胞的初始保护,并允许它们在封装一段时间后再被细胞完全降解.Matsuzawa等[107]将纤连蛋白和明胶形成的复合物以及Ⅳ型胶原和层粘连蛋白形成的复合物通过层层自组装方法包裹在肝癌细胞表面,相比于传统的聚电解质包裹的细胞,在离心多次后其生物活性仍是传统的1.4倍.生物分子具有可降解功能和生物适应性,在细胞输送领域具有潜在的研究价值,另外若在壳层中引入细胞生长因子也能够提高细胞的生物活性.
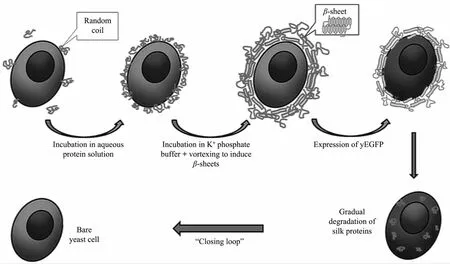
图5 用LBL方法将蚕丝蛋白纳米壳包裹在酵母菌表面的示意图[106]Fig.5 Schematic representation of silk-on-silk LbL deposition to form silkⅡrich structure on the surface of yeast cells[106]
3.5 杂化复合物
一般杂化复合物包含2种或2种以上不同的材料,因其所具有的多种功能而吸引了研究者的目光[108-110],很多研究者尝试在生物细胞表面包裹复合物以赋予细胞多种功能.
Choi等[111]在硅酸衍生物的仿生缩聚过程中加入(3-巯基丙基)三甲氧基硅烷(MPTMS),将硫醇官能团直接掺入二氧化硅壳中,通过多肽作用将二氧化硅/二氧化钛纳米复合物固定于酵母细胞表面形成纳米复合壳,壳化后的细胞不仅保持了原有的生物活性,其热稳定性也显著提高(图6),这恰恰也证明了二氧化硅和二氧化钛的协同作用能够赋予细胞更多的功能.此外,Choi等[112]还在酵母细胞表面构建了鞣酸与Fe3+离子形成的纳米复合物壳层.这种壳层不仅能够保护细胞免受紫外辐射、溶菌酶裂解的影响,而且还能通过降解壳层控制细胞分裂,实现化学上的"孢子形成"和"出芽生殖".姜楠等[113]在酵母细胞表面构建了由涂有L-半胱氨酸的金纳米粒子和自组装无定形二氧化硅的生物混合层组成的双层纳米壳,与传统的聚电解质膜相比,该壳层有更好的生物相容性,同时它能够导电和磁性功能化,用于保护细胞免受多种刺激.
4 细胞表面壳化的应用
由于能够通过细胞表面壳化来赋予细胞功能的材料多种多样,其实现的功能也各不相同,且加上不同种类细胞的特性也不同,故细胞表面壳化的应用领域也十分广泛,包括生物、化学、能源或医疗等方面.这些领域相互交叉,根据常用领域在这里可大体分为两大类,一类是能源、环境领域,另一类则是生物、医学领域[114].
4.1 能源、环境领域
4.1.1 环境治理
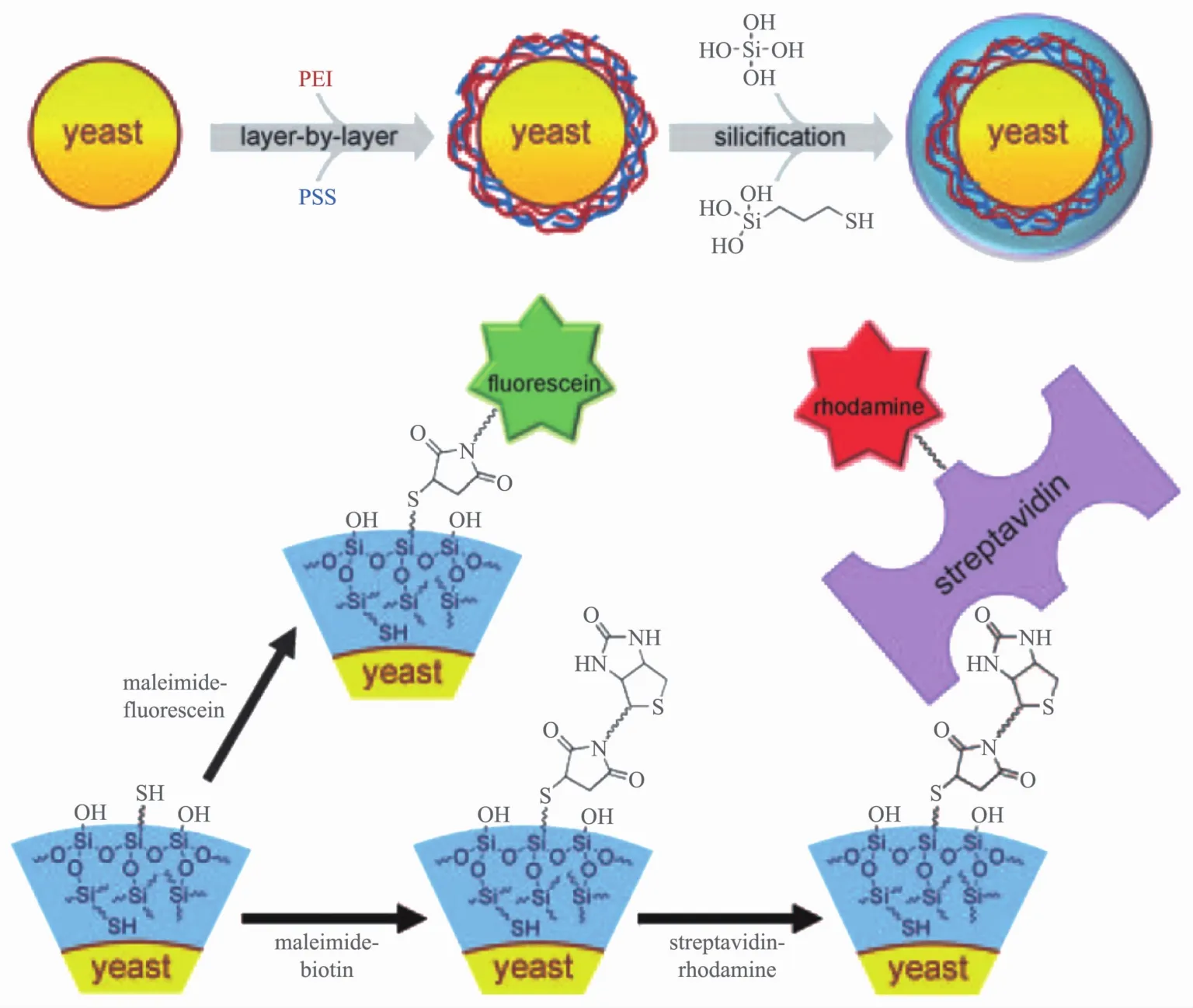
图6 将单个酵母细胞封装在硫醇功能化二氧化硅(SiO2)壳内,并在SiO2壳上引入荧光素或链霉菌素[111]Fig.6 Encapsulation of individual yeast cells in the thiol-functionalized silica(SiO2SH)shells and the introduction of fluorescein or streptavidin onto the SiO2SHshells[111]
随着工业的发展,环境污染问题也日益严重,大量含有氮、磷的废污水造成的水华现象以及重金属污染对人们的日常生活造成严重的威胁.因此如何处理好被污染的废水成了一个难题.很多研究者将目光转向了生物去污的方向.生物去污是一种利用生物体(例如植物[115]、微生物)将污水中重金属离子等去除的方法,与传统的治污方法相比,它的成本较低且环保有效[116-118].江慧[119]用海藻酸钠-明胶-聚乙烯醇包埋酵母菌,并对其吸附重金属的能力进行研究.Yang等[120]报道了一种在正常生长条件下,利用Ca2+与CO2的内源反应在酵母细胞表面制备功能性CaCO3支架的方法(图7),并以Pb2+为例,进一步研究了功能化细胞去除重金属的能力.实验证明,对比普通酵母细胞,功能化的细胞对Pb2+的吸附能力要大于酵母细胞.此外,CaCO3和PbCO3之间的沉淀转化可能只发生在功能化细胞中,最重要的是,这种方法能有效地去除水溶液中的微量杂质.这种在细胞表面构筑壳层实现功能化的方法不仅能够提高细胞的去污能力,而且有可能实现更多的功能,例如选择性地降解污染物、实现除污细胞的快速分离等[110],在环境保护中具有重要的应用价值.针对水华现象,卢瑞瑞[121]探究了纳米材料TiO2光催化对藻类细胞(依藻,微囊藻)的影响,发现纳米TiO2光催化作用在紫外光照射下比在自然光光照下对藻类细胞破坏大,而且照射时间越长破坏越大.熊威[122]则以微囊藻细胞作为模型,利用带胺基的阳离子聚电解质,实现细胞与二氧化硅纳米颗粒的快速结合.二氧化硅修饰的微囊藻细胞迅速变为聚集态,并在短时间内完全沉降到水底.沉降到水底的微囊藻细胞,不仅光合生长受到抑制,而且几乎停止释放藻毒素.该研究为预防水华提供了一种安全有效、成本低廉的策略.
4.1.2 生物电池
由于过度的开发滥用,能源危机日益严重,为满足人们对能源的需求,生物电池应运而生.众所周知,单细胞生物内含有大量的碳、氮化合物,是天然的碳源和氮源[123].在细胞表面功能化之后,吸附了金属离子的生物细胞经过碳化处理可以得到金属或金属氧化物与碳的复合材料,这种材料具有良好的导电性,是用来制造生物电池的一种新选择[124].Du等[125]以酵母菌作为介孔结构模板合成了Li3V2(PO4)3/C微球,其中钒阳离子与带负电荷的亲水性基团结合,分别通过静电相互作用和代谢调节在酵母细胞壁表面和细胞内部自组装.该微球具有较高的比表面积和合理的孔径分布,大幅度增加了储锂活性,同时也缩短了锂离子迁移和扩散的距离.Yin等[126]将酵母和石墨烯等混合在还原性气氛下经高温碳化得到了具有三维构造的碳/石墨烯(3D-NHPC/G)复合材料(图8),该材料具有很高的电子传递能力,是制作超级电容器电极的理想材料.还有一些细胞本身就具有带电的性质,像是某些发电的鱼类[127]中与发电相关的细胞都可以进行修饰成为性能更佳的生物电池.这些生物电池利用了自然界的生物体将化学能转化为电能,因其绿色高效得到了大家的认可,具有广阔的应用前景[128].
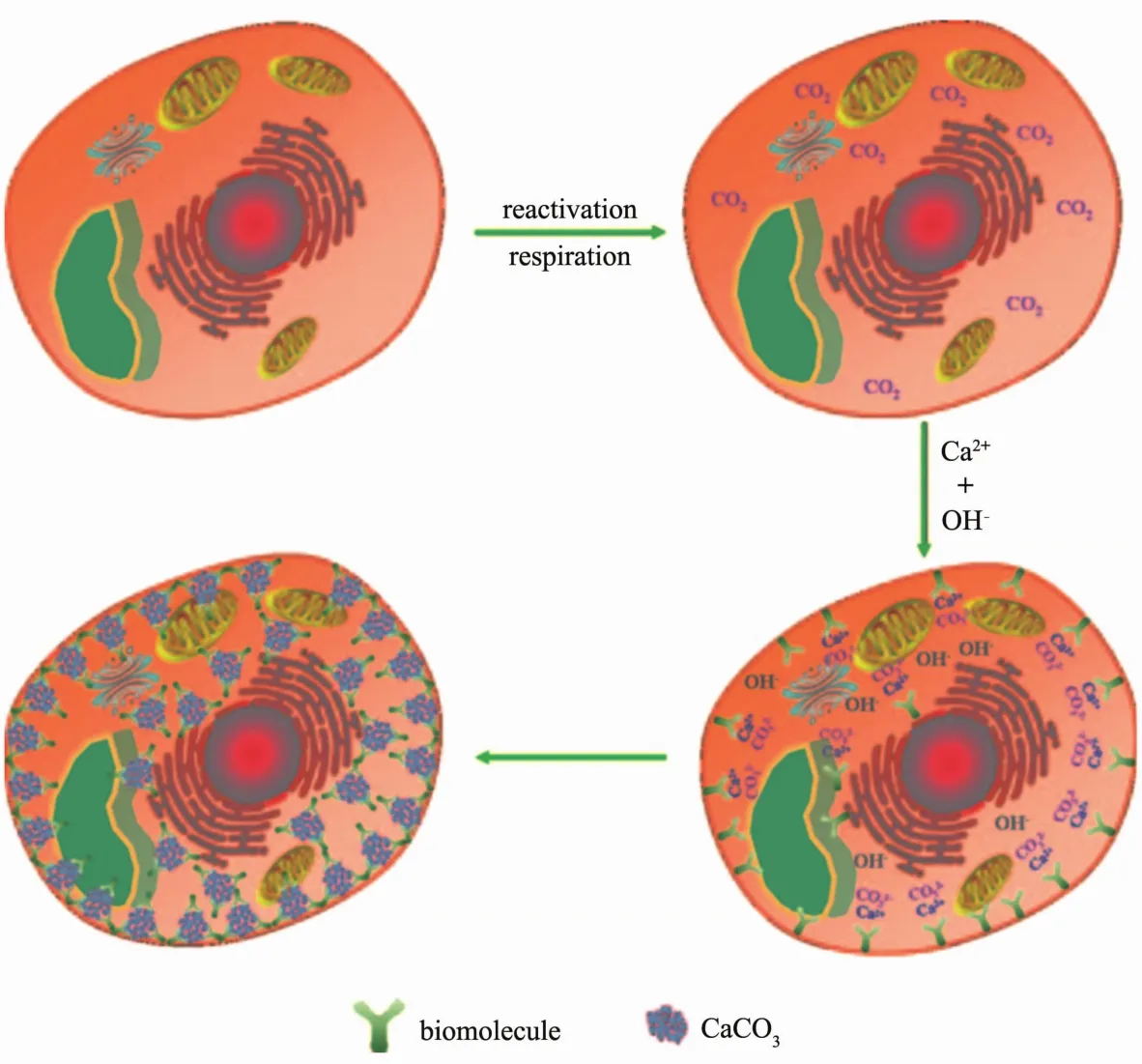
图7 内源性生成碳酸钙纳米颗粒支架的功能化细胞的形成机制[120]Fig.7 Formation mechanism of functionalized cell with endogenous production of CaCO3nanoparticle scaffold[120]
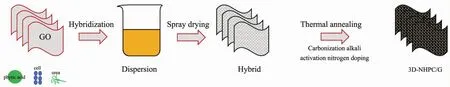
图8 三维构造的碳/石墨烯(3D-NHPC/G)复合材料的制备工艺[126]Fig.8 Procedure for the fabrication of 3D-NHPC/G[126]
4.2 生物、医学领域
4.2.1 细胞保护与保存
细胞的功能性外壳像件外衣,将细胞紧紧地包裹住,但同时它还具有一定的渗透性,被包裹的细胞与外界仍能进行物质交换.即使外界环境恶劣,被修饰的细胞都能在免受外界伤害的同时保持一定的活性.通过改变在细胞表面所包裹的材料种类,可以保护细胞免受多种伤害[72,94,113].Zhao等[129]通过设计纳米材料作为人工细胞器,来消除细胞毒性.研究发现金寡核苷酸(Au-ODN)组成的纳米复合材料可以捕获标准化疗药物阿霉素(DOX),阻止药物进入细胞核.体内实验证明,Au-ODN纳米材料可以选择性地富集在肝细胞内,消除了氧化还原引起的肝毒性,提高了细胞抵抗化疗环境威胁的能力(图9).这一研究表明,将功能材料作为生物细胞器引入生命系统,可能是保护细胞在更复杂条件下生存和制造超级细胞的新策略.Wang等[130]在斑马鱼的囊胚期成功在其表面诱导沉积了一层可以吸收紫外线的磷酸镧铈铽矿化层.实验证明,在短时间高功率和长时间低功率的紫外辐射的情况下,人工矿物壳可以有效地吸收紫外线辐射,从而保持胚胎状况良好;相比之下,未被包膜的胚胎在此情况下无法存活.另外在细胞存储方面,目前所常用的液氮冷冻保存的方法会对细胞造成很大的伤害,往往有部分细胞无法复苏而凋亡,因此设想能否采用生物壳化的技术来实现细胞室温下的长期保存[67].Wang等[131]以一株日本脑炎减毒活病毒为模型,在生理条件下,通过仿生原位矿化手段用磷酸钙诱导病毒发生矿化,在不改变疫苗原有的生物活性及感染功能的情况下,合理设计了热稳定疫苗.这一实验在疫苗的常温保存方面有重要的意义.
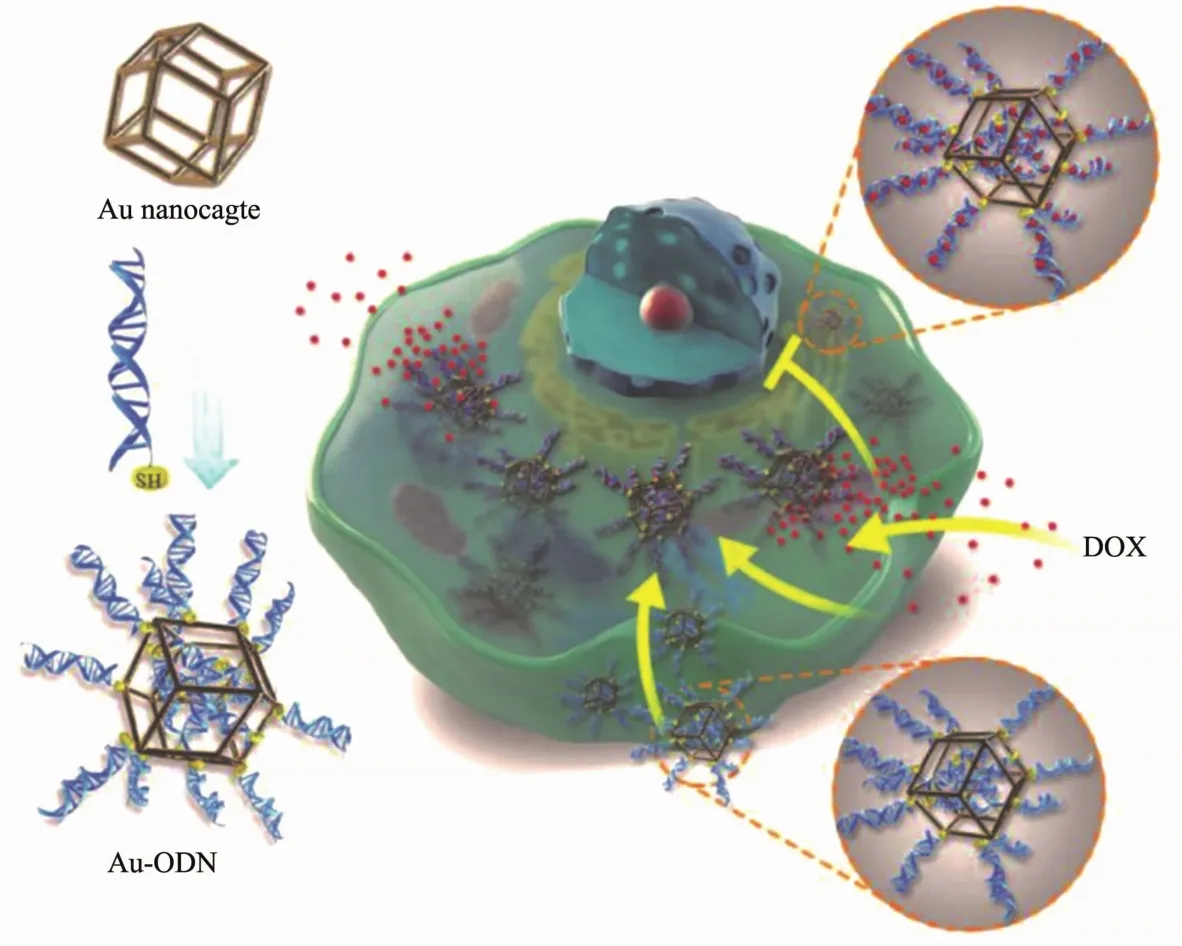
图9 Au-ODN的结构示意图及其作为细胞内纳米材料细胞器的工作原理[129]Fig.9 Schematic of construction of Au-ODN and its working principle as nanomaterials based organelle within the cell[129]
4.2.2 细胞输送与治疗
细胞治疗是指利用某些具有特定功能的细胞特性,将经过生物工程手段处理过的健康细胞靶向运输到受损器官或组织,从而达到治疗疾病的目的.根据人们的需求,利用生物壳工程的手段在细胞表面形成壳层能够提高细胞运输的效率,而且通过在细胞表面增加功能基团能够使细胞与药物特异性结合,实现药物的定点释放,大大提高细胞治疗效率.另外细胞壳化还为实现细胞的操纵治疗提供了可能[110],例如,人工在干细胞表面包裹纳米磷酸钙颗粒,不仅可以保护细胞,而且可以诱导干细胞向成骨细胞分化,是一种理想的骨修复活性材料[132-133];在细胞表面引入磁性纳米壳层也能够在外加磁场作用下实现细胞治疗可控地快速传递与分离[134];可以设计形成人造矿物外壳来包围癌细胞,使得癌细胞与底物之间的关联受到干扰或抑制,并由于人造矿物外壳的限制,癌细胞的运动能力会被削弱或抑制[26].Zhao等[135]提出癌细胞靶向钙化(CCTC)的方法,选择叶酸受体(FR)过表达的HeLa细胞,来吸附叶酸(FA)分子,然后在局部富集Ca2+,诱导特定的细胞钙化,并由此产生的钙矿物包裹癌细胞,诱导癌细胞死亡.研究结果表明,与传统化疗相比,CCTC治疗可以有效抑制肿瘤生长和转移,而不损害正常细胞.这一成果可能代表了一种用选择性钙化替代硬化治疗肿瘤疾病的方法(图10).Zhu等[136]选择硫酸软骨素作为最佳靶剂和连接剂,诱导外源Ca2+和CO32-原位生物矿化,生成靶向癌细胞膜的生物相容性碳酸钙(CaCO3)纳米结构.研究发现,生成的CaCO3纳米结构可阻断转运蛋白,导致线粒体膜电位崩溃,乳酸脱氢酶释放增加,最终诱导癌细胞凋亡.这一研究可能为癌症的有效和特异性治疗带来希望.
此外,还有研究者们将壳化后具有特殊功能的细胞用于生物催化[137]、生物检测与成像[138]、生物传感器[139-141]和制作细胞芯片[142-143]等方面,细胞壳化在生物、医学领域具有更为广泛的应用价值.
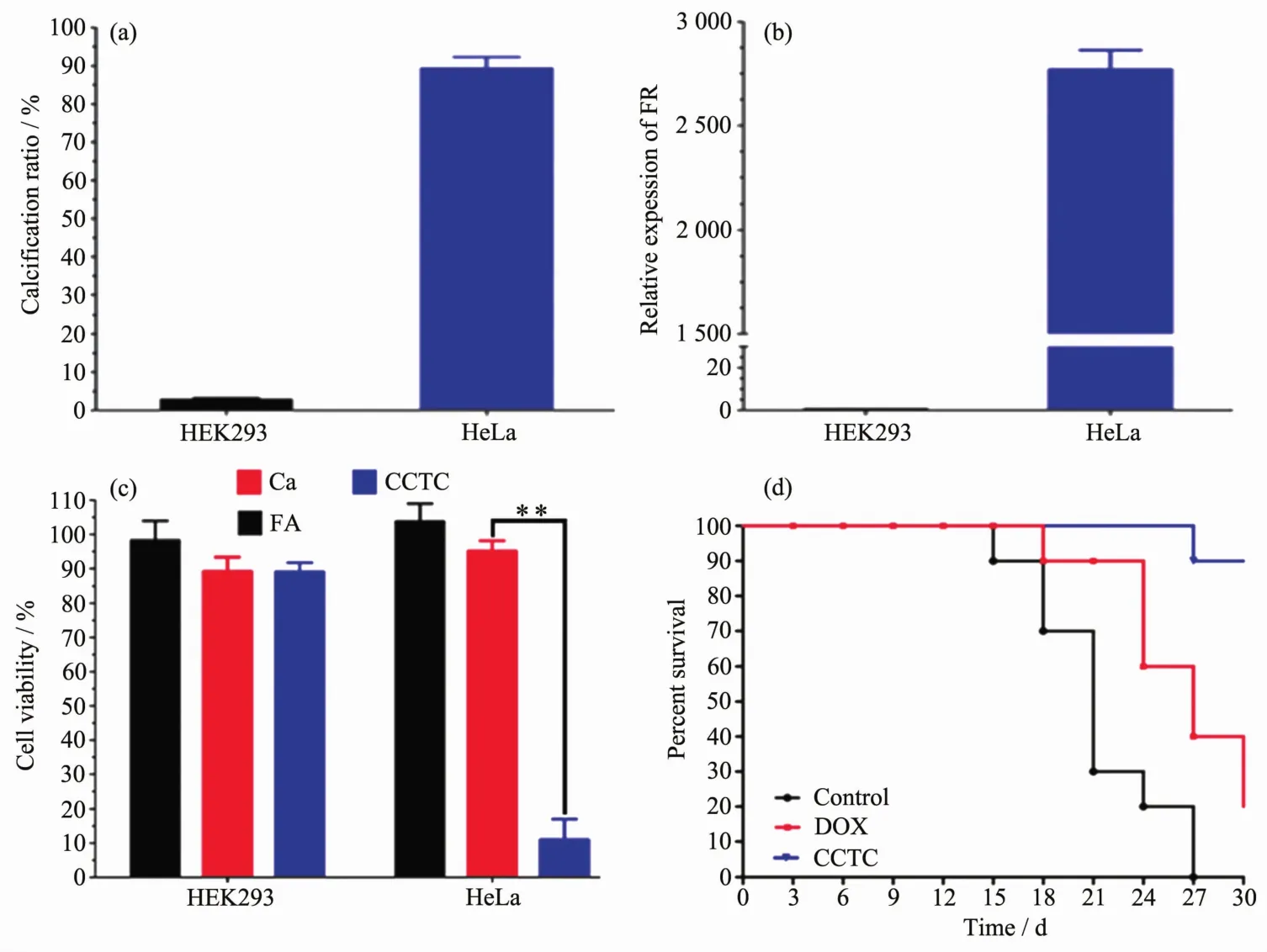
图10 (a,b)HEK293和Hela细胞经过FA选择性介导靶向钙化后的钙化率;(c)经不同处理后细胞活力的定量分析(**P<0.01);(d)肿瘤小鼠经DOX和CCTC治疗后的存活率(n=10)[135]Fig.10 (a,b)Calcification rate of HEK293 and Hela cells after FA selectively mediated targeted calcification anticancer therapy by CCTC;(c)Quantitative analysis of cell viability with different treatments(**P<0.01);(d)Survival rates of tumor mice after DOX and CCTC treatment(n=10)[135]
5 展 望
细胞表面壳化技术从建立到发展,尽管还不到20年的时间,但是该技术的研究极大地促进了化学、生物、材料以及医学等领域发展.细胞表面壳化不仅可以修饰细胞,使其获得新功能,同时也可以以细胞为模板制得新材料,还可以为揭示纳米材料与细胞间的相互作用提供有效手段.细胞表面壳化技术未来前景广阔,可以通过革新壳化技术方法、壳化材料、细胞种类、应用领域等来实现.
在细胞表面壳化技术方法上,传统方法为水凝胶法和溶胶-凝胶法,可以使细胞外壳较灵活应用,后来发展为层层自组装法和原位矿化法,能为细胞表面提供良好的机械性能和稳定性.随着基因编辑技术的发展,细胞可以通过插入外界基因而在细胞表面合成相应矿化相关多肽,从而被矿化修饰.此方法可以得到多种人工外壳,应用灵活,但是插入基因后细胞具有遗传性,也必将存在生物安全性问题.除此之外,通过人工设计3D打印机可以在细胞表面打印出所需复合壳层,在细胞和组织培养、药物缓释、组织工程等领域具有巨大的应用潜力.另外,对自然界生物过程的理解也将促进壳化技术的发展,例如自然界的硅化和多巴胺的自聚合等.
在壳化材料的种类上,目前多数为聚电解质和简单纳米粒子,在材料的选择上,最基本的要求是对细胞低毒或者无毒、不改变细胞的遗传信息等.而随着功能纳米材料和智能聚合物的快速发展,研究者会选择新型多功能复合纳米材料应用于细胞表面壳化,例如具有双重功能的纳米材料(janus nanoparticles)或基于环境(pH、磁性、温度、湿度以及离子强度等)响应的多功能纳米粒子或纳米管的复合材料.当然,使用何种材料需要根据对象细胞以及使用目的来选择.可以预见,未来的细胞表面壳化技术不会是简单的将纳米材料沉积到细胞表面,而是需要引发细胞表面对环境变化的反应.也就是说,表面的壳层具有环境适应性强、结构多变等特性.
在壳化细胞类型上,尽管细胞壳化工程采用了所有主要分类群的细胞代表,但使用的物种数量却非常有限.在将来,必将有新的物种细胞作为壳化的对象或模板.尤其是人类细胞的壳化将会越来越多,这与人类健康密切相关.目前有研究对部分癌细胞壳化成功且有效抑制癌细胞相关生理活动,证实细胞壳化方法在体外抑癌有效,但是在复杂的体内,壳化难度加大,尤其是能否成功靶向壳化是该技术的瓶颈.
在应用领域,细胞表面壳化技术无疑会越来越广阔.目前,细胞表面壳化主要应用于细胞存储、细胞保护、生物检测、生物治疗等领域.除此之外,在多种细胞表面壳化可以制造一种单一的环境,进而在研究多种单细胞的生理活动和遗传信息等领域都具有较大的应用前景.另外,细胞表面的壳化层会影响细胞的功能性,控制壳化层的功能进而可以得到功能型细胞,或许可以诱导干细胞定向分化,产生所需要的特定功能的细胞或者组织,这将极大地促进生物、医学学科的发展.
当然,细胞表面壳化技术目前也存在着很多问题,比如,目前多数材料对细胞有毒性、壳化后的细胞会有免疫源性、细胞对壳化的材料有一定的排斥性、外壳改变细胞某些生物学功能的机理不清楚等.因此,要解决上述问题、拓展细胞表面壳化技术领域,需要表面工程、材料科学、生物医学、分子生物学等各个相关领域的交叉研究[144].
