基于TT51-1水稻种子标准曲线检测的可靠性分析
2019-10-08袁建琴孔艳彪李丽
袁建琴 孔艳彪 李丽

摘 要:为了分析在同一个实验室的2台不同型号的实时荧光定量PCR仪(扩增曲线和标准曲线的相关参数)可比性,在常规条件下,使用同一批号的试剂,将标准品及同一水稻种子样品TT51-1在2台荧光定量PCR仪上进行扩增,对标准曲线的参数及分析结果进行比对,分析其一致性。结果表明,作为单一的检测系统,运用同一批号试剂对相同标准品及待检样品的试验中,2台实时荧光定量PCR仪测定的结果差异没有统计学意义(P > 0.05)。通过对标准曲线的相关参数和待检测样品的检测结果的分析,可以判定实验室存在的2台实时荧光定量PCR仪检测的结果的一致性,可确保检测结果可靠。
关键词:TT51-1水稻;标准曲线;转基因成分检测;实时荧光定量PCR;可靠性分析
中图分类号:S-3
文献标识码:A
DOI:10.19754/j.nyyjs.20190830004
基金项目:山西省高等学校教学改革创新项目“开放式生物技术专业实践教学体系的研究与实践”(项目编号:J2018079);山西农业大学科技创新基金资助“基于DNA甲基化探究双酚A致Marc-145细胞毒性机制”(项目编号:2016ZZ09); 山西省科技攻关项目“主要转基因深加工农产品定量检测技术研究”(项目编号:20140311025-3)
实时荧光定量PCR技术在诸多领域都得到了广泛应用,其领域涉及动物学、植物学、环境生物学和医药卫生等[1-3]。由于实时荧光定量PCR技术只要设计出能够对应检测样品的引物与探针,就能够实现特异性地结合的特点,也被广泛地运用在对环境中的微生物变化进行检测的方面[4-8]。虽然实时荧光定量技术拥有很强的特异性,很好的重复性,较高的自动化程度以及较快的检测速度,但是影响实时荧光定量PCR技术的因素仍旧不能忽视。样品的处理、试剂的选择与储存、核酸的提取、仪器的扩增、操作的规范性以及对于结果的分析都是可能影响到试验的最终结果的因素[9-12]。对于实验过程之中可能对于实验结果造成影响的因素进行分析,对应寻找合适的解决措施与方法,可以提高检验检疫的精确度。特别是随着分子生物学的发展和分子生物学研究手段在检测领域的运用,同一实验室内有多台实时荧光定量PCR仪的情况变得越来越常见。判断2台实时荧光定量PCR仪扩增与检测结果的一致性,是实现实验室的规范标准化亟待解决的问题。为此,本试验在同一条件下,将100% TT51-1水稻标准物质和待测样品(1% TT51-1水稻标准物质)在2台实时荧光定量PCR仪上由同一操作人员使用相同试剂进行扩增,对标准曲线的相关参数和检测结果进行分析,以此记录和比照不同仪器的检测结果是否具有的一致性。
1 材料与方法
1.1 材料
1.1.1 水稻材料
1% TT51-1水稻标准物质作为待测样品、100% TT51-1水稻标准物质作为阳性标准品(均由农业农村部科技发展中心提供)。
1.1.2 主要試剂
植物基因组DNA提取试剂盒(离心柱型)(DP130227,TIANFGEN(BEIJING) CO.LTD)、无水乙醇、苯酚、氯仿、异戊醇、β-巯基乙醇、适用于实时荧光定量的TaqDNA聚合酶以及缓冲液、dNTP等实验室常规分析纯试剂。
1.1.3 主要仪器
试验中所用2台实时荧光定量PCR仪,见表1。
1.2 方法
1.2.1 DNA的提取及纯化
本试验参照植物基因组DNA提取试剂盒(离心柱型)说明书进行提取基因组DNA。
1.2.2 DNA溶液的浓度和纯度
开启核酸蛋白定量检测仪,用10μL移液器将2μL TE加入到测量孔中进行调零。
将2μL提纯的DNA溶液加到测量孔,检测DNA浓度,记录结果,清洗测量杯,重复检测DNA浓度3次并计算平均值。
1.2.3 样品制备
初始模版的制备:将提取好并检测浓度后的 DNA 溶液用灭菌的超纯水稀释至50ng/μL来作为初始的模板。
浓度梯度溶液的制备:用灭菌的超纯水对初始模板进行梯度稀释,分别为10ng/μL、2ng/μL、0.4ng/μL、0.08ng/μL。
1.3 实时荧光定量PCR检测
对样品进行实时荧光定量PCR,检测对象为水稻转化体TT51-1和PLD基因。阳性标准品为100%的水稻标准物质,阴性对照为鲑鱼精子DNA,空白对照是灭菌的ddH2O。检测方法和引物探针参照农业部2122号公告-8-2014[13]。
1.3.1 实时荧光定量 PCR 所用的引物与探针
实时荧光定量 PCR 所用的引物和探针见表2。
1.3.2 实时荧光定量PCR反应体系
试验中TT51-1荧光定量PCR体系见表3,PLD荧光定量PCR体系见表4。
1.3.3 实时荧光定量PCR循环参数
实时荧光定量PCR体系见表5[14-16]。
2 结果与分析
2.1 样品DNA含量检测结果
100% TT51-1水稻标准物质的基因组DNA浓度和纯度检测结果,见表6。
提取100% TT51-1水稻标准物质的基因组DNA的浓度为538.5ng/μL,在25ng/μL以上,OD260/OD280为1.86,在1.7~2.0之间;OD260/OD230为2.04,大于2,说明所提取的DNA浓度与纯度均符合实时荧光定量PCR的要求。
2.2 实时荧光定量PCR对于样品的检测结果(机型Ⅰ)
2.2.1TT51-1实时荧光定量PCR检测标准曲线
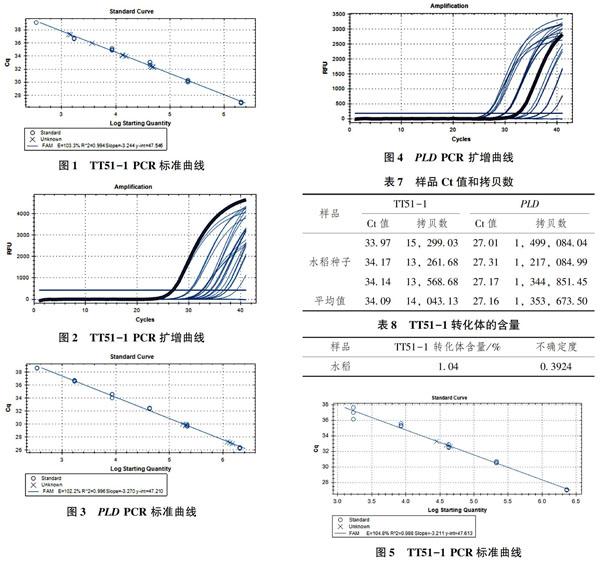
100%TT51-1水稻标准物质DNA在机型Ⅰ上的标准曲线如图1所示。
从图1可以看出,TT51-1扩增效率为103.3%,R2为0.994>0.98,标准曲线斜率为-3.244≥-3.6,并且≤-3.1,能够对样品进行准确判定。
2.2.2TT51-1实时荧光定量 PCR 检测的扩增曲线
图2中,阴性对照和空白对照均无典型扩增曲线,待测样品、阳性标准物质TT51-1均有典型扩增曲线。
2.2.3PLD基因实时荧光定量PCR检测的标准曲线
PLD在机型Ⅰ上的标准曲线如图3所示。
从图3可以看出,PLD扩增效率为102.2%,R2为0.996>0.98,标准曲线斜率为-3.270≥-3.6,并且≤-3.1,能够对样品进行准确判定。
2.2.4 PLD实时荧光定量PCR检测的扩增曲线
PLD在机型Ⅰ上的扩增曲线如图4。
在图 4 中,阴性对照和空白对照均无典型扩增曲线,样品、阳性对照有典型扩增曲线。
2.2.5 Ct值和拷贝数
TT51-1和PLD基因的Ct值和拷贝数见表7。
2.2.6 样品中转化体含量的计算
样品中TT51-1转化体的含量可通过公式:C转基因含量(%)=nTT51/nPLD*100%。计算结果见表8。
从表中可以得知,所检样品中含有TT51-1的转化体含量为1.04%。
2.3 实时荧光定量PCR对样品的检测结果(机型Ⅱ)
2.3.1 TT51-1实时荧光定量PCR检测的标准曲线
TT51-1在机型Ⅱ上的标准曲线如图5所示。
从图5可以看出,TT51-1扩增效率为104.8%,R2为0.988>0.98,标准曲线斜率为-3.211≥-3.6,并且≤-3.1,阴性对照与空白对照均没有典型的扩增曲线,能够对样品数据进行准确判定。
2.3.2 TT51-1实时荧光定量 PCR 检测的扩增曲线
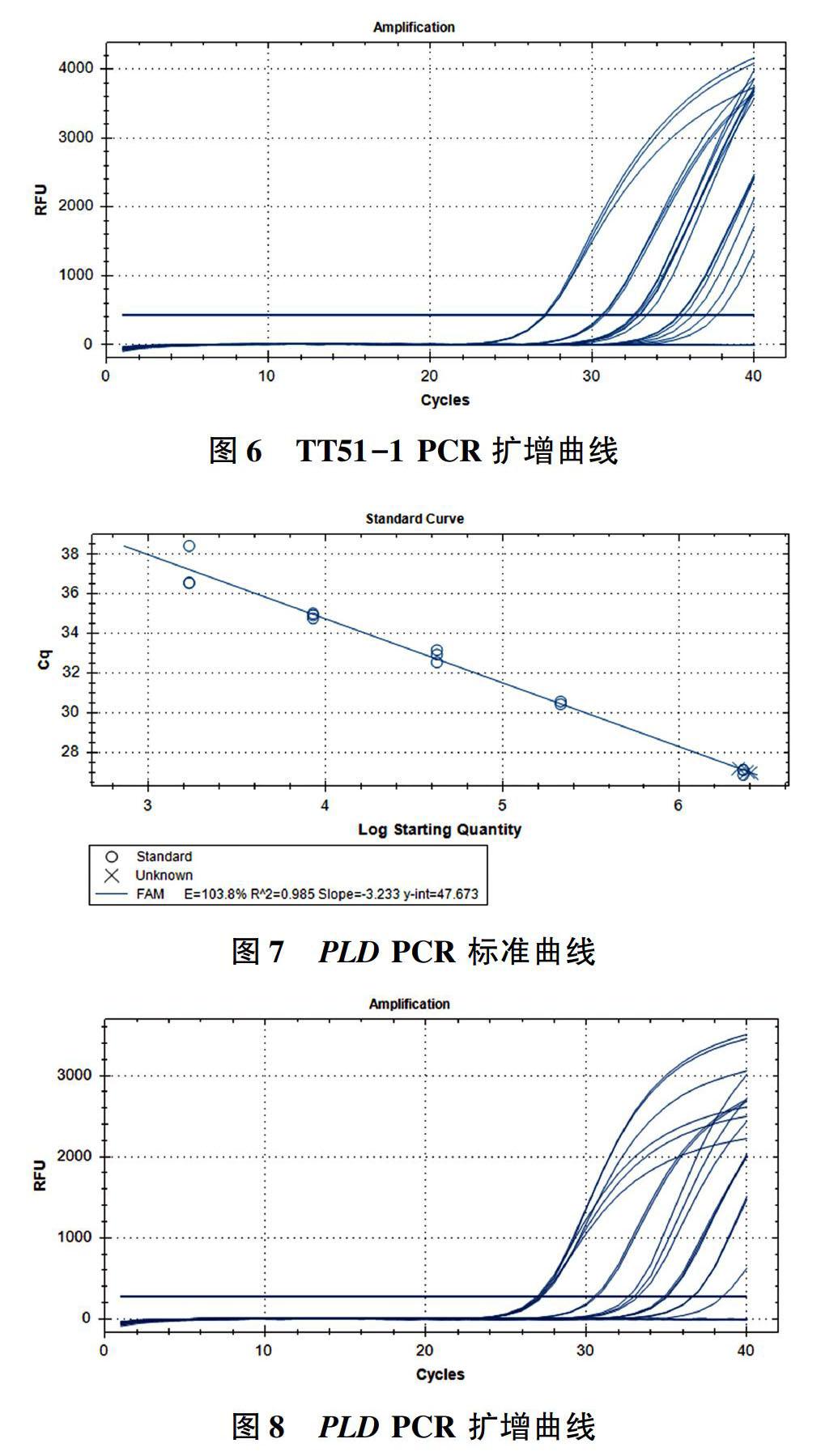
TT51-1在机型Ⅱ上的扩增曲线如图6所示。
在图6中,阴性对照和空白对照均无典型扩增曲线,待测水稻样品和阳性对照都有典型扩增曲线。
2.3.3 PLD实时荧光定量PCR检测的标准曲线
PLD基因在机型Ⅱ上的标准曲线如图7。
从图7可以看出,PLD扩增效率为103.8%,R2为0.985>0.98,标准曲线斜率为-3.233≥ -3.6,并且≤-3.1,能够对样品数据进行准确判定。
2.3.4 PLD实时荧光定量PCR检测的扩增曲线
PLD在机型Ⅱ上的扩增曲线如图8所示。
在图8中,阴性对照和空白对照均无典型扩增曲线,待测样品和阳性对照均有典型扩增曲线。
2.3.5 Ct值和拷贝数
TT51-1及PLD基因的Ct值和拷贝数见表9。
2.3.6 样品中转化体含量计算
转化体含量的计算结果见表10。
从表中可以得知,样品中含有TT51-1的转化体含量为0.97%。
3 讨论
3.1 水稻基因组DNA的提取
由于原有的试剂盒法虽然提取步骤相对简单,操作时间较短,但是提取效率低,试验用改良试剂盒法提取水稻基因组DNA。改良试剂盒法增加苯酚、氯仿和异戊醇的抽提步骤,使提取的DNA浓度,与说明书理论值相比,提升400%。通过OD260/OD280和OD260/OD230可以判断抽提的核酸的纯度是否符合试验的要求。试验中所提取样液的OD260/OD280在1.7~1.9之间,纯度较好,浓度远高于25 μL;OD260/OD230大于2.0,说明改良试剂盒法提取的DNA可以作为后续试验荧光定量PCR的模板。
3.2 标准曲线与扩增曲线的分析
图1、图3是在机型Ⅰ上水稻转化体TT51-1和PLD基因的标准曲线,图5、图7是在机型Ⅱ上TT51-1和PLD的标准曲线,由农业农村部科技发展中心提供的100% TT51-1标准物质作为阳性标准品。在标准曲线的参数中,相关系数需满足大于0.98,扩增效率需满足大于90%,小于110%。圖1、图3、图5、图7的相关系数与扩增效率均满足需求,可以用来计算待测样品的最初拷贝数。图2、图4是在机型Ⅰ上TT51-1和PLD的扩增曲线,图6、图8是在机型Ⅱ上TT51-1和PLD的扩增曲线。可以看出,曲线的拐点都比较明显,整体的平行性好。曲线在指数期的斜率较大,这表明PCR扩增效率比较高。图中的待测样品扩增曲线在第25个循环后进入指数期,说明样品的起始拷贝数比较低。
3.3 2种机型扩增结果的比较
3.3.1 基于系统扩增曲线和标准曲线的分析
利用100% TT51-1水稻标准物质在2台PCR仪上检测1%水稻标准物质的TT51-1扩增结果,如图2和图6所示。图中,基因组DNA浓度为50ng/μL、10ng/μL、2ng/μL、0.4ng/μL、0.08ng/μL的Ct值在机型Ⅰ和机型Ⅱ上的平均平均值分别为26.89、30.17、32.92、35.01、36.67和27.06、30.62、32.65、35.40、36.94,2台仪器的曲线都呈现标准的“S”型扩增,曲线之间的间距均一;从标准曲线图上可以看出,2台不同仪器绘制的标准曲线斜率分别为-3.244、-3.211,都和理论斜率值接近,相关系数也都大于0.98,因此,这次扩增有效,并且扩增效率比较高。100% TT51-1水稻标准物质在2台PCR仪的扩增结果(PLD)如图4和图8所示。图中,基因组DNA浓度为50ng/μL、10ng/μL、2ng/μL、0.4ng/μL、0.08ng/μL的Ct值在机型Ⅰ和机型Ⅱ上的平均值分别为29.79、32.43、34.40、36.66、38.63和27.03、30.49、32.88、34.90、36.55,2台仪器的曲线也都呈现标准的“S”型扩增,曲线之间的间距均一;从标准曲线图上可以看出,2台不同仪器绘制的标准曲线斜率分别为-3.270、-3.233,都和理论斜率值接近,相关系数也都大于0.98,因此,这次扩增有效,并且扩增效率比较高。选择这样的浓度梯度,满足点分布均匀和具备定量极限处数值,绘制的曲线更具有代表性。
3.3.2 对于样品检测结果的分析
2台仪器均检出1%水稻中的TT51-1转化体含量,在机型Ⅰ中为1.04%,机型Ⅱ中为0.97%(真实值为1%),说明机型Ⅰ和机型Ⅱ检测结果与实际值无显著差异(P>0.05)。
4 结论
本试验利用100% TT51-1转化体标准物质和待测水稻种子粉末(1% TT51-1转化体标准物质)对实验室2台不同型号实时荧光定量PCR仪进行结果比对,表明2台实时荧光定量PCR仪检测结果无显著差异,均可满足科研及检测需要。
参考文献
[1] Clive James.国际农业生物技术应用服务组织. 2016年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志, 2017, 37(04): 1-8.
[2] 徐婷婷. 荧光定量PCR技术应用综述[J]. 畜禽业, 2010(10): 48-50.
[3] 朱捷, 杨成君, 王军. 荧光定量PCR技术及其在科研中的应用[J]. 生物技术通报, 2009(2): 73-76.
[4] 杨弘华, 宋燕燕, 林晓波, 等. 實时荧光定量PCR技术应用研究[J]. 山东化工, 2016, 45(22): 46-47.
[5] 黄东东, 翁少萍, 吕玲,等. Taq Man MGB 实时荧光PCR对转基因大豆定量检测的研究[J]. 中山大学报, 2008, 47(03): 140-142.
[6] 李富威, 张舒亚, 叶军, 等. 食品中木瓜成分实时荧光PCR检测方法[J]. 食品研究与开发, 2013, 34(11): 51-56.
[7] 李娅, 韦平, 金元昌, 等. 实时荧光PCR检测鸡GAPDH基因方法的建立[J]. 中国家禽, 2008, 30(08): 37-40.
[8] 拜廷阳, 杨增岐, 吴志明, 等. 猪链球菌 9 型荧光定量PCR检测方法的建立及应用[J]. 西北农林科技大学学报, 2008(1): 7-12.
[9] 赵晓祥, 庞晓倩, 庄惠生. 荧光定量PCR技术在环境监测中的应用研究[J]. 环境科学与技术, 2009, 32(12): 125-128.
[10] 何闪英, 于志刚. 红色裸甲藻实时定量PCR快速检测方法的建立[J]. 浙江大学学报:农业与科学生命版块, 2009, 35(02): 119-126.
[11] 刘洪波, 刘晓雷, 罗小铭. 核酸提取方法进展[J]. 现代生物医学进展, 2011, 11(16): 3187-3190.
[12] 杨怡姝, 孙晓娜, 王小利, 等. 实时荧光定量PCR技术的操作实践[J]. 实验室研究与探索, 2011, 30(07): 15-19.
[13] 中华人民共和国农业部. 农业部2122号公告-8-2014: 转基因植物及其产品成分检测 抗虫水稻TT51-1及其衍生品种定量PCR[S]. 北京: 中国农业出版社, 2014.
[14] 袁建琴, 常泓, 赵江河, 等. 转基因大豆豆粕外源基因和蛋白在SD大鼠体内消化吸收分析[J]. 生物工程学报, 2016, 32(05): 657-668.
[15] 袁建琴, 赵江河, 史宗勇, 等. 动物饲料中转基因抗草甘膦大豆GTS40-3-2成分的检测[J]. 大豆科学, 2016, 35(02):295-300.
[16] 袁建琴, 常泓, 赵江河, 等. 山西市场动物饲料中转基因成分的检测(英文版)[J]. 生物工程学报, 2016, 32(11): 1576-1589.
