牛粪堆肥过程中nosZ型反硝化细菌动态变化
2019-10-08许本姝门梦琪武晓桐盛思远朱海峰孟庆欣邓利廷许修宏
许本姝,门梦琪,武晓桐,姜 欣,盛思远,韩 悦,朱海峰,孟庆欣,邓利廷,许修宏
(东北农业大学资源与环境学院,哈尔滨 150030)
随着畜牧养殖业与农业的发展,家畜粪便、农作物秸秆等有机废弃物已成为主要的环境污染物,影响生态平衡和人类健康[1]。堆肥是将上述有机废弃物混合,经生化降解而制成的一种有机肥料,能够使有限的资源得到二次利用。制造堆肥必须先收集适当的材料,以秸秆与粪便作为堆肥原料不仅能够减小有机废物对环境带来的压力,同时能调节能源结构,促进农业、畜牧业的协调发展,对实现环境资源的可持续发展具有重要意义[2]。
氮素是堆肥过程中的重要营养元素,影响堆肥的进程及堆肥质量。在反硝化作用过程中,氮元素以气体的形式释放到大气中,影响堆肥的质量[3-4]。反硝化反应的过程为,氧化亚氮还原酶基因(nosZ)参与其过程中最后一步,并将N2O转化为N2,使反硝化过程得到完全反应的同时又能够减少温室气体的产生。因此,学者们常以nosZ功能基因为标记研究反硝化细菌[5-6]。
堆肥反应是一个复杂的生物过程,不同深度堆肥中理化参数差异较大,对微生物群落组成也会产生不同的影响[7-8]。国外学者对细菌、真菌在堆肥不同区域的群落结构变化进行了研究[9-10]。然而动态堆肥过程中不同深度的反硝化细菌群落动态变化则鲜见报道,且关于理化参数与反硝化细菌之间关系的研究也相对欠缺。
本试验以牛粪和稻草为原料,以nosZ功能基因为标记,通过高通量测序技术研究好氧堆肥过程中不同时期与深度的nosZ型反硝化细菌群落结构与多样性的变化,并且分析理化参数对反硝化细菌群落结构以及多样性的影响。对理解堆肥氮循环理论和促进堆肥技术的改进具有科学价值。
1 材料与方法
1.1 试验材料与处理
在哈尔滨市香坊农场实验基地于2016年7月1日进行堆肥试验,堆肥中的牛粪与水稻秸秆来自黑龙江省哈尔滨市阿城区畜牧业基地。堆肥材料的主要成分见表1。将稻秆干燥后切成3~5 cm小段后与牛粪混合均匀,调节起始C/N值为30∶1,建成约3 m×1.5m×1.5 m的堆体,堆肥全程共50 d,在堆肥的第8、23 d和41 d进行翻堆处理。
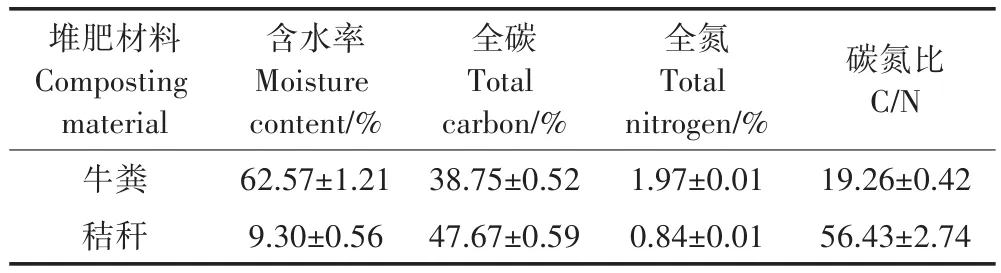
表1 堆肥材料的主要成分Table 1 Properties of raw materials for composting
1.2 样品采集
堆体高1.5 m。在堆肥试验开始的第0、2、18、39 d和50 d进行取样,取样时将堆体分为上(距堆体顶部20 cm)、中(距堆体顶部75 cm)、下(距堆体底部20 cm)三层,在各层均匀地取三个点分别采集500 g样品,并按层次充分混匀,重复三次,整个堆肥过程共采集39份样品,按堆肥天数与深度分类并分别命名为I0(第0 d)、T1(第2 d上层)、M1(第2 d中层)、B1(第2 d下层)、T2(第18 d上层)、M2(第18 d中层)、B2(第18 d下层)、T3(第39 d上层)、M3(第39 d中层)、B3(第39 d下层)、T4(第50 d上层)、M4(第50 d中层)、B4(第50 d下层)。采集后的部分样品经干燥、粉碎并过100目筛后常温储存,其余样品置于-80℃冰箱中用于后期分析。
1.3 测定内容与方法
在堆肥过程中,每日用精密数字温度计测定每个层次(由上到下20、75、130 cm)与环境的温度。含水率(WC)采用恒重法测定。将新鲜堆肥样品与去离子水以1∶10(W/V)混合,用电导仪和pH数字仪分别测量pH值与EC值。全碳(TC)和全氮(TN)分别采用重铬酸钾容量法和凯氏定氮法测定[11],碳氮比(C/N)为TC与TN的比值。氨态氮(¯N)与硝态氮(NO-3¯N)的含量利用流动分析仪进行测定。种子发芽率(Germination index,GI)是判断堆肥腐熟程度的重要指标,利用独行菜(Lepidium sativum L.)种子[12]测定种子发芽率。堆肥样品与去离子水的比例为1∶10(质量浓度比),振荡24 h后取5 mL提取液注入有滤纸的培养皿中,并将20粒独行菜种子分布均匀地放置于滤纸上,在培养箱中25°C遮光培养48 h,并用蒸馏水代替堆肥提取液作为对照组。计算方法:
GI=(堆肥浸提液的种子发芽率×种子根长)/(对照组种子发芽率×种子根长)×100%
除温度以外的所有指标均进行三次重复测定。
1.4 样品DNA的提取与PCR扩增
用CTAB法从堆肥样品中提取总DNA[13],使用Omega凝胶回收试剂盒(Omega Bio-Tek,Inc.,GA,USA)并根据说明书提示将提取粗DNA进行纯化。纯化后的DNA存储在-80℃条件下以减少样本的变化。以各个样品的DNA为模板,以nosZ-1F(5′-CGY TGT TCM TCG ACA GCC AG-3′)和nosZ-1622R(5′-CGS ACC TTS TTG CCS TYG CG-3′)为引物扩增nosZ基因[14]。PCR反应体系与条件为:共75 μL PCR体系包含37.5 μL Taq-HS PCR Forest Mix(2X),模板 1 μL,上下游引物各 0.6 μL,补充 dd H2O到 75 μL。94℃预变性4 min;95℃变性45 s,58℃退火45 s,72℃延伸45 s,35个循环;72℃再延伸7 min,最后4℃反应终止。PCR产物利用2%琼脂糖凝胶电泳进行检测,并使用Omega凝胶回收试剂盒纯化PCR产物。
1.5 nosZ型反硝化细菌高通量测序
将纯化后的PCR产物在四川贝博特生物科技有限公司Illumina Miseq平台进行测序。原始数据提交至NCBI数据库,登录号为SUB4856116。
1.6 生物信息处理
根据PE reads之间的重叠关系进行拼接过滤并去除嵌合体,在97%的相似度水平下进行聚类获得可操作分类单元(OTU,Operational taxonomic units),使用Mothur(Version v.1.30)软件,对样品alpha多样性指数进行评估(Simpson指数、ACE指数),基于Silva数据库对OTU进行分类学注释。利用QIIME软件(Version 1.8.0)生成物种丰度表,利用R语言Vegan包中的RDA分析来反应各样品微生物群落结构与理化参数之间的相关性。
1.7 数据处理
试验数据利用SPSS 22.0软件对堆肥的理化参数进行单因素方差分析(One way-ANOVA,Tukey HSD法),对反硝化细菌的多样性与丰富度进行Spearman相关性分析,概率值P<0.05代表相关关系显著。
2 结果与讨论
2.1 堆肥过程中理化参数及GI指标的变化
堆体高1.5 m。堆肥各层的温度分布如图1所示,箭头表示翻堆时间。在整个过程中,堆肥经历了升温(0~12 d)、高温(13~27 d)、降温(28~46 d)和腐熟(47~50 d)四个时期,堆体的温度在堆肥开始后立即升高,堆体上层与中层的温度在堆肥开始的第4 d即达到了55℃,而下层的温度在第11 d才达到55℃,这种现象是由于堆肥下层的通风较差,氧气含量较低,微生物代谢缓慢,导致下层温度升高较慢[15-16]。堆肥过程中,各层温度均达到了55℃并持续了5 d以上,足以杀死堆体中的病原菌而使堆肥达到无害化[17]。堆肥进行到第28 d,堆体的上中下层的温度同时开始下降,并在第47 d达到了腐熟期。整个堆肥过程中,上层和中层的温度基本上高于下层,并且翻堆会造成堆体温度明显波动。
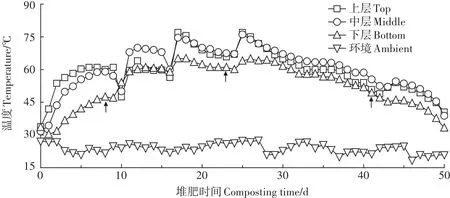
图1 堆肥过程中温度的变化Figure 1 Changes of temperature during composting process
在堆肥过程中的升温与高温阶段,pH值缓慢升高,这可能是由于随着堆肥的进行,通过氨化作用使有机酸分解[18],使pH值从7.93增加到8.90(见表2)。而到了降温期,堆肥的pH值开始下降,最终达到了有机肥料可施用标准的微碱性环境(pH值范围7.5~9.0)[19]。在堆肥的高温阶段,上层与中层的pH值分别达到了8.9和8.62,而下层只达到了8.20(P<0.05),这可能是由于堆肥上层相对于堆体其他层次通风量较大,参与氨化作用的微生物大多为好氧微生物,因此在堆肥上层的活动相对剧烈[20]。电导率(EC)与堆肥中的含盐量有着十分紧密的关系,EC值超过4.3 mS·cm-1时会不利于作物的正常生长[21]。从表1数据得知,堆肥过程中EC最高值为2.14 mS·cm-1,因此符合要求标准。含水率(WC)在堆肥过程中呈下降趋势,在堆肥的第50 d含水率下降至45.21%~53.44%,且下层的含水率较上层和中层稍高,这可能是由于上层和中层的通风条件加速了含水量的降低[15]。NH+4¯N在堆肥过程中先升高再减低,这是由于堆肥前期氨化细菌通过氨化作用使堆肥中的氮素分解为NH+4¯N,导致¯N含量逐渐增加,而到了堆肥后期,硝化作用使堆体中的转化为-N,另外由于NH3的挥发,¯N含量开始下降[22]。在堆肥的高温期与降温期,NH+4¯N上层和中层的含量显著高于下层(P<0.05)。且上层的NH+4¯N含量持续高于中层和下层的现象持续至堆肥结束,这可能是由于堆体上层具有相比底层较高的温度环境和相比中层较好的通风条件,因此有利于氨化细菌的繁殖与氨化反应的进行[23]。而NO-3-N含量在堆肥升温期过后急速上升。这与以往的研究结果相一致,过高的温度会抑制硝化细菌的活性,随着堆体温度的降低,硝化细菌活性增强,氨态氮经硝化作用转化为硝态氮,导致NO-3-N含量升高[24]。C/N是判断堆肥腐熟度的指标之一,一般情况下,C/N小于20即可判定堆肥基本腐熟[25],通过表2可知,除中层的C/N值稍高于腐熟标准(20.14),其他各层的C/N值均达到了要求。种子发芽率(GI)是判断堆肥腐熟程度的重要指标,当发芽率大于80.0%时证明堆肥的毒性已经丧失并腐熟[26]。本实验上中下层的种子发芽率均达到了标准值,证明堆肥各层均已达到腐熟标准并对植物失去毒性。
2.2 堆肥中nosZ型反硝化细菌群落的丰富度及多样性
在所有堆肥样品中共获得了872 502个序列(见表3),各个样品序列条数在12 717~55 863。在97%相似度的基础上划分共获得449个OTU,序列长度范围为200~500 bp。所有样品基因文库的覆盖率指数均高于0.99,表明获得的测序结果足以代表堆肥中nosZ型反硝化细菌群落结构的真实情况。测序结果表明在不同采样地点的OTU数量和分布各不相同。nosZ型反硝化基因的OTU数量在堆肥开始时最高,随着堆肥的推进OTU数量逐渐减少,在腐熟阶段达到最低。这可能是在堆肥的最初阶段,堆体中的营养物质浓度较高,利于反硝化细菌的生长[18]。此外,在整个堆肥过程中,上层的OTU数量始终高于中层和底层。Alpha多样性统计结果见表3,样品内物种Simpson指数代表样品中物种组成的多样性,数值大小与物种多样性呈反比,数值越大代表多样性越低[27]。本研究的堆肥体系中Simpson指数先增大后减小,说明反硝化细菌的多样性先降低后升高,并且在堆肥的降温期,上层与下层的多样性呈显著性差异(P<0.05)。ACE指数表示样品中反硝化细菌的丰富度,ACE指数越高,反硝化细菌的丰富度越高[28]。ACE指数在堆肥过程中先减小后增大,表明反硝化细菌的丰富度与多样性趋势相似,先降低后升高。堆肥过程中丰富度的变化可能是由于溶解有机碳(DOC)浓度引起的,有研究表明nosZ基因丰富度与溶解有机碳浓度显著相关[29]。此外在堆肥过程中,堆体各层的丰富度并没有体现出显著性差异。
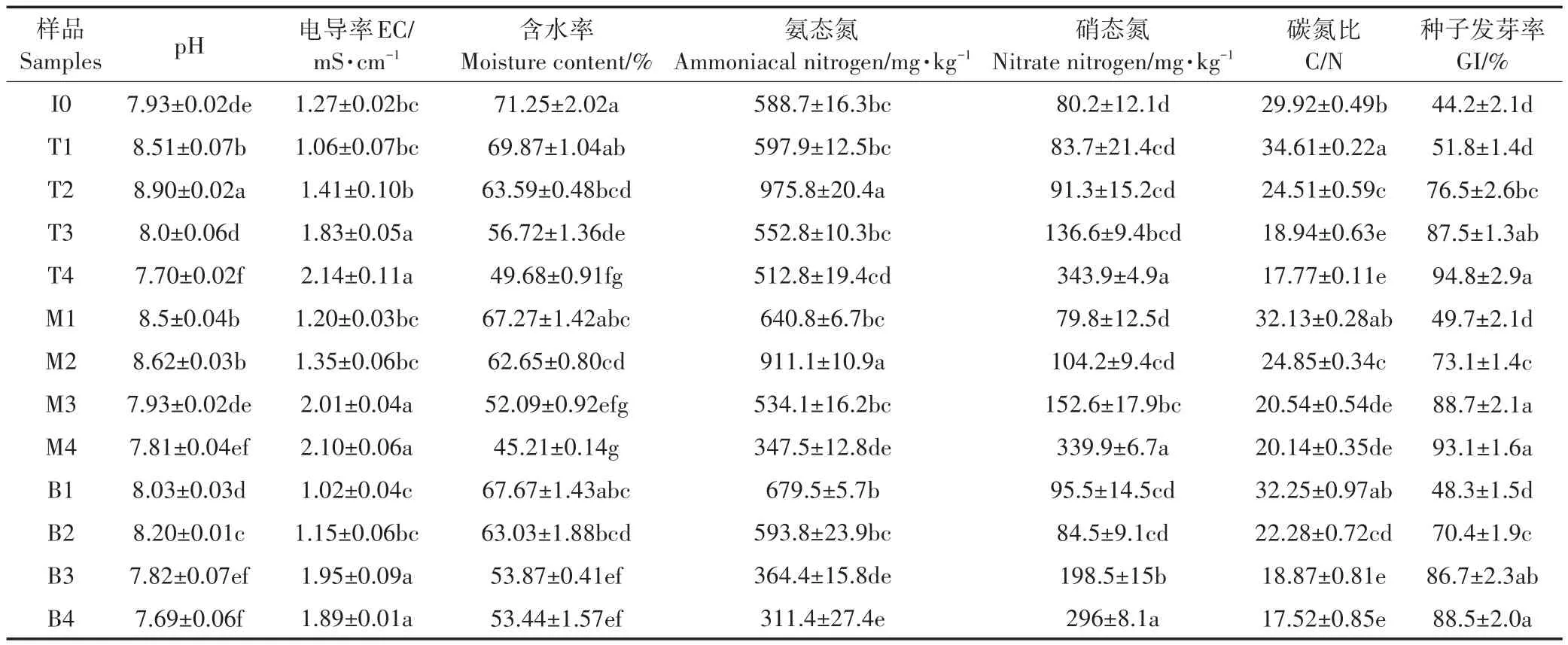
表2 堆肥过程中理化及GI指标的变化Table 2 Changes of physic-chemical and GI indices during composting process
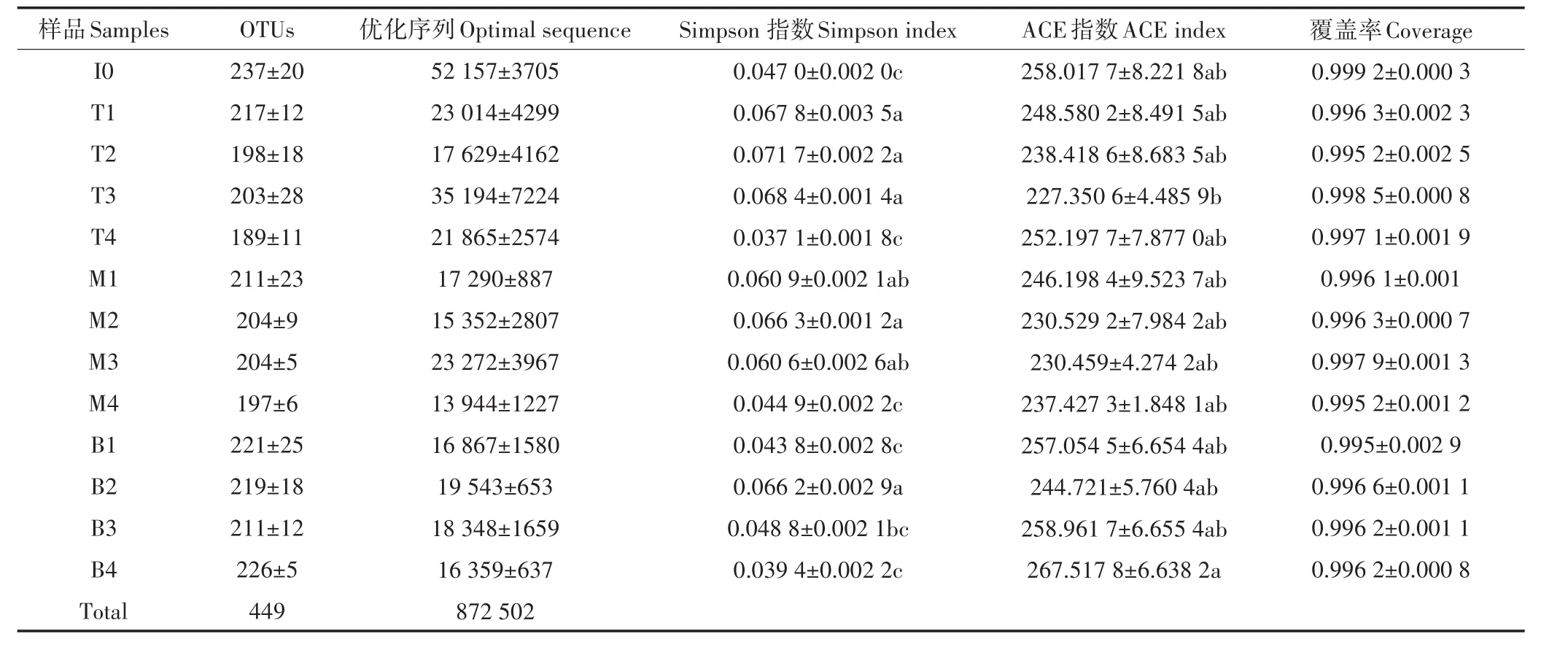
表3 堆肥过程中MiSeq测序结果及多样性指数Table 3 MiSeq sequencing results and diversity indices during composting process
2.3 堆肥中nosZ型反硝化细菌的群落组成
39个堆肥样品中的449条OTU分属于1门3纲8目12科14属15种。图2为nosZ型反硝化细菌在属水平上群落组成的动态变化,图中显示了过滤掉unclassified后丰度水平前10的物种,并将其他丰度水平物种合并为Others。假单胞菌属(Pseudomonas)、鲍特氏菌属(Bordetella)、陶厄氏菌属(Thauera)、无色杆菌属(Achromobacter)、Polymorphum、卡斯特兰尼氏菌属(Castellaniella)、生根瘤菌属(Mesorhizobium)、盐单胞菌属(Halomonas)、螯台球菌属(Chelatococcus)、红假单胞菌属(Rhodopseudomonas)为各样品中主要的反硝化细菌。堆肥第0 d,假单胞菌属(54%)、鲍特氏菌属(17%)、陶厄氏菌属(12%)、生根瘤菌属(11%)为优势菌属。当堆肥进行到升温期,陶厄氏菌属的相对丰度显著上升,成为升温期的优势菌属,且上层与下层其相对丰度相比中层较高。这是由于陶厄氏菌属是β-变形菌门下的革兰氏阴性细菌,大多数为杆状且具有反硝化能力,并适合在中性pH和中温环境中生长[30-31],与此同时无色杆菌属的相对丰度在升温阶段也稍有增加。堆肥高温期各层反硝化细菌群落结构开始出现明显的差异,堆肥上层和下层的假单胞菌属含量上升并分别达到了83%和66%。有研究表明土壤N2O的排放量与温度呈正相关,并且在N2O排放量较高的阶段检测到了大量假单胞菌的nosZ基因片段[32-33]。而中层的假单胞菌属的相对丰度仅为38%,这可能是中层与下层氧气含量的差异引起的。此外,无色杆菌属在中层的相对丰度也迅速增加。在堆肥开始的第39 d,假单胞菌属含量降低,上层与中层的螯台球菌属、卡斯特兰尼氏菌、无色杆菌属的相对丰度增加,鲍特氏菌属在堆肥下层的相对丰度迅速增加并达到了68%。堆肥的腐熟期,三层之间的群落组成相似,鲍特氏菌属依然为优势细菌,有研究表明鲍特氏菌属更适合在中温与中性的环境下生长[34]。假单胞菌属在堆肥过程中的初始、升温及高温阶段相对丰度均为最高,为堆肥过程中的优势菌属。有研究表明假单胞菌属具有生长速度快及高效脱氮的特点[35]。因此根据该菌属的生长习性调节堆肥理化参数能够有效控制堆肥反硝化反应的进程并可减少温室气体N2O的排放。
2.4 堆肥中nosZ型反硝化细菌群落组成与理化指标的相关性
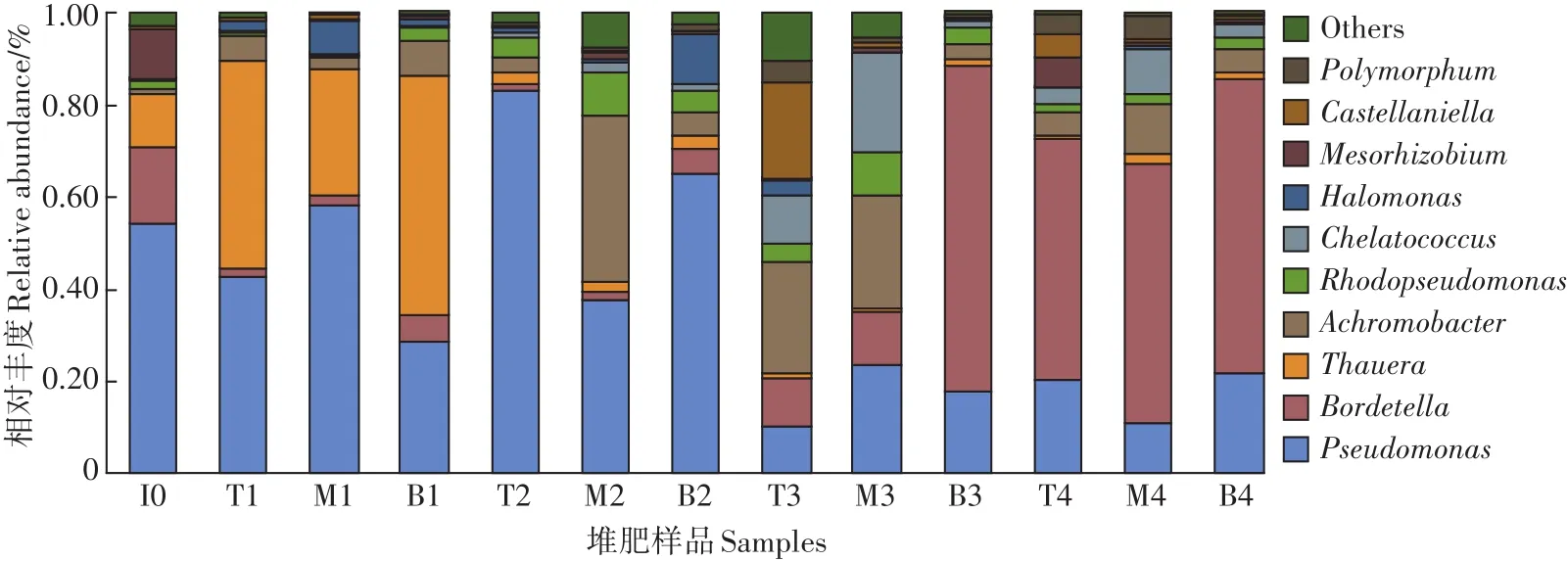
图2 堆肥样品中nosZ型反硝化细菌在属分类水平上群落组成的动态变化Figure 2 Changes of community composition of nosZ type denitrification bacteria during composting process at the level of genus
堆肥中的群落结构主要是受环境因素(温度、pH、氮、含水率等)和堆肥基质的影响[36]。了解理化参数与微生物之间的关系,找出影响微生物群落的主要因素,可以有效地调控微生物群落,从而改善堆肥过程[37]。因此,采用冗余分析(RDA)方法分析堆肥过程中理化因素对反硝化细菌群落结构的影响,本实验对堆肥丰度前10的反硝化细菌属与理化因素之间的关系进行了分析。如图3a所示,前两个排序轴分别解释了40.15%和21.24%的变化,因此理化因素显著影响堆肥过程中反硝化细菌的群落结构。箭头的矢量线长短表示着不同理化参数与样品之间的相关性大小,矢量线越长相关性越大[38]。因此根据箭头连线的长度可看出,各理化因素中C/N(CN)、含水率(WC)、pH为影响样品反硝化细菌群落结构最为显著的环境因子,其次为EC、温度(Temp)、NH+4¯N(AN)、NO-3¯N(NN)。含水率是影响堆肥中微生物活性关键的影响因素[39]。有研究指出若堆肥中含水率过高会导致堆体内部形成厌氧环境,更有利于大部分为厌氧菌的反硝化细菌生长繁殖[26]。Meng等[40]利用PCRDGGE技术分析反硝化细菌群落结构,结果表明pH和温度显著影响nosZ型反硝化细菌群落结构。图中各点代表堆肥样品,点与点之间的关系由点之间的距离表示,距离越近代表样品组成越相似,从图3a可以观察到,堆肥前期(0~2 d)的样品汇聚在第一象限,而堆肥后期(18~50 d)的样品集中在第四象限内,堆肥升温期中层的样品与同时期其他两层样品之间的连线以及降温期的各样品之间连线距离较远,因此这两个时期反硝化细菌的群落结构受层次影响较大。图3b显示了堆肥过程中的nosZ型反硝化细菌优势菌属(相对丰度前10)与理化参数之间的关系。螯台球菌属与温度呈极显著正相关(P<0.01),Polymorphum与NO-3¯N含量呈极显著正相关(P<0.01),卡斯特兰尼氏菌属与C/N呈显著负相关(P<0.05),生根瘤菌属与NO-3¯N含量呈显著负相关,与NH+4¯N和温度呈显著正相关(P<0.05),与含水率和C/N呈极显著性负相关(P<0.01),无色杆菌属与温度呈显著正相关(P<0.05),红假单胞菌属与温度和NH+4¯N呈显著正相关(P<0.05),盐单胞菌属和陶厄氏菌属均与C/N呈显著正相关(P<0.05),与NO-3¯N含量呈显著负相关(P<0.05)。
2.5 理化参数对nosZ型反硝化细菌群落多样性与丰富度的影响
堆肥过程中的反硝化细菌的多样性与温度、pH、NH+4¯N、NO-3¯N之间呈极显著相关性(P<0.01)(见表4),与C/N、含水率之间呈显著相关性(P<0.05)。并且影响程度由大到小依次为:温度>pH>NO-3¯N>NH+4¯N>C/N>含水率,其中温度、pH、NH+4¯N、含水率、C/N与反硝化细菌的多样性呈反比,NO-3¯N与反硝化细菌的多样性呈正比。表明在本研究的堆肥过程中,反硝化细菌对温度和pH敏感性较强。堆肥过程中反硝化细菌的丰富度仅与温度呈极显著相关性(P<0.01),丰富度随着温度升高而减小。这与以往研究结果一致,过高的温度和pH值会影响微生物的活性,抑制微生物的生长[17,40]。
3 结论
(1)在牛粪稻草堆肥过程中,不同时期的nosZ型反硝化细菌群落结构差异显著,反硝化细菌的多样性和丰富度在堆肥过程中均先降低后升高。假单胞菌属、陶厄氏菌属为堆肥升温期的反硝化优势菌属,假单胞菌属、无色杆菌属为高温期的优势菌属,鲍特氏菌属为堆肥腐熟期的优势菌属。除此之外,堆肥降温期不同深度堆肥中菌群结构与多样性指数差异显著,各层次优势菌属各不相同。可见,nosZ型反硝化细菌群落结构与多样性在堆肥不同阶段和不同深度均存在差异。
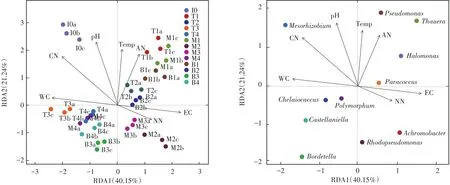
图3 理化参数与样品(a)及nosZ型反硝化细菌(b)在属水平上的RDA分析Figure 3 RDA analysis of physic-chemical parameters between samples(a)and denitrifying bacteria(b)at the genus level

表4 理化参数与反硝化细菌群落Simpson和ACE指数的Spearman相关性系数Table 4 Spearman correlations coefficient between physic-chemical parameters and denitrifying bacteria Simpson as well as ACE indices
(2)理化因素对反硝化细菌有着不同程度的影响,C/N、含水率、pH对反硝化细菌群落结构影响最为显著,螯台球菌属与温度呈极显著正相关(P<0.01),Polymorphum与硝态氮含量呈极显著正相关(P<0.01),生根瘤菌属与含水率和C/N呈极显著负相关(P<0.01)。温度、pH、氨态氮与反硝化细菌多样性呈极显著负相关(P<0.01),硝态氮与反硝化细菌的多样性呈极显著正相关(P<0.01),温度与反硝化细菌丰富度呈显极著负相关(P<0.01)。
