Cd胁迫下小麦的形态生理响应及Cd积累分布特征
2019-10-08张大众杨海川菅明阳隗书伟张一阳马翎健
张大众,杨海川,菅明阳,隗书伟,赵 越,张一阳,丁 勤,马翎健*
(1.西北农林科技大学农学院,陕西 杨凌 712100;2.西北农林科技大学园艺学院,陕西 杨凌 712100;3.河北省石家庄市藁城区农业科学研究所,石家庄 052160)
镉(Cd)在土壤中有高度的迁移性,是最具有危害性的重金属元素之一[1]。Cd可通过食物链传递进而危害人的身体健康。小麦是我国主要粮食作物之一,且属于抗Cd能力较强和易积累作物[2]。Cd胁迫会导致小麦株高、穗长和产量等生长指标降低以及品质的下降。大量试验表明[3-4]小麦Cd抗性存在较大的品种间差异。小麦Cd抗性又可以分为耐性(高浓度Cd条件下减小其毒害)和避性(减少吸收量)两个途径。早期研究也多是围绕这两个途径展开,一方面研究Cd胁迫对小麦形态生理指标的影响[5-7]和Cd积累分布特征,研究表明SOD、POD、CAT等保护性酶及脯氨酸、可溶性糖等渗透调节物质与小麦Cd耐受能力相关,Cd在根部等器官和组织的特异积累能提高小麦Cd耐受能力;另一方面是低积累品种的筛选[8-9]。近年通过调控环境因素来降低Cd胁迫对小麦毒害作用的相关的研究逐渐增多[10-12]。从小麦自身Cd抗性出发并系统研究小麦在Cd胁迫下的形态生理响应,Cd的吸收、积累分布特征以及不同抗性品种之间响应方式差异的报道很少,单一水平揭示小麦Cd胁迫的响应机制,不利于小麦Cd抗性的深入研究及相关性状的改良。本研究通过比较不同浓度Cd处理及不同Cd抗性小麦品种间对Cd胁迫的形态、生理响应以及Cd的积累、转运和化学形态分布,试图初步探讨小麦的Cd抗性机制,为小麦高抗和低积累Cd性状的遗传改良提供参考。
1 材料方法
1.1 试验材料
盆栽试验用土取自西北农林科技大学试验田,风干后过筛并与营养土按一定比例混匀。土壤理化性质:pH 8.0,速效氮 112.4 mg·kg-1,速效磷 38.2 mg·kg-1,速效钾87.9 mg·kg-1,Cd 0.52 mg·kg-1。
试验所选用小麦品种为课题组前期通过发芽试验筛选出的Cd抗性不同但生育期基本一致的黄淮麦区小麦品种(系),发芽率和发芽势显示其抗性水平为:许农186较高,M1019和漯麦0603中等,西农20较低。
1.2 试验处理
外源Cd 含量设置0、25、50 mg·kg-13个水平,按照相应处理浓度及土壤质量称取CdCl2·2H2O溶于水中喷于土壤表面并不断搅拌混匀。将处理后的土壤装入塑料盆中,每盆装土8 kg,浇足水稳定30 d备用。各品种种子用30%H2O2消毒20 min后再用蒸馏水多次冲洗。将消毒后的种子种于装满相应浓度Cd处理土壤的营养钵(10 cm×10 cm×10 cm)中,每盒种60粒,每个处理2盒,共24盒。于恒温25℃、光照12 h的培养箱进行培养,长至一叶一心转移到3~4℃的培养箱春化一个月。苗期移苗到对应Cd浓度的塑料盆中,每盆10株,每处理5盆,共60盆,在日光温室培养至成熟。
1.3 测定指标与方法
1.3.1 形态指标调查
于成熟期测量株高,顶三叶面积(长×宽×0.75),茎、叶、穗干质量(10株)和千粒重(500粒)。
生长抑制率=(1-处理/对照)×100%
1.3.2 生理指标测定
(1)分别于苗期(苗期移苗时)、拔节期、灌浆期和蜡熟期取小麦顶部三片叶,存放于-80℃冰箱,测定超氧化物歧化酶(SOD)、过氧化物酶(POD)活性及脯氨酸含量。因种子数量的原因,苗期所取样品量较少,未进行该时期SOD酶活性测定。
(2)分别于拔节期、开花期、灌浆期用叶绿素仪(SPAD502)测量小麦顶三叶叶绿素相对含量。
1.3.3 Cd的积累分布测定
(1)小麦各器官Cd积累量
于成熟期按处理取样,用自来水冲洗干净,再用蒸馏水冲洗三次,吸水纸吸干表面水分,根部在20 mmol·L-1的Na2-EDTA溶液浸泡15 min除去表面的Cd。按根、茎、叶、籽粒分解,并于75℃烘干至恒质量,籽粒阴干,各处理样品粉碎过100目筛并称取1 g用石墨消解仪消解,消解试剂为HNO3-HClO4(3∶1,V/V),用火焰石墨炉原子吸收光谱仪(Z-2000)测定Cd含量。
(2)小麦体内Cd化学形态分析
于小麦灌浆期取各处理根和叶片用于化学形态分布测定。Cd化学形态分析采用化学试剂连续提取的方法[13]。
1.4 数据处理分析
本试验的所有数据均使用Excel 2007和SPSS 19软件进行处理分析。
2 结果与分析
2.1 Cd处理对小麦表型性状的影响
不同浓度Cd处理下各小麦品种的表型性状如表1所示。许农186和西农20株高未随Cd处理浓度的增加而显著变化,M1019在25 mg·kg-1处理下株高有所增加,而漯麦0603在50 mg·kg-1处理下与对照相比株高显著降低。各品种茎、叶、穗干质量和千粒重随Cd处理浓度的增加而降低,其中对叶片干质量影响最大,50 mg·kg-1处理下降20%以上;25 mg·kg-1处理下许农186、西农20和M1019的顶三叶叶面积分别增大了8.6%、2.9%和7.21%,50 mg·kg-1处理下叶面积均显著减小,其中漯麦0603降低最多为11.9%。各品种受抑制程度随处理Cd浓度增加而增加,在25 mg·kg-1和50 mg·kg-1两个处理下许农186平均抑制率最低,漯麦0603最高,西农20和M1019抑制率居中。
2.2 Cd处理下小麦的生理响应
2.2.1 POD酶活性
由图1可以看出各处理下小麦叶片POD酶活性随处理时间的延长整体上呈降低趋势。苗期各品种小麦叶片POD酶活性整体呈现随Cd处理浓度升高而增加的趋势,其中许农186叶片POD酶活性最高,M1019最低。拔节期各处理叶片POD酶活性在各时期中最低,西农20和M1019叶片POD酶活性仍随Cd浓度的上升而显著增加,且西农20的POD酶活性在50 mg·kg-1条件下在同时期所有处理中最高;许农186和漯麦0603的叶片POD酶活性随Cd浓度的上升而显著降低,且漯麦0603在同时期所有处理中酶活性处于较低水平,在50 mg·kg-1条件下达到最低。灌浆期和蜡熟期各处理叶片POD酶活性在25 mg·kg-1条件下最高,50 mg·kg-1条件下酶活性则显著低于25 mg·kg-1下的水平,这两个时期各品种在对应Cd胁迫条件下POD酶活性以西农20最高,漯麦0603最低。

表1 不同浓度Cd处理下各小麦品种农艺性状Table 1 Agronomic traits of wheat varieties under different concentrations of Cd
2.2.2 SOD酶活性
如图2所示,除漯麦0603拔节期和灌浆期叶片SOD酶活性随Cd处理浓度增加而增加外,其余各处理SOD酶活性均随Cd处理浓度增加而降低,但较多处理间SOD酶活性差异不显著。蜡熟期SOD酶活性低于灌浆期。
2.2.3 脯氨酸含量
由图3可知,脯氨酸含量整体上随Cd处理时间和处理浓度的增加呈上升趋势,但增加幅度较小,多数处理之间差异不显著。
2.2.4 叶绿素含量
各处理下不同时期顶三叶叶绿素含量的平均值如图4所示。许农186、西农20和M1019顶三叶叶绿素含量随生育进程的推进而升高并趋于稳定,而漯麦0603在灌浆期叶绿素含量显著下降。小麦各品种各时期叶绿素含量均随Cd处理浓度的增加而降低。灌浆期25 mg·kg-1和50 mg·kg-1处理条件下各品种叶绿素含量显著低于对照,且漯麦0603各处理间差异显著。
2.3 各品种小麦Cd积累特征
图5表明,Cd在四个品种小麦各器官中的含量随Cd处理浓度的增加而升高,不同器官中Cd含量表现为:根>叶片>茎秆>籽粒,且地上各部位远低于根,籽粒中的Cd含量远低于其他部位,50 mg·kg-1条件下籽粒中的Cd含量只占根部的2.2%~3%。西农20和漯麦0603各器官Cd积累量均显著高于许农186和M1019。品种间不同部位Cd含量比值也表现出明显差异,50 mg·kg-1处理下漯麦0603 Cd的叶片和籽粒转运系数最低,分别为21.2%和2.2%,西农20叶片转运系数最高,分别为26.4%,西农20和许农186籽粒转运系数较高,分别为3.02%和3.04%。
2.4 各品种小麦Cd化学结合形态

图1 各处理下不同生育时期小麦叶片POD酶活性Figure 1 POD enzyme activity of wheat leaves at different growth stages under different treatments

图2 各处理下不同生育时期小麦叶片SOD酶活性Figure 2 SOD enzyme activity of wheat leaves at different growth stages under different treatments
小麦叶片各提取态Cd含量如图6所示。未处理条件下Cd各提取态间的分布相对均匀,随Cd处理浓度的增加氯化钠提取态和醋酸提取态占比增大,其余结合形态占比逐渐减小。未处理条件下氯化钠提取态和醋酸提取态占比20%左右,其余化合态略低于上述两种状态。25 mg·kg-1胁迫条件下氯化钠提取态和醋酸提取态分别占40%和30%左右,其余形式各占10%左右。50 mg·kg-1胁迫条件下氯化钠提取态和醋酸提取态分别占50%和30%左右,其余形式都在10%以下。各品种的活跃态(乙醇、去离子水和氯化钠提取态)Cd的比例有所差异,各处理条件下西农20和漯麦0603相近且活跃态Cd占比较高,许农186活跃态Cd占比最低。
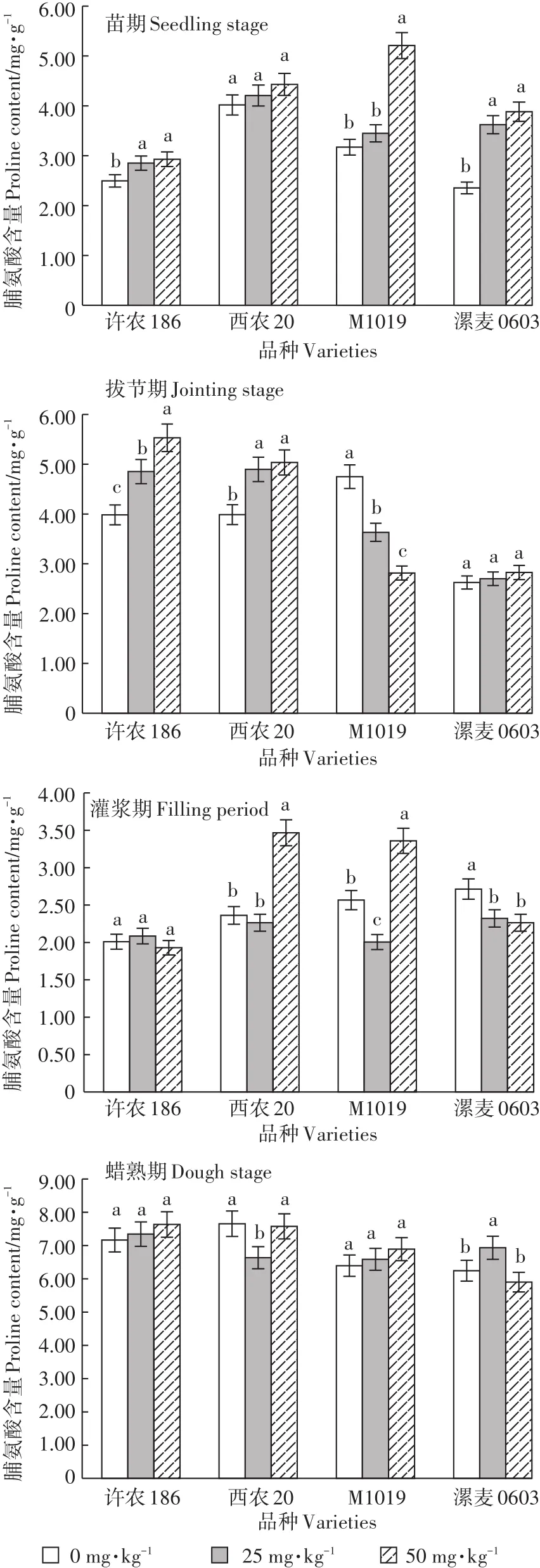
图3 各处理不同生育时期叶片脯氨酸含量Figure 3 Proline content in leaves of different growth stages
小麦根系各提取态Cd含量如图7所示。分布情况与叶片中分布情况相似,但各处理下氯化钠提取态和醋酸提取态Cd占比提高。

图4 各处理不同时期顶三叶叶绿素含量相对值Figure 4 Chlorophyll content of top three leaves in different periods of treatment
3 讨论

图5 各处理小麦不同器官Cd积累量Figure 5 Cd accumulation in different parts of wheat under different treatments

图6 小麦叶片各提取态Cd含量分配比例Figure 6 The percentage of each extractable forms of Cd in leafs of wheat
小麦不同表型性状对Cd胁迫的响应存在差异,25 mg·kg-1浓度Cd处理下对M1019的株高及西农20、许农186和M1019叶面积有促进作用,即适宜浓度Cd胁迫对部分小麦的株高和叶片的生长有促进作用,这与何俊瑜等[14]和王丽燕等[15]在Cd胁迫对小麦种子萌发及幼苗生长实验中的结果相似,与聂胜委等[16-17]在Cd胁迫对小麦生长及产量研究中的结果基本一致,朱志勇等[18]的研究也表明50 mg·kg-1Cd处理下仍能促进抗性小麦品种叶面积指数的增加,本试验中许农186叶面积在50 mg·kg-1Cd处理下与对照差异不显著。本试验中在叶面积增加的情况下相应处理的小麦各器官干质量仍下降,可能是由于光合机构对Cd胁迫更为敏感,致使光合速率显著下降,同化物质减少[19-20]。Cd胁迫还能抑制籽粒贮藏物质合成能力和胚乳细胞的分裂能力,导致籽粒库容量减少,千粒重下降[21]。从表型性状受抑制的程度可以看出四个品种Cd抗性表现为许农186较强,M1019、西农20次之,漯麦0603最弱,这与前期鉴定的结果基本一致。个别品种抗性的变化可能是因为不同生育时期抗性不一致。

图7 小麦根系各提取态Cd含量分配比例Figure 7 The percentage of each extractable forms of Cd in roots of wheat
Cd对植物的毒害作用之一是损害生物体内的酶及其化学性质并诱发高活性自由基[22-23]。SOD、POD等是活性氧自由基清除系统中的重要保护酶。本试验中,POD在苗期活性较高,随后活性迅速降低,且随胁迫时间延长呈降低趋势,在灌浆和蜡熟期25 mg·kg-1Cd胁迫下POD酶活性最高。许农186、西农20和M1019的SOD酶活性随Cd浓度的增加和胁迫时间的延长不断降低。可能是因为SOD和POD活性的提高是一种急性解毒措施,其调节能力是临时和有限的,当细胞长时间受到胁迫,细胞内的酶也会受到损伤而使活性下降[24]。脯氨酸在植物体内含量可以反映植物受胁迫程度的大小[25],本试验中脯氨酸含量整体上随Cd处理浓度和时间的增加而增加,即随着处理浓度和时间的增加小麦受胁迫的程度也不断增加。本试验中SOD、POD酶活性和脯氨酸含量既表现出了相同的规律性也有品种间的差异,其中许农186和西农20的SOD、POD酶活性各时期都高于漯麦0603,西农20的脯氨酸含量相对较高,而漯麦0603一直处于较低水平,这些抗性生理对Cd胁迫响应程度的差异也是造成品种间Cd抗性差异的重要原因,这与何俊瑜等[26]的观点一致。Cd胁迫对叶绿素含量和光合作用也有很大程度的影响,叶绿素含量高低也可以用来反映植物逆境下受伤害的程度。本试验中,随Cd处理浓度的增加,叶绿素含量下降。拔节期顶三叶叶绿素含量低是因为顶部新抽出叶片光照时间短,叶绿素含量低。各品种以漯麦0603各处理间叶绿素含量差异最大,说明该品种对Cd胁迫最敏感。
Cd胁迫下小麦各个器官Cd含量随处理浓度的升高而升高,不同器官含量不同[27-28]。本试验研究结果与文献一致,小麦各器官Cd含量表现为根部>叶片>茎秆>籽粒,与肖昕等[27]和冯绍元等[29]研究结果一致。Cd积累量在品种间表现出差异,西农20和漯麦0603显著高于许农186和M1019,说明西农20和漯麦0603应对Cd胁迫的避性要低于许农186和M1019;不同器官间分配比例也不同,根系和茎秆中漯麦0603 Cd含量最高,叶片和籽粒中则是西农20含量最高。减少Cd的吸收,限制向地上部的转运是植物应对Cd胁迫的重要防御方式[30]。西农20表现出较高的Cd吸收和转运能力,是Cd抗性低的表现。漯麦0603则是高吸收、低转运,但其叶片和籽粒的绝对含量仍处于较高水平。
植物体内的重金属以不同的化学结合形态存在,其中乙醇提取态和水溶态迁移活性最强,氯化钠提取态次之,醋酸和盐酸提取态最弱[13]。无论在叶片还是根部乙醇提取态和水溶态Cd占比都随处理Cd浓度的增加而降低,氯化钠和醋酸提取态不断增加。在叶片中许农186的乙醇提取态和水溶态占比最少,漯麦0603占比最多,根中的分布情况与叶片相似。说明漯麦0603中活性高的Cd占比较多,在该方面对Cd的抗性较弱。
许农186低吸收Cd,高活性的Cd的组分占比最少,生理响应水平相对高,所以表现出了较高的Cd抗性;漯麦0603高吸收Cd,高活性Cd组分占比多,生理响应水平低,所以表现出了较低的Cd抗性;西农20和M1019的各个指标响应程度有强有弱,所以其抗性处于中间水平。从以上结果可以看出,小麦响应Cd胁迫的防御方式很多,响应方式也不尽相同,而抗性是所有生理机制作用的综合体现。
4 结论
(1)四个小麦品种成株期Cd抗性表现为:许农186抗性高,西农20和M1019次之,漯麦0603较低。Cd胁迫在各器官中以对叶片干质量的影响最大,一定浓度的Cd胁迫对部分小麦品种的株高和叶面积等有促进作用。
(2)一定程度的Cd胁迫能提高POD酶活性,胁迫程度过高则表现为抑制,敏感型品种酶活性低;长时间Cd胁迫会降低SOD酶活性;脯氨酸含量随Cd处理浓度和时间的增加而增高;叶绿素含量在Cd胁迫下降低。
(3)随Cd处理浓度的增加,小麦通过提高低活性Cd的比例,来提高自身抗Cd胁迫的能力。
(4)不同小麦品种Cd吸收积累和分布的特征不同,对Cd胁迫的响应也不同,但整体上表现为:抗性品种的Cd吸收量小、高活性Cd占比小、生理响应的水平高。
