曲妥珠单抗联合GEM、CAP化疗对HER-2阳性晚期乳腺癌患者血清T细胞亚群、TPS水平及生存质量的影响
2019-09-30沈春燕金晓新王淑玲
沈春燕 金晓新 王淑玲

[摘要] 目的 探討曲妥珠单抗联合吉西他滨(GEM)、卡培他滨(CAP)化疗在人类表皮生长因子受体2(HER-2)阳性晚期乳腺癌患者中的应用效果。 方法 选取武警后勤学院附属医院2010年8月~2015年4月收治的HER-2阳性晚期乳腺癌患者80例,按照随机数字表法分组,对照组40例采用GEM、CAP化疗治疗,观察组40例在对照组基础上加用曲妥珠单抗治疗。比较两组疾病控制情况及治疗前后血清肿瘤标志物各指标[血清组织多肽特异性抗原(TPS)、癌相关糖蛋白抗原153(CA153)]水平、血清T细胞亚群(血清CD3+、CD4+、CD8+)水平及生存质量各维度(角色功能、情绪功能、认知功能、躯体功能、社会功能)评分,并统计两组毒副作用发生情况及生存率。 结果 观察组临床疗效优于对照组,且观察组临床控制率高于对照组(P < 0.05)。治疗2个月后,两组血清TPS、CA153水平均较治疗前降低,且观察组较对照组降低更明显(P < 0.05)。两组治疗2个月后血清CD3+、CD4+水平均较治疗前降低,但观察组高于对照组(P < 0.05);两组治疗前后血清CD8+水平比较,差异无统计学意义(P > 0.05)。两组白细胞下降、恶心呕吐、血小板下降发生率比较,差异无统计学意义(P > 0.05)。治疗2个月后,两组认知功能、躯体功能、角色功能、情绪功能及社会功能评分均高于治疗前,且观察组高于对照组(P < 0.05)。两组1、2、3年生存率比较,差异无统计学意义(P > 0.05)。 结论 曲妥珠单抗联合GEM、CAP化疗可降低HER-2阳性晚期乳腺癌患者血清肿瘤标志物水平,提高疾病临床控制率,对患者机体免疫功能损伤小,预后生存率高,毒副作用小,可提高患者生存质量。
[关键词] 晚期乳腺癌;HER-2阳性;曲妥珠单抗;GEM;CAP;血清T细胞亚群;TPS水平;生存质量
[中图分类号] R737.9 [文献标识码] A [文章编号] 1673-7210(2019)07(a)-0093-05
Effect of Trastuzumab combined with GEM and CAP chemotherapy on serum T cell subsets, TPS levels and quality of life in patients with HER-2 positive advanced breast cancer
SHEN Chunyan1 JIN Xiaoxin1 WANG Shuling2
1.Department of Oncology, Affiliated Hospital of Armed Police Logistics College, Tianjin 300162, China; 2.Key Laboratory of Cancer Prevention and Therapy Affiliated Cancer Hospital of Tianjin Medical University, Tianjin 300060, China
[Abstract] Objective To investigate the effect of Trastuzumab combined with Gemcitabine (GEM) and Capecitabine (CAP) in advanced breast cancer patients with positive human epidermal growth factor receptor 2 (HER-2). Methods Eighty patients with HER-2 positive advanced breast cancer admitted to the Affiliated Hospital of Armed Police Logistics College from August 2010 to April 2015 were selected. According to the random number table, 40 cases in control group were treated with GEM and CAP, and 40 cases in observation group were treated with Trastuzumab on the basis of control group. The disease control and the levels of serum tumor markers indicators [tissue polypeptide specific antigen (TPS), cancer-related glycoprotein antigen 153 (CA153)] before and after treatment, serum T cell subsets (serum CD3+, CD4+, CD8+) levels and quality of life dimensions (role function, emotional function, cognitive function, physical function, social function) score changes were observed between two groups, the occurrence of toxic and side effects and survival rate were also counted between two groups. Results The clinical efficacy of observation group was better than that of control group, and the disease control rate of observation group was higher than that of control group (P < 0.05). After 2 months of treatment, the levels of serum TPS and CA153 in two groups were lower than those before treatment, and the decrease in observation group was more obvious than that in control group (P < 0.05). After 2 months of treatment, the levels of serum CD3+ and CD4+ in two groups were lower than those before treatment, but the levels in observation group were higher than those in control group (P < 0.05). There was no significant difference in serum CD8+ level between two groups before and after treatment (P > 0.05). There was no significant difference in the incidence of leukopenia, nausea, vomiting and thrombocytopenia between two groups (P > 0.05). The scores of cognitive function, somatic function, role function, emotional function and social function in two groups were higher than those before treatment, and those in observation group were higher than those in control group (P < 0.05). There was no significant difference in 1, 2 and 3-year survival rates between two groups (P > 0.05). Conclusion Trastuzumab combined with GEM and CAP chemotherapy can reduce serum tumor marker levels in patients with HER-2 positive advanced breast cancer, improve the clinical control rate of the disease, have less damage to the patient′s immune function and have a high prognosis survival rate with fewer side effects. It can improve the quality of life of patients.
[Key words] Advanced breast cancer; HER-2 positive; Trastuzumab; GEM; CAP; Serum T cell subset; TPS level; Quality of life
乳腺癌为多发于40~70岁女性的恶性肿瘤疾病,占女性全身恶性肿瘤总患病率的7%~10%,居女性恶性肿瘤第一位,且每年以2%~3%的速率递增,严重危害女性生命健康[1-3]。有数据显示20%~30%的乳腺癌患者人类表皮生长因子受体2(HER-2)呈阳性,且早期症状并无特异性,多数患者确诊时已是晚期,错失最佳手术治疗时机,需进行化疗治疗[4]。吉西他滨(GEM)联合卡培他滨(CAP)化疗方案为晚期乳腺癌患者常用化疗方案,可有效杀灭肿瘤细胞,控制病情恶化,改善患者临床症状;但化疗后多数患者存在免疫力低下的现象,影响预后。有研究指出,分子靶向治疗药物仅作用于癌细胞的某些位点,杀伤肿瘤细胞,可减少对患者正常细胞的损害[5-6]。曲妥珠单抗是一种靶向治疗药物,可作用于HER-2而杀伤肿瘤细胞,安全性高,与GEM+CAP化疗方案联合使用效果是否会更佳,临床鲜有研究。基于此本研究将曲妥珠单抗与GEM+CAP化疗方案联合应用于HER-2阳性晚期乳腺癌患者,探讨其治疗效果及对患者血清T细胞亚群、生存质量的影响。现将结果报道如下:
1 资料与方法
1.1 一般资料
选取武警后勤学院附属医院2010年8月~2015年4月收治的80例HER-2阳性晚期乳腺癌患者,按照随机数字表法分组,对照组40例,年龄41~69岁,病程2~5年;观察组40例,年龄40~70岁,病程1~6年。两组患者年龄、病程、TNM分期及发病部位比较,差异无统计学意义(P > 0.05),具有可比性。见表1。本研究符合《世界医学会赫尔辛基宣言》[7]中相关要求。
1.2 纳入标准
①均经临床病理检查确诊为乳腺癌;②TNM分期为Ⅲ~Ⅳ期且均为HER-2阳性;③对本研究所用药物成分无禁忌;④年龄40~70岁;⑤知晓同意本研究且均可完成随访研究。
1.3 排除标准
①生存期<6个月者;②心、肾、肺等重要脏器功能不全者;③卡氏评分量表(KPS)评分<70分者;④伴有严重精神疾病或意识障碍;⑤合并其他恶性肿瘤;⑥出现全身急慢性感染者;⑦合并血液系統疾病或内分泌系统疾病;⑧存在心脑血管疾病;⑨正在进行放疗或其他化疗方案治疗者;⑩合并传染性疾病;双侧乳腺癌。
1.4 方法
1.4.1 对照组 第1、8天静脉滴注1000 mg/m2 GEM(江苏豪森药业集团有限公司,生产批号:8690144400 0086)治疗;第1、14天口服2000 mg/m2 CAP(上海罗氏制药有限公司,生产批号:H20073024)治疗,21 d为1个疗程,共治疗2个疗程。
1.4.2 观察组 在以上治疗基础上静脉滴注曲妥珠单抗(Genentech Inc.,生产批号:86978791000561)治疗,首次剂量为8 mg/kg,而后剂量减至6 mg/kg,1次/周,共治疗2个月。
1.5 血清学指标检测
采集7 mL空腹静脉血,以3000~3500 r/min转速离心处理10~15 min(离心半径8 cm),采用瑞士罗氏Cobas公司生产的全自动化学发光免疫分析仪(e411),以酶联免疫吸附法测定血清组织多肽特异性抗原(TPS)、癌相关糖蛋白抗原(CA153)水平。采用美国贝克曼公司生产的流式细胞仪(CytoFLEX)检测血清CD3+、CD4+、CD8+水平。
1.6 评定标准
治疗2个月后有新病灶出现或目标病灶体积增加≥25%为进展(PD);目标病灶体积增加<25%或缩小<50%为稳定(SD);目标病灶体积缩小>50%为部分缓解(PR);目标病灶基本消失,且可维持4周为完全缓解(CR)[8]。临床控制率=(SD+PR+CR)/总例数×100%。
1.7 观察指标
①治疗效果。②两组治疗前及治疗2个月后血清TPS、CA153水平变化情况。③两组治疗前及治疗2个月后血清CD3+、CD4+、CD8+水平变化情况。④毒副作用(恶心呕吐、白细胞下降、血小板下降)。⑤采用欧洲癌症研究与治疗组织生存质量核心30问卷调查表(EORTCQLQ-C30)评估对比两组治疗前及治疗2个月后的生存质量,包括认知功能、角色功能、情绪功能、躯体功能及社会功能5个维度,每个维度总分均为100分,分值越高,生存质量越好[9]。⑥随访3年统计比较两组生存率。
1.8 统计学方法
通过SPSS 22.0对数据进行分析处理,计量资料用均数±标准差(x±s)表示,采用t检验;计数资料用[例(%)]表示,采用χ2检验;等级资料采用Ridit检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 两组临床疗效比较
观察组临床疗效优于对照组,且观察组临床控制率高于对照组,差异有统计学意义(P < 0.05)。见表2。
2.2 两组治疗前后血清肿瘤标志物水平比较
治疗2个月后,两组血清TPS、CA153水平均较治疗前降低,且观察组较对照组降低更明显,差异有统计学意义(P < 0.05)。见表3。
2.3 两组治疗前后血清CD3+、CD4+、CD8+水平比较
两组治疗前CD3+、CD4+、CD8+水平比较,差异无统计学意义(P > 0.05)。两组治疗2个月后血清CD3+、CD4+水平均较治疗前降低,但观察组高于对照组,差异有统计学意义(P < 0.05);两组治疗前后血清CD8+水平比较,差异无统计学意义(P > 0.05)。见表4。
2.4 两组毒副作用发生情况比较
两组白细胞下降、恶心呕吐、血小板下降发生率比较,差异无统计学意义(P > 0.05)。见表5。
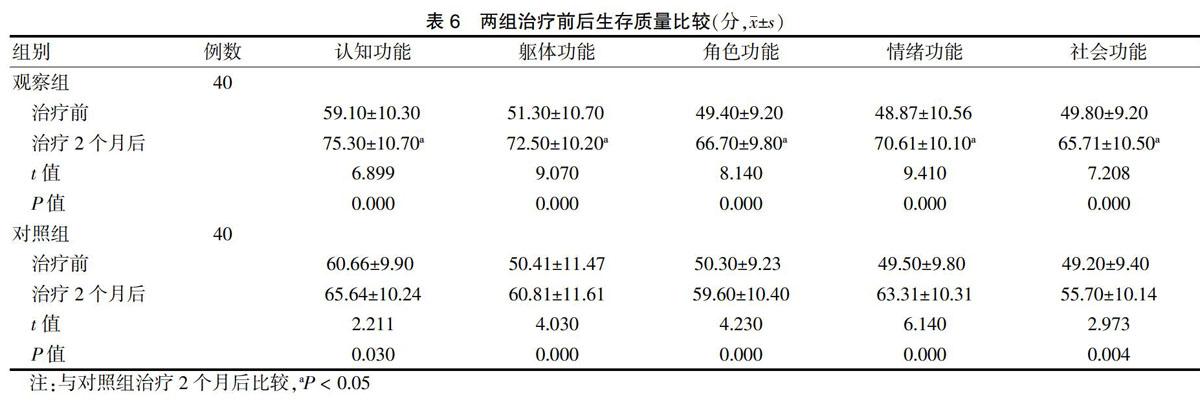
2.5 两组治疗前后生存质量比较
治疗前两组生存质量比较,差异无统计学意义(P > 0.05);治疗2个月后,两组认知功能、躯体功能、角色功能、情绪功能及社会功能评分均高于治疗前,且观察组高于对照组,差异有统计学意义(P < 0.05)。见表6。
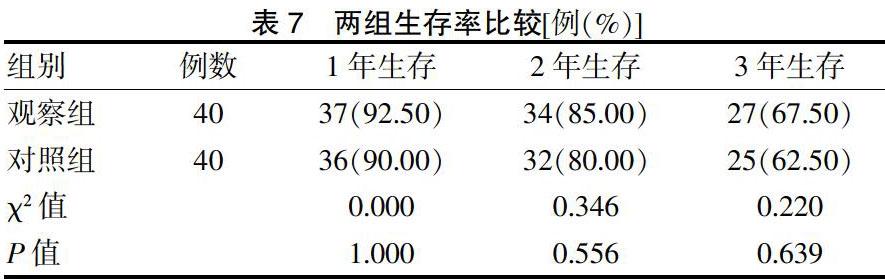
2.6 两组生存率比较
随访3年,两组1、2、3年生存率比较,差异无统计学意义(P > 0.05)。见表7、图1。
3 讨论
晚期乳腺癌恶性程度高、病死率高,有调查数据显示,全球范围内每年约有40万患者死于乳腺癌,尤其是HER-2表达阳性的乳腺癌晚期患者,增殖指数高、肿瘤负荷大,转移率、病死率更高,需引起重视[10-12]。血清学肿瘤标志物是细胞癌变发生、发展、转移过程中分泌的一类活性物质,其水平变化可反映肿瘤恶性程度及治疗效果[13]。TPS为肿瘤标志物的一种,可充分体现乳腺肿瘤生物学行为,在肿瘤增殖活跃期呈高表达状态;CA153为固定于膜上的黏液性糖蛋白,为反映肿瘤大小、监视肿瘤细胞转移的有效指标,其水平居高不下则提示需加强临床治疗措施[14-15]。
GEM+CAP化疗方案由化疗药物GEM、CAP组成,其中GEM属细胞周期性特异性抗肿瘤药物,可作用于肿瘤细胞DNA合成期,抑制G1期向S期进展;同时可使肿瘤细胞DNA链错配,阻断DNA合成,促进肿瘤细胞凋亡;CAP为氟尿嘧啶前体药物,口服进入机体后可转化为氟尿嘧啶的抗代谢氟嘧啶脱氧核苷氨基甲酸酯类药物,抑制肿瘤细胞分裂,抑制蛋白质、RNA合成;两者联合可协同增效、控制肿瘤生长、转移[16-17]。但本研究发现GEM+CAP化疗对部分患者病情控制能力较差,且GEM+CAP化疗是一种全身性用药化疗方案,在杀死肿瘤细胞的同时,对患者机体正常细胞亦会造成较大伤害,导致其机体免疫力低下,影响患者生存期生活质量;需结合靶向治疗药物,以减轻对机体正常细胞的损害,提高机体免疫。
曲妥珠单抗是用于治疗实体瘤的人源化抗HER-2受体的单抗药物,对肿瘤细胞具有高度亲和性及靶向性,为抗HER-2治疗的首选药物,有研究指出曲妥珠单抗可降低乳腺癌化疗患者预后复发及死亡風险[18];其以HER-2基因为靶点,可将HER-2所介导的信号转导通路阻断,降解HER-2受体蛋白,减小细胞膜HER-2蛋白浓度,抑制血管新生,促使细胞停滞于G1期,抑制肿瘤生长;且可通过抗体依赖性细胞毒性,杀伤肿瘤细胞,改善患者临床症状,延长其生存期限;此外该药物异源性较低,对非靶细胞杀伤力小,安全性高,单独用于治疗乳腺癌有效率为15%~26%[19];与GEM+CAP化疗方案联合使用可相互补充、多靶点杀死肿瘤细胞,尽可能减轻对正常细胞的损害,改善预后。本研究发现,观察组治疗2个月后血清TPS、CA153水平低于对照组,疾病临床控制率高于对照组(P < 0.05),说明给予HER-2阳性晚期乳腺癌患者曲妥珠单抗联合GEM、CAP化疗治疗,效果显著,可降低血清肿瘤标志物水平,提高疾病临床控制率,改善患者临床症状。
此外,有研究指出肿瘤的发生、进展及转移与患者免疫状态关系密切[20]。血清T细胞亚群为临床监测患者免疫功能的重要指标,其中CD3+ T细胞代表总T细胞的值,其水平降低则代表免疫功能下降,CD4+主要表达于辅助T细胞,而CD8+主要表达于抑制细胞杀伤性T细胞,当CD3+、CD4+、CD8+水平出现异常变化时则提示免疫功能紊乱的发生[21-22]。本研究发现,两组治疗2个月后血清CD3+、CD4+水平均低于治疗前,但观察组高于对照组(P < 0.05),说明化疗可在一定程度上降低患者的机体免疫力,但结合靶向药物曲妥珠单抗治疗,对机体免疫影响小,可减轻免疫损伤,有助于改善预后。同时,本研究发现两组毒副作用(白细胞下降、血小板下降、恶心呕吐)及1、2、3年生存率比较,差异无统计学意义(P > 0.05);观察组治疗2个月后认知功能、角色功能、情绪功能、躯体功能及社会功能评分高于对照组(P < 0.05),提示曲妥珠单抗辅助GEM、CAP化疗方案治疗HER-2阳性晚期乳腺癌,毒副作用小、生存率高,可提高患者生存质量。此外,本研究亦存在一定不足之处:选取样本量小,且未对研究者、被研究者及结果分析者进行盲法控制,存在分配偏倚、评估偏倚的可能,有待临床多中心、多渠道选取样本,完善研究方案,进行更深入的研究探讨。
综上可知,曲妥珠单抗联合GEM、CAP化疗应用于HER-2阳性晚期乳腺癌患者,效果显著,主要体现在治疗后血清肿瘤标志物水平下调、疾病临床控制率提高、生存质量提高方面,且对患者免疫功能影响小、毒副作用小、预后生存率高,具有较高的临床推广应用价值。
[参考文献]
[1] 崔剑锋.曲妥珠单抗联合长春瑞滨治疗HER-2阳性晚期乳腺癌患者的疗效分析[J].实用药物与临床,2017,20(7):759-762.
[2] Baselga J,Bradbury I,Eidtmann H,et al. Lapatinib with trastuzumab for HER2-positive early breast cancer (Neo- ALTTO):a randomised,open-label,multicentre,phase 3 trial [J]. Lancet Oncol,2014,15(10):1137-1146.
[3] 何江涛,王伟.曲妥珠单抗联合吉西他滨或卡培他滨一线治疗HER-2阳性晚期乳腺癌的临床研究[J].中国当代医药,2017,24(13):97-99.
[4] 胡爱玲.曲妥珠单抗联合含紫杉类方案治疗HER-2阳性晚期乳腺癌疗效观察[J].现代中西医结合杂志,2015,24(35):3948-3950.
[5] 文芳,翁洁,罗盘.吉西他滨联合卡培他滨二线治疗晚期乳腺癌的疗效评价[J].中国肿瘤外科杂志,2015,7(3):184-185.
[6] 黄玉琴.注射用曲妥珠单抗对人表皮生长因子受体2阳性晚期乳腺癌化疗患者血清肿瘤标志物及免疫功能的影响[J].中国综合临床,2017,33(8):748-752.
[7] 王福玲.世界医学会《赫尔辛基宣言》——涉及人类受试者的医学研究的伦理原则[J].中国医学伦理学,2016,29(3):544-546.
[8] 贾春芳,段敏,段昕.参芪扶正注射液联合化疗治疗乳腺癌的疗效及对患者造血功能及免疫功能的影响[J].海南医学院学报,2016,22(16):1866-1869.
[9] 唐政,王继伟,张庆云,等.QLQ-BR23和EORTC QLQ-C30测量康复锻炼对乳腺癌患者生命质量的影响[J].复旦学报:医学版,2015,42(5):589-595.
[10] 廖春雁,陈圆圆,曾健,等.常规超声结合弹性成像对非哺乳期乳腺炎与乳腺癌的鉴别诊断价值[J].中国超声医学杂志,2016,32(1):16-18.
[11] Weiss NS. Re:“twenty five year follow-up for breast cancer incidence and mortality of the canadian national breast screening study:randomised screening trial” [J]. Am J Epidemiol,2014,180(7):759-760.
[12] 王俊斌,杨燕,汪子书,等.长春瑞滨或吉西他滨联合顺铂治疗转移性三阴性乳腺癌的临床疗效与安全性评价[J].中国临床药理学杂志,2016,32(1):24-26.
[13] 熊娟.探讨肿瘤标志物(CA153、CA199、CA125、CEA)联合检测对乳腺癌、卵巢癌和结直肠癌的诊断价值[J].中国社区医师,2017,33(1):93-94.
[14] 蒋显勇,易艳军,梁庄严,等.血清HER-2/neu、TPS、CA15-3和TSGF聯合检测在乳腺癌诊断中的价值[J].实用医学杂志,2016,32(24):4115-4117.
[15] 傅丽敏,程雪,张小薇.血清肿瘤标记物癌胚抗原、CA153和CA125检测对乳腺癌的临床诊断价值[J].中国现代医生,2016,54(20):104-107.
[16] 林梅燕,王季堃.卡培他滨和吉西他滨分别联合卡铂治疗晚期三阴性乳腺癌的近期疗效比较[J].解放军医学院学报,2016,37(6):573-575.
[17] 宋志刚,庞东生,李星缘.卡培他滨联合吉西他滨治疗蒽环类耐药的转移性乳腺癌的效果比较[J].宁夏医科大学学报,2015,37(4):459-461.
[18] 殷科,曹永晋.曲妥珠单抗新辅助化疗表皮生长因子受体2阳性乳腺癌的临床疗效及安全性评价[J].中国临床药理学杂志,2015,31(9):725-727.
[19] 顾文静.通阳祛瘀中药联合曲妥珠单抗治疗乳腺癌疗效及对血清CEA、CA153、CA724的影响[J].现代中西医结合杂志,2017,26(23):2599-2601.
[20] 马隆波,王静,胡雪梅.生物治疗联合化疗与单纯化疗乳腺癌患者免疫功能的差异[J].滨州医学院学报,2015, 38(4):263-265.
[21] 李杰宝.消癌顺气汤联合CAF化疗对147例乳腺癌患者T细胞亚群和血管内皮生长因子的影响及疗效分析[J].海南医学院学报,2015,21(3):381-383.
[22] 李杰宝,张家衡.复方苦参注射液治疗乳腺癌术后化疗患者的临床疗效及其对外周血T细胞亚群的影响研究[J].中国医院药学杂志,2015,35(21):1945-1949.
