非综合征性唇腭裂外周血血浆外泌体源miRNA的表达研究
2019-09-28王俊伟杨学财李一颖侯志军胡宁宁
王俊伟 杨学财 李 玮 李一颖 侯志军 胡宁宁 宋 凯
唇腭裂是常见的先天性发育畸形,在我国发病率约为1.82/1000,在先天畸形的发生率中排第三位[1]。按照其是否伴有其他系统、器官畸形分为综合征性唇腭裂和非综合征性唇腭裂(non-syndromic cleft lip with or without cleft palate,NSCL/P)。唇腭裂的发生影响患者的发音、听力、面部的发育,而且治疗周期长、难度大、费用高,给患者和社会带来沉重负担。因此对唇腭裂发病原因的研究就显得格外重要。
外泌体是一种能被大多数细胞分泌的微小膜泡,具有脂质双层膜结构,直径大约30~100nm,内部含有细胞特异的蛋白、脂质和核酸,能作为信号分子传递给其他细胞从而改变其他细胞的功能,在很多生理、病理过程中起着重要的作用[2]。其中miRNA作为一种非编码单链RNA 分子,广泛参与调节细胞的增殖分化,并与腺体发育、肿瘤的侵袭、转移以及颌面部发育异常息息相关[3~6]。Li 等[7]通过提取皮肤组织中的miRNA 进行研究发现miRNA 与NSCL/P易感性密切相关。Zou 等[8]通过分析NSCL/P 患者血浆来源的miRNA 的表达框架发现血浆中的某些miRNA 较对照组高表达,其可能作为一组诊断唇腭裂的标记物。目前对于miRNA 的研究多为血浆总RNA,而血浆外泌体中miRNA 的纯度更高,对结果的干扰更小,因此更适合作为目标分子进行研究。已知的研究证实 miRNA 在 PDGF、TGF-β、BMP、wnt、SHH 等重要信号通路之中均发挥重要作用[9~12],能够介导细胞间通讯的基因信息交流[13]。因此鉴定miRNA 分子对于理解NSCL/P 的调节机制是非常重要的,然而,NSCL/P 血浆外泌体源miRNA 的表达谱仍然很少被研究,同时,我们的另一项研究(未发表结果)表明,外周血血浆外泌体的浓度在患者和健康人之间无统计学差异,因此,本实验将研究方向放在外泌体内部miRNA 的差异性表达,通过对NSCL/P患者和正常儿童外周血外泌体内部miRNA 进行分离提取,对miRNA 进行测序来分析差异表达的血浆外泌体源miRNA,并对miRNA 的靶基因进行Go 和KEGG 通路富集分析。
资料和方法
1.研究对象的选择及血浆样本收集:随机选择青岛大学附属医院2016年~2018年典型病例作为研究对象:8 例NSCL/P 患者的外周血取自于青岛大学附属医院口腔颌面外科手术患者(A 组),8 例正常儿童外周血取自于青岛大学附属医院产科新生儿(B 组)。纳入标准:NSCL/P 患者和健康儿童的年龄均在2~12 个月之间;患者经临床全面检查及医生确诊,不合并其它先天性疾病或先天性畸形以及其它重要脏器疾病,无唇腭裂家族史;正常儿童符合新生儿健康标准,无全身遗传性疾病,无家族遗传性疾病史,在性别和出生地区与病例组匹配。研究方案经青岛大学机构审查委员会批准,与患者父母签订书面知情同意书后,进行外周血样品采集。将外周血收集到EDTAK2 管中,然后立即离心获取等份的上清液(血浆)储存在-80℃冰箱。
2.血浆中外泌体的分离提取:采用QIAGEN exoEasyMaxiKit 试剂盒,通过使用超滤法分离提取血浆中的外泌体[14,15]。将血浆过滤去掉大于0.8μm的颗粒;加入与样本等体积的XBP 缓冲液混匀,并让溶液升至室温后加入16ml 的Sample/XBP 的混合物到exoEasy 离心柱中并500×g 离心1min,弃流出液并将离心柱放回收集管中;向离心柱中加入10mlXWP 并 5000×g 离心 5min 去除残余的缓冲液,弃流出液,并将离心柱从收集管中取出,将离心柱放入一个新的收集管中并加入400μlXE 缓冲液到膜上并孵育1min,500×g 离心5min 收集洗脱液;将洗脱液重新吸出加回离心柱中,孵育1min,5000×g 离心5min 洗脱外泌体到一个新的离心管中。
3.外泌体鉴定—电镜观察:吸取外泌体样品10μl 加于200 目铜网上沉淀10min,滤纸吸去浮液;将醋酸双氧铀10μl 滴加于铜网上沉淀1min,滤纸吸去浮液,常温干燥数分钟,上机,80kv 成像。
4.外泌体表面标记物检测:采用Automated Capillary Western Blot(WES)对外泌体表面蛋白TSG01、CD81 进行鉴定。
5.血浆外泌体蛋白BCA 法定量:配制工作液、标准品及待测外泌体样品,利用BCA 定量法对外泌体蛋白进行测定,计算出外泌体样本的浓度。
6.外泌体源miRNA 抽提与质量检测:吸取等量外泌体样品加Trizol,室温放置5min,以12000rpm离心10min,弃沉淀,按200ul 氯仿/mlTrizol 加入氯仿,混匀后冰上放置5min。以4℃12000xg 离心15min,吸取上层水相至另一离心管中,按0.5ml 异丙醇/mlTrizol 加入异丙醇混匀,冰浴放置10min。以4℃12000xg 离心 10min,弃上清,RNA 沉于管底,按1ml75%乙醇/mlTrizol 加入75%乙醇悬浮沉淀。以4℃8000xg 离心 5min,弃上清,室温晾干 10min,以30ulDEPC 处理水溶解RNA 样品。使用Agilent2100测定 miRNA 在分光光度计 260、280 和 230nm 的吸光度值,以计算浓度并评估纯度。
7.miRNA 测序分析:使用Agilent2100 miRNA微阵列芯片对16 个外泌体miRNA 分别进行分析,其中包括8 个非综合征性唇腭裂血浆样品和8 个正常血浆样品。使用GeneSpring 软件进行原始数据分析,筛选显示出两倍或更大变化的差异表达的miRNA。
8.GO和 KEGG通路富集分析:使用TARGETMINER,miRDB,microRNA,TarBase 数据库中的至少两个同时进一步分析差异表达的miRNA 的预测靶基因,并对差异表达的miRNA 的预测靶标进行GO 富集分析和KEGG 通路富集分析。靶基因的KEGG 和GO 分析采用R 软件的超几何分布检验,P 值经Benjamini & Hochberg 多重检验纠正。
结 果
1.血浆中外泌体的鉴定:本研究成功从16 例血浆样本中分离外泌体,各组获得的外泌体沉淀量无明显差异,并在透射电镜下观察到30~100nm 大小不一的囊泡状结构,符合外泌体的电镜表现,且可观察到其典型的茶托状形态(图1)。
2.Automated Capillary Western Blot 结果:检测外泌体标记蛋白TGS101、CD81 的表达情况,见图2,非综合征性唇腭裂患者和正常对照者的血浆外泌体中均表达TSG101 和CD81。

图1 透射电镜下外泌体形态

图2 外泌体WES 胶图
3.外泌体浓度检测及外泌体miRNA 质量检测:使用Agilent2100 检测个样品中的外泌体浓度并进行组间比较,未发现差异(P<0.05),如表1所示。在上机测序前用Agilent 2100 进行文库质控,图3为电泳图,五个样本均有smear 条带,可以进行后续测序流程。

表1 外泌体浓度

图3 miRNA Agilent2100 电泳图
4.miRNA 测序结果:利用T-test 分析A 组与B组两样本间显著差异表基因后,以log2(FoldChange) 为横坐标,以 T-test 显著性检验p-Value 的负对数 -log10(p-Value)为纵坐标,得出火山图(图4),图中彩色点表示筛选出的相应基因;并对差异表达miRNA 进行非监督层次聚类(图5):经过筛选A 组与B 组出现差异表达的miRNA 共18条,P值均<0.05,具有统计学意义,A 组较 B 组表达上调的14 条,表达下调的4 条。
5.失调的miRNA 的潜在靶基因的功能分析:我们对NSCL/P 患者外周血外泌体中差异表达的miRNA 的预测靶标进行了GO 和KEGG 通路富集分析,包括 14 种上调的 miRNA 和 4 种下调的miRNA,共产生6747 种可能的靶基因。富集的GO术语在图中列出(图6),其靶基因功能富集于多细胞生物发育、转录调节、信号转导、蛋白质结合及外泌体等30 个生物学过程。异常表达的miRNA 靶基因通过KEGG 数据库进行通路富集分析,其靶基因信号通路富集于赖氨酸降解、Wnt 信号传导、MAPK信号传导、TGF-β 信号传导及钙信号传导等304个信号通路(图7)。

图4 实验组与对照组miRNA 差异表达(火山图)

图5 差异miRNAheatmap图
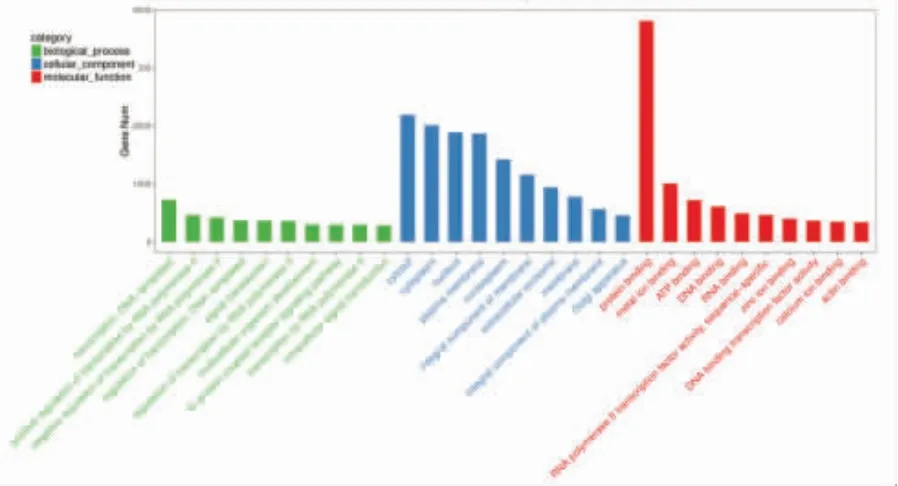
图6 GO 富集TOP30 条目图

图7 KEGG 富集TOP20 气泡图
讨 论
外泌体是包含核酸和蛋白质的囊性小泡,特异性膜结构及其内部多种遗传物质广泛参与、调控Wnt/β-catenin 信号及TGF-β 信号通路的表达。Hopper 等[19]研究发现Wnt 信号通路的组成成分通过外泌体这一载体作用于远处细胞,同时外泌体可通过TGFβ1 和Smad 信号通路介入腭中嵴上皮细胞的转归,从而影响腭裂的发生[9,20~22]。外泌体内部含有 mRNA、miRNA 等信号分子,miRNA 是一类具有调控功能的内源性非编码单链RNA 分子,通过碱基互补配对识别靶基因,参与基因的网络调控。研究差异表达的血浆外泌体源miRNA 在NSCL/P 患者中的表达谱将进一步提高我们对这种疾病的认识、诊断和管理。在NSCL/P 患者组织中miRNA 差异表达的研究中,苏艳国[23]、李曼达[12]及王鑫[10]通过提取结缔组织中的miRNA 进行芯片杂交研究发现254 条表达差异,均采用4 例病例样本与4 例正常样本,并在实验中得以验证。另外研究人员发现组织中的总miRNAs 表达水平高于血浆来源的外泌体,此外,研究人员还发现了在外泌体内选择性富集的miRNAs[24]。这些结果表明,由于miRNA 的差异变化,外泌体miRNA 的测量不能被组织中miRNA 的测量所代替,反之亦然。综上此次研究使用miRNA测序分析来评估NSCL/P 患者血浆样本中外泌体源miRNA 与健康儿童的差异表达,实验中采用8 例病例样本与8 例正常样本对比完成。
从图6及图7可以看出这差异的miRNA 靶基因涉及大量的信号通路,反映了唇腭裂基因调控的复杂性,同时也反映出唇腭裂的发生时多基因的变异造成的。同时我们还发现图中一些miRNA 的条数虽少,但其差异表达的倍数却很高,最具代表性的为miRNA-133a-3p,是Wnt 通路重要转录调节因子,上调达到182 倍,基于Hopper[19]的研究推测miRNA-133a-3p 的高表达对Wnt 通路起到抑制作用,导致WNT 相关基因的缺乏,使细胞的定向迁移消失,协同其他上调miRNA 最终导致唇腭裂的发生。同时,Vincenzo[25]等通过对NSCL/P 患者的唾液中外泌体的研究发现miR-150、miR-128 在唇腭裂的发生中发生了重要作用,这两种miRNA 在本研究中也得到了验证。
基于GO 分析,NSCL/P 患者血浆外泌体中上调和下调的miRNA 的预测靶基因主要参与多细胞生物发育、转录调节、信号转导、蛋白质结合及外泌体的分泌等。通过KEGG 富集分析,检查前20 个富集通路显示,靶基因与多种通路相关,包括维生素的代谢通路[26]、转化生长因子(TGFs)[27]、丝裂原活化蛋白激酶(MAPK)[28]、WNTs 基因家族[29]以及血管内皮生长因子(VEGF)[30],既往研究结果表明这些通路均参与NSCL/P 的发生。
NSCL/P 的发病受到多种因子的调控,miRNA作为新发现的基因调节小分子,在个体发育及生理病理过程中发挥重要作用,其在疾病筛查和防治等方面的研究越来越多的受到关注[31]。目前,唇腭裂领域关于miRNA 的研究尚少,仅个别miRNA 的作用已明确,对于人体组织中血浆外泌体源miRNA 在腭裂或唇腭裂的发病机制中的作用,特别是在唇、腭的发育及颅面结构的影响,需要进一步探索。
通过miRNA 测序分析,我们发现NSCL/P 患者与健康儿童相比,外周血血浆外泌体内部的存在差异表达的miRNA,使用GO 和KEGG 通路富集分析,我们发现了外泌体源miRNA 参与的诸多生物过程及信号传导通路,其可能作为新的NSCL/P 的筛查和防治靶点,进一步研究潜在靶基因的机制,为未来的唇腭裂临床预防和治疗提供新的途径。
