真蛸早期发育形态特征及生长规律研究*
2019-09-27徐大凤刘永胜陈四清赵捷杰葛建龙刘长琳
徐大凤 刘永胜 常 青 陈四清① 赵捷杰 边 力 葛建龙 刘长琳
真蛸早期发育形态特征及生长规律研究*
徐大凤1,2刘永胜3常 青1,4陈四清1,4①赵捷杰1,2边 力1,4葛建龙1,4刘长琳1,4
(1. 中国水产科学研究院黄海水产研究所 青岛 266071;2. 上海海洋大学水产与生命学院 上海 201306;3. 烟台市水产研究所 烟台 264000;4. 青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071)
为了探究真蛸()早期幼体生长发育特征,在室内水泥池育苗条件下,研究了孵化后1~100日龄真蛸的形态变化特征,并对1~49日龄真蛸的全长、腕长、胴长、胴宽、体重及最长腕的吸盘个数进行了测量。结果显示,在盐度为30~32,水温为18.6℃~26.0℃条件下,初孵仔蛸平均全长为(3.05±0.11) mm,大部分初孵仔蛸外卵黄囊在出膜前已吸收完毕,1日龄仔蛸已开口摄食,17日龄稚蛸开始摄食糠虾,35日龄稚蛸开始营底栖生活,60日龄体色由透明发育为乳白色,80日龄体色已与成体相同,100日龄除性腺外,各器官发育成熟,形态特征与成体基本一致。研究表明,真蛸早期(1~49日龄)发育过程中,体重与全长呈立方函数关系,为=5×10–53– 0.00092+0.0072–0.0132;全长与腕长呈立方函数关系,为=–0.00123+0.04922+0.0243+0.2179;全长、体重、腕长、胴长、胴宽分别与日龄呈立方函数关系,为=–0.00013+0.01052–0.0122+3.0562、=–2×10–73+4×10–52–0.0004+0.0034、=–0.00043+0.02472–0.1037+0.8214、=–0.00043+0.01242+0.0749+1.4757、=–3×10–53+0.00252+0.0354+1.4026。依据营养类型、形态和生物学特征等参数,将真蛸早期发育分为仔蛸期、稚蛸浮游期、稚蛸底栖期和幼蛸期4个时期。
真蛸;早期发育;形态特征;生长
真蛸()属于软体动物门(Mollusca)、头足纲(Caphalopoda)、二鳃亚纲(Dibranchiata)、八腕目(Octopoda)、蛸科(Octopodidae)、蛸属(),是重要的经济种类,广泛分布于世界各大洋的热带和温带海域(董正之, 1988)。真蛸味道鲜美,营养丰富,食用价值极高,既可鲜食,也可为干品,入药具有补气养血、收敛生肌的作用,深受人们喜爱。真蛸具有生命周期短(廖永岩等, 2006)、产卵量大(Boyle, 1983;Iglesias, 2007; Garcia, 2006)、食物转化率高(Mangold, 1973; Roo, 2017)和生长速度快(Mangold, 1973)等特点,是极具潜力的海水增养殖品种。
目前,由于对真蛸生物学、繁育条件和营养需求等知识缺乏了解,人工繁育条件下,幼体在浮游期生长慢、死亡率极高,阻碍了真蛸增养殖产业发展(Garrido, 2017; 王卫军等, 2017)。国外许多学者从生理、生化和营养等方面对真蛸幼体开展了大量工作(García-Garrido, 2012; Garrido, 2016、2017; Nande, 2017; Roo, 2017),而关于真蛸早期形态特征和生长规律鲜有报道。国内对真蛸研究刚刚起步,李雷斌等(2012)和郑小东等(2011)分别对真蛸幼体的饵料和浮游期生长进行了研究,但对真蛸幼体早期生长发育特征的描述和划分缺乏详细的资料。因此,开展对真蛸早期幼体的形态特征与生长等方面的研究十分必要。
本研究观察了真蛸幼体胚后从浮游至附底 (100日龄)过程中的形态发育,并对各个阶段的形态特征进行描述和划分,对1~49日龄幼体的可量性状进行测量和分析,以期补充和完善真蛸早期生长发育研究资料,旨在丰富真蛸基础生物学研究,为国内开展真蛸人工育苗技术的开发提供参考资料。
1 材料与方法
1.1 材料
真蛸亲体于2017年7月采捕自浙江省南麂岛海域,通过活水车运输到烟台市水产研究所牟平基地人工培育,培养40 d后,自然交配产卵,将产卵亲体、卵群及蛸巢一并置于水泥池中流水孵化,期间每日投喂少量菲律宾蛤仔()。培育水温为23.7℃~25.4℃,盐度为29~32,pH为7.8~8.4,日换水量为100%~200%,孵化21 d得到初孵幼体。
1.2 方法
将初孵仔蛸移入水泥池(6 m×2 m×1.5 m)中培育,50日龄前,水温变化范围为23.6℃~26.0℃,50~ 100日龄,水温变化范围为18.6℃~23.0℃,盐度为30~32,连续充氧,溶解氧含量>5.0 mg/L,3日龄前静水培育,4日龄开始换水,日换水量为30%~70%,光照强度1000 lx以下。0~15日龄投喂卤虫()无节幼体,15~50日龄投喂卤虫无节幼体和活体糠虾,50日龄后投喂光滑河蓝蛤(),壳长为12~ 16 mm,日投喂2次。
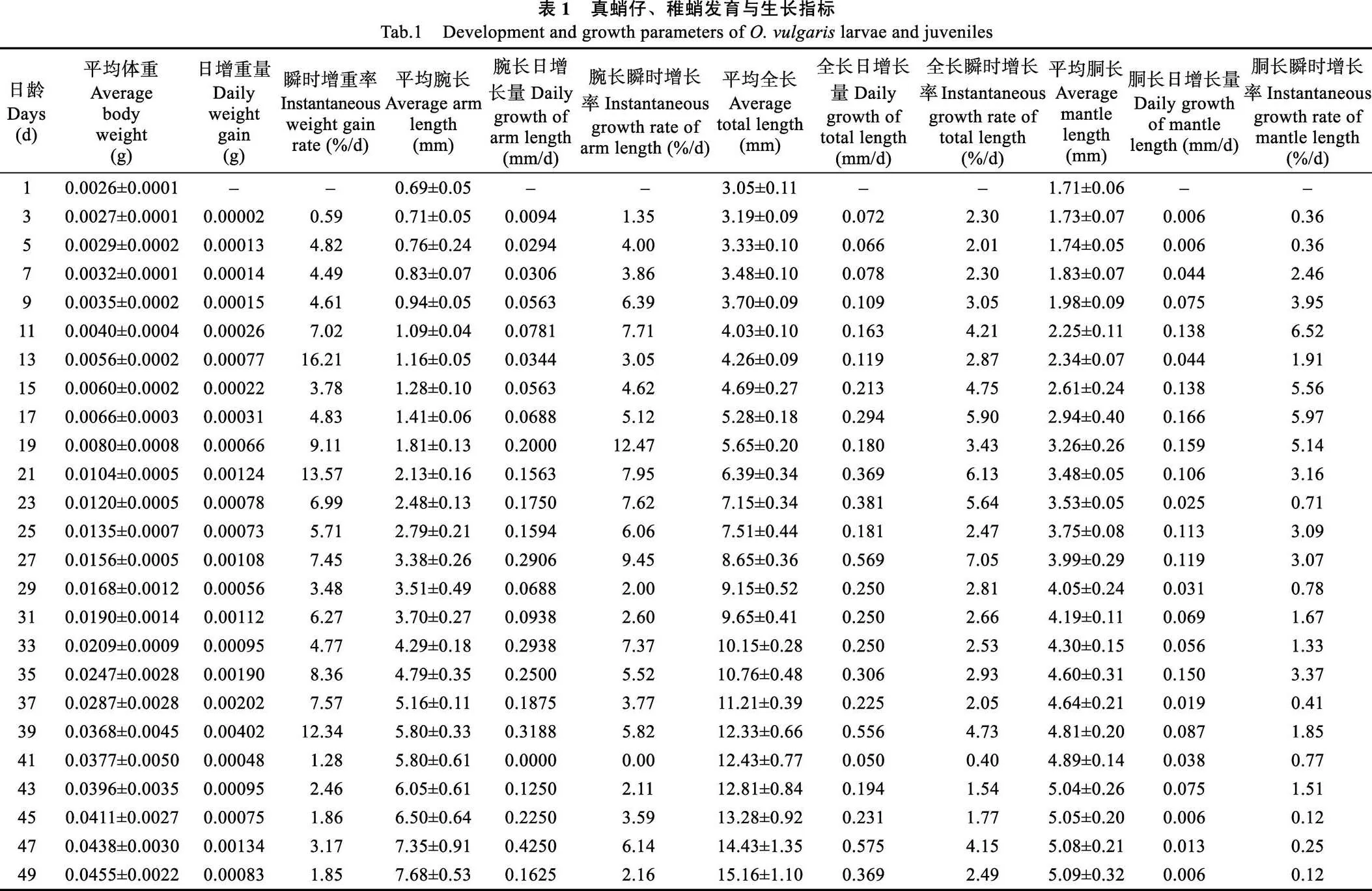
每日定期观察,1~49日龄真蛸,每隔1 d在池中随机取8尾幼体,50~100日龄真蛸每隔4 d随机取 5尾幼体,用显微镜(奥林巴斯CX23型)和解剖镜(重光ZSA0850型)拍照并记录其发育情况。1~49日龄真蛸,在解剖镜下测定其全长、胴长、胴宽、腕长和最长腕吸盘个数等形态特征,用精密电子天平测定其体重,测量前用拧干的湿纱布吸干表面水分。测量方法:全长(Total length, TL)为真蛸胴部低端至腕部最前端的距离;腕长(Arm length, AL)为真蛸腕的基部至顶端的距离;胴长(Mantle length, ML)为真蛸胴部底端至头部底端的距离;胴宽(Mantle width, MW)为真蛸胴体最宽的距离(图1)。

图1 真蛸测量参数(蔡如星, 1991)
1.3 数据分析
实验数据采用Excel2016和SPSS19.0软件处理。选定2为最大值的函数关系式作为最佳曲线。以平均体重、全长及腕长的日均增长量、瞬时增长率来描述真蛸幼体的生长特征(李达等, 2017)。
参数计算公式为:
(1)瞬时增长率(Instantaneous growth gain rate, %/t)=[(ln2–ln1)/(2–1)]×100%
(2)瞬时增重率(Instantaneousweight gainrate, %/t) =[(ln2–ln1)/(2–1)]×100%
(3)日均增长量(Average daily growth gain, mm/d)= (2–1)/(2–1)
(4)日均增重量(Average daily weight gain, g/d)= (2–1)/(2–1)
式中,1为1时刻的全长、腕长或胴长(mm);2为2时刻的全长、腕长或胴长;1为1时刻的体重(g);2为2时刻的体重(g)。
2 结果
2.1 仔稚蛸形态发育特征
2.1.1 仔蛸期 初孵仔蛸:大部分初孵仔蛸外卵黄囊已吸收完毕,仅有少数尚未吸收(图2a、图2b),未吸收完卵黄囊呈椭圆形,长径为(0.842±0.019) mm,短径为(0.801± 0.002) mm,卵黄囊被腕部包裹,在孵出9 h内可被吸收完;初孵幼蛸内卵黄囊披附在消化腺周围,尚未吸收完毕(图2w)。
1~2 d:孵化1 d仔蛸已开口摄食,全长为(3.05± 0.11) mm,腕长/胴长比为0.40∶1,形态已与成体接近(图2c),胴体背部外套膜表面透明无色,内部有8个色素斑块,胴体腹部色素斑块16~20个均匀分布;头部背面有7~9个大小不一、近卵圆形色素斑块,头部腹面有2个近纺锤形浅色斑;各腕长大小相近,腕上均匀分布3~4个色素斑块,各腕3个初生吸盘(图2v);口球内上下颚发达,消化、呼吸以及循环器官结构明显;内卵黄囊缩小,但未消化完毕(图2x);初孵仔蛸可在水中自由活动,主要靠胴体收缩来完成,营浮游生活,活动能力较弱;当仔蛸停留在某一水层时,头部朝下,胴体斜向上,呈斜角状态,有趋光性。
3~5 d:腕部末端开始生长,但并未形成新生吸盘;鳃叶逐渐增至8~10片,胴长、腕长、胴宽逐步增长,但生长速度较为缓慢;强光下或遇见刺激时,有喷墨现象发生;有集群现象。孵化第5天(图2d),内卵黄囊已吸收完毕(图2y),全长为(3.33±0.10) mm,腕长/胴长比为0.44∶1,全长日增长量为0.07 mm/d。
2.1.2 稚蛸浮游期 7~25 d:生长速度加快,随着腕增长,腕上色素与吸盘个数逐渐增多,腕吸盘2行,生长于3个初生吸盘末端;孵化25 d(图2h),最长腕吸盘个数逐渐增至13个,全长为(7.51±0.44) mm,腕长/胴长比为0.745∶1,全长日增长量为0.224 mm/d。
27~33 d:胴体背部色素斑块增多(图2i),相比于胴长,腕部生长迅速,腕上色素继续增加;孵化33 d (图2j),各腕之间观察到由浅膜连接(图2z),腕部吸盘逐渐增至17~19个,全长为(10.15±0.28) mm,腕长/胴长比为1∶1,全长日增长量为0.250 mm/d。
2.1.3 稚蛸底栖期 35 d:孵化35 d稚蛸(图2k),幼体底栖比例达60%,即认为真蛸幼体进入稚蛸底栖期。此时全长为(10.76±0.48) mm,腕长/胴长比为1.04∶1,全长日增长量为0.305 mm/d,平均吸盘个数为21个,吸附能力增强,可吸附在池壁或池底。
37~49 d:胴体腹部色素斑块收缩,并逐渐向胴体底部聚集;胴体背面色素斑块数量增多;孵化49 d (图2o),稚蛸吸盘增至26个,全长为(15.16±1.10) mm,腕长/胴长比为1.51∶1,全长日增长量为0.329 mm/d。
52~60 d:胴体背部色素斑块逐渐退化(图2p),体色逐渐由透明变为乳白色(图2q);腕出现明显分化,腕式特征:2>3>4>1,与成体相同(图2q);孵化60 d,全长为(17.95±1.71) mm,腕长/胴长比为1.98∶1,全长日增长量为0.299 mm/d;吸附池底能力增强,在池底爬行活动增多。
60~90 d:胴体和腕部色素斑点极细,且密集增多(图2r、图2s),头部色素斑块褪化,体色逐渐由乳白色变为褐色,体色已与成体相同;孵化90 d,全长为(31.02±2.01) mm,腕长/胴长比为2.5∶1,全长日增长量为0.436 mm/d;强光照射或受刺激体色变白。
2.1.4 幼蛸 100 d:发育100 d(图2t、图2u),全长为(42.51±2.63) mm,全长日增长量为1.150 mm/d,腕长/胴长比为3.63∶1,与成体真蛸基本一致。稚蛸生长到除性腺未发育成熟外,其形态特征已与成体真蛸一致,进入幼蛸阶段。
2.2 早期生长指标
真蛸早期发育阶段(0~49 d)的各项生长指标见表1,仔蛸的生长较为缓慢,17日龄后生长速度明显加快。

a~c:初孵仔蛸;a:含外卵黄囊;b:7 h;c:未含外卵黄囊;d~s:稚蛸;d:5 d;e:9 d;f:13 d;g:17 d;h:25 d;i:29 d;j:33 d;k:35 d;l:37 d;m:41 d;n:45 d;o:49 d;p:52 d;q:60 d;r:80 d;s:90 d;t和u:100 d幼蛸;v:初孵仔蛸腕;w:初孵仔蛸腹面胴体(7 h);x:1 d仔蛸腹面胴体;y:5 d仔蛸腹面胴体;z:33 d稚蛸腕部。A:外卵黄囊;B:外卵黄囊(7 h);C:吸盘;D和E:内卵黄囊;F:无内卵黄囊;G:浅膜
a~c: Newly hatched larva; a: External yolk sac; b: 7 h; c: No external yolk sac; d~s: Juvenile; d: 5 d; e: 9 d; f: 13 d; g: 17 d; h: 25 d; i: 29 d2; j: 33 d; k: 35 d; l: 37 d; m: 41 d; n: 45 d; o: 49 d; p: 52 d; q: 60 d; r: 80 d; s: 90 d; t and u: 100 d young octopus; v: Newly hatched larva arm; w: Venter mantle view of newly hatched larva (7 h); x: Venter mantle view of 1 d larva; y: Venter mantle view of 5 d larva; z: 33 d juvenile arm.A: External yolk sac; B: External yolk sac (7 h); C: Sucker; D and E: Internal yolk; F: No internal yolk; G: Superficial membrane
2.3 真蛸幼体全长、体重的生长变化
初孵仔蛸的平均体重为(0.0026±0.0001) g,平均全长为(3.05±0.11) mm;49日龄,平均体重为(0.0455± 0.0022) g,平均全长为(15.16±1.10) mm,体重为初孵仔蛸的28倍,全长为初孵仔蛸的5倍。通过拟合方程可知,体重、全长与日龄呈立方函数增长,方程分别为=–2×10–73+4×10–52–0.0004+0.0034 (图3,²= 0.9889)和=–0.00013+0.01052–0.0122+ 3.0562 (图4,²=0.9968)。体重与全长关系符合如下关系式:= 5×10–53–0.00092+0.0072–0.0132(图5,²= 0.9951)。孵化后1~17 d,体重和全长总增长速度较为缓慢,体重和全长日增长量分别为0.00025 g/d和0.139 mm/d;孵化后19~49 d,生长较快,体重和全长的日增长量为分别为0.00125 g/d和0.317 mm/d。
2.4 真蛸幼体各器官与日龄的关系变化
2.4.1 腕长、胴长、胴宽与日龄的关系 真蛸发育早期各器官生长缓慢,1~33日龄,腕长小于胴长;随着全长增长,腕相对其他器官增长迅速,35日龄的幼体平均腕长为(4.79±0.35) mm,平均胴长为(4.60± 0.31) mm,腕长已大于胴长。生长至49日龄时,腕长为(7.68±0.53) mm的稚蛸,胴长为(5.09±0.32) mm,胴宽为(5.40±0.12) mm。通过拟合方程可知,腕长、胴长、胴宽与日龄呈立方函数增长,方程分别为= –0.00043+0.02472–0.1037+0.8214 (图6,²= 0.9963);=–0.00043+0.01242+0.0749+1.4757 (图6,²=0.9941);=–3×10–53+0.00252+0.0354+1.4026 (图7,²=0.9974);真蛸幼体全长与腕长符合关系式=–0.00123+0.04922+ 0.0243+0.2179 (图8,²= 0.9983)。

图3 真蛸幼体体重与日龄的关系

图4 真蛸幼体全长与日龄的关系
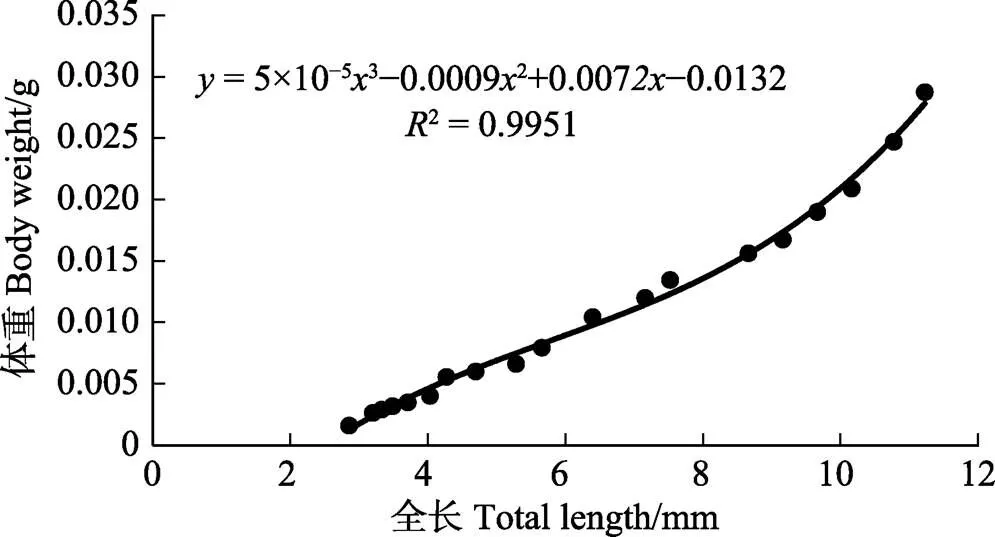
图5 真蛸幼体体重与全长的关系

图6 真蛸幼体胴长(a)、腕长(b)与日龄的关系

图7 真蛸幼体胴宽与日龄的关系

图8 真蛸幼体全长与腕长的关系

图9 真蛸幼体腕长与胴长的比值变化
2.4.2 早期吸盘个数变化 真蛸早期吸盘个数变化如图10所示,吸盘发育是真蛸幼体增长变化的重要指标,初孵仔蛸每个腕有3个初生吸盘,1~7 d,吸盘个数未见增加;1~11 d吸盘个数增加较少,增加2个吸盘;11~21 d增加了6个吸盘;21~31 d增加了6个吸盘,吸盘个数增加速度加快;31~41d增加了 5个吸盘;41~49 d增加了4个吸盘,吸盘个数增加速度放缓,其中生长至35日龄底栖生活时,平均吸盘个数为21个。

图10 真蛸早期幼体吸盘个数变化
3 讨论
3.1 真蛸不同阶段的划分
在蛸类早期阶段划分研究方面,Moguel等(2010)首次把玛雅蛸()早期生命历程分为2个阶段:后孵化期和幼蛸期。Fernández-Gago等(2017)将胚胎和孵化后1个月真蛸分为4个阶段:胚胎期、前孵化期、后孵化期和幼蛸期,但均未对底栖阶段的真蛸幼体划分。本研究依据营养类型、形态和生物学特征等参数,将真蛸早期阶段划分为:仔蛸期、稚蛸浮游期、稚蛸底栖期和幼蛸期4个阶段。各阶段划分依据如下:(1)仔蛸期:营浮游生活,初孵仔蛸以内源性和外源性混合营养为主,内卵黄囊未吸收,内卵黄囊完全消失为这一时期结束的标志;(2)稚蛸浮游期:营浮游生活,真蛸内卵黄囊吸收完毕,仅以外源性摄食为营养来源,腕长小于胴长;(3)稚蛸底栖期:营底栖生活,腕长生长迅速,腕长大于胴长,但此时腕长/胴长比尚未达到成体标准,色素斑块缩小分散,透明体色逐渐转为乳白色,随后体色转为棕褐色,已与真蛸亲体体色相似;(4)幼蛸:性腺发育尚未成熟,但腕长/胴长比等外部形态特征与成体基本相同。
3.2 真蛸生长与摄食
本研究观察到大部分初孵仔蛸外卵黄囊在卵内已吸收,内卵黄囊4~5日龄吸收完毕,这与Fernández-Gago等(2017)的研究结果基本一致。Vidal等(2002)认为真蛸与其他头足类动物类似,在孵化后2~3日龄仔蛸可能仍将卵黄作为主要的能量来源,由于初孵仔蛸腕不发达、吸盘个数少以及消化能力较弱等原因(Young, 1988),掠食活动能力较弱。17日龄前的真蛸,营浮游生活,体重、全长的生长速度缓慢,摄食和消化能力较弱,仅可摄食卤虫幼体等活动能力较弱的生物饵料。而在17日龄后,随着个体增长,腕长/胴长比增加迅速,消化系统逐渐完善,提高了捕食与消化食物的能力,可捕获糠虾等活动力较强、个体较大的生物饵料。17日龄后,体重和体长平均日增长量比前期提高了0.001 g/d和0.178 mm/d,由此可推断,仔蛸孵化后,为提高捕获食物和躲避敌害的能力,影响仔稚幼蛸存活的视觉、摄食和运动等的重要器官在短时间内优先发育,体重增长相对缓慢,以此增强适应环境能力,提高成活率(何滔等, 2012; 雷舒涵等, 2014; Moguel, 2010)。35日龄浮游生活结束,进入底栖阶段,这与Nixon等(1996)研究结果基本相同。进入底栖阶段的真蛸,腕长/胴长比不断增大,腕部作为真蛸的重要器官,腕部的生长速度对真蛸的生存能力有极为重要的影响,腕的快速增长,可为吸盘提供发育的空间,使稚蛸有吸附池壁和在池底爬行的能力,并提高稚蛸主动捕食能力。真蛸底栖阶段平均吸盘个数为21,与Takeuchi(2009)的报道结果基本一致,而Iglesias等(2004)报道的底栖吸盘个数为23个,推测此差异与培育环境有关。50日龄后真蛸主要各功能器官进一步完善,腕上吸盘个数不断增多,摄食与捕食能力进一步增强,已可摄食小贝壳类饵料。
3.3 浮游阶段的2个危险期
在本研究幼苗培育实验过程中,有2个危险期。第1个危险期:7~15 d,会出现大量死亡现象(林国清等, 2008),Iglesias等(2014)和Vidal等(2005)认为在此阶段,稚蛸的捕食和消化能力正在进一步完善,是蛸类内源性和外源性摄食过渡的关键时期。真蛸对饵料要求比较高,幼体孵化前几周需要不间断的捕食与摄食,所以在前期饵料供应不足情况下,可能会导致幼蛸因营养缺乏而死亡。作者在养殖过程中发现,前期仔蛸活动能力较差,主动摄食能力较低,需要维持较高密度饵料投喂来保证被动摄食,但此阶段仍具有很高的死亡率(Seixas, 2010a、b),具体原因和机理还需进一步研究。
第2个危险期:33~40 d,此时从浮游生活逐步进入底栖生活,各器官发育已较成熟,稚蛸主动摄食能力增强,但此阶段真蛸幼体对饵料和营养要求较高,单一饵料已经不能满足稚蛸营养需求,需要PUFA或多种营养来提供补充所需,如蟹幼体的添加可以显著提高成活率(Navarro, 2000、2003)。本研究由于条件限制,仅投喂糠虾饵料以致成活率较低,所以此阶段应注意饵料的营养强化,投喂复合饵料弥补单一饵料在营养上的不足,提高苗种成活率。
Boyle PR. Cephalopod life cycles. Academic Press, 1983, 335–364
Cai RX. Zoology molluscs of Zhejiang. Hangzhou: Zhejiang Science and Technology Press, 1991, 302 [蔡如星. 浙江动物志·软体动物. 杭州: 浙江科学技术出版社, 1991, 302]
Dong ZZ. Fauna Sinica, Mollusca, Cephalopod. Beijing: Science Press, 1988, 88–95[董正之. 中国动物志软体动物门头足纲. 北京: 科学出版社, 1988, 88–95]
Fernández-Gago R, Heß M, Gensler H,. 3D reconstruction of the digestive system incuvier, 1797 embryos and paralarvae during the first month of life. Frontiers in Physiology, 2017, 8: 462
Garcia GB, Cerezo VJ. Optimal proportions of crabs and fish in diet for common octopus () on growing. Aquaculture, 2006, 253(1): 502–511
García-Garrido S, Hachero-Cruzado I, Rosas C,. Protein and amino acid composition from the mantle ofjuveniles (Cuvier, 1797) exposed to prolonged starvation. Journal of Coastal Conservation, 2012, 16(4): 555–566
Garrido D, Navarro JC, Perales-Raya C,. Fatty acid composition and age estimation of wild, paralarvae. Aquaculture, 2016, 464: 564–569
Garrido D, Varó I, Morales AE,. Assessment of stress and nutritional biomarkers in cultured, paralarvae: Effects of geographical origin and dietary regime. Aquaculture, 2017, 468(1): 558–568
He T, Xiao ZZ, Liu QH,. Allometric growth in rock bream larvae (Temminck et Schlegel 1844). Journal of Fisheries of China, 2012, 36(8): 1242–1248 [何滔,肖志忠, 刘清华, 等. 条石鲷早期发育阶段的生长模式. 水产学报, 2012, 36(8): 1242–1248]
Iglesias J, Fuentes L, Villanueva R. Cephalopod culture. Springer Netherlands, 2014, 427–450
Iglesias J, Otero JJ, Moxica C,. The completed life cycle of the Octopus (, Cuvier) under culture conditions: Paralarval rearing usingand Zoeae, and first data on juvenile growth up to 8 months of age. Aquaculture International, 2004, 12(4–5): 481–487
Iglesias J, Sánchez FJ, Bersano JGF,. Rearing ofs, paralarvae: Present status, bottlenecks and trends. Aquaculture, 2007, 266(1): 1–15
Lei SH, Zhang XM, Zhang PD,. Early development of golden cuttlefish. Journal of Fishery Sciences of China, 2014 , 21(1): 37–43 [雷舒涵, 张秀梅, 张沛东, 等. 金乌贼的早期生长发育特征. 中国水产科学, 2014, 21(1): 37–43]
Li D, Liu CL, Li A,. Principal component analysis of the morphometric traits of the cuttlebone ofat early developmental stages. Progress in Fishery Sciences, 2017, 38(5): 41–49 [李达, 刘长琳, 李昂, 等. 金乌贼()早期发育阶段内壳形态学指标的主成分分析. 渔业科学进展, 2017, 38(5): 41–49]
Li LB, Zhong JX, Ning Y,. Effects of diets on growth and survival rates ofparalarvae. Journal of Fujian Fisheries, 2012, 34(4): 326–330 [李雷斌, 钟建兴, 宁岳, 等. 不同饵料对真蛸浮游幼体生长和存活的影响.福建水产, 2012, 34(4): 326–330]
Liao YY, Gao FY, Zhang JJ. The research and aquaculture of octopus that distribution in China. Journal of Aquaculture, 2006, 27(5): 11–15 [廖永岩, 高凤英, 张聚杰. 中国产章鱼的研究和增养殖. 水产养殖, 2006, 27(5): 11–15]
Lin GQ, Huang J, Hu RC,. Preliminary experiment on artificial propagation of. Journal of Fujian Fisheries, 2008(3): 16–20 [林国清, 黄健, 胡荣炊, 等. 真蛸人工繁殖初步试验. 福建水产, 2008(3): 16–20]
Mangold K, von Boletzky S. New data on reproductive biology and growth of. Marine Biology, 1973, 19(1): 7–12
Moguel C, Mascaró M, Avila-Poveda OH,. Morphological, physiological, and behavioral changes during post-hatching development of(Mollusca: Cephalopoda) with special focus on the digestive system. Aquatic Biology, 2010, 9(1): 35–48
Nande M, Iglesias J, Domingues P,. Effect of temperature on energetic demands during the last stages of embryonic development and early life of(Cuvier, 1797) paralarvae. Aquaculture Research, 2017, 48(4): 1951– 1961
Navarro JC, Villanueva R. The fatty acid composition ofparalarvae reared with live and inert food: Deviation from their natural fatty acid profile. Aquaculture, 2003, 219(1–4): 613–631
Navarro JC, Villanueva R. Lipid and fatty acid composition of early stages of cephalopods: An approach to their lipid requirements. Aquaculture, 2000, 183(1–2): 161–177
Nixon M, Mangold K. The early life of(Cephalopoda: Octopodidae) in the plankton and at settlement: A change in lifestyle. Journal of Zoology, 1996, 239(2): 301–327
Roo J, Estefanell J, Betancor MB,. Effects of supplementation of decapod zoea to Artemia basal diet on fatty acid composition and digestive gland histology in common octopus () paralarvae. Aquaculture Research, 2017, 48(2): 633–645
Seixas P, Otero A, Valente LMP,. Growth and fatty acid composition of, paralarvae fed with enriched Artemia, or co-fed with an inert diet. Aquaculture International, 2010a, 18(6): 1121–1135
Seixas P, Rey-Méndez M, Valente LMP,. High DHA content in Artemia is ineffective to improveparalarvae rearing. Aquaculture, 2010b, 300(1–4): 156–162
Takeuchi T. Nutritional studies on improvement of health and quality of marine aquatic animals larvae. Nippon Suisan Gakkaishi, 2009, 75(4): 623–635
Vidal EAG, DiMarco FP, Wormuth JH,. Influence of temperature and food availability on survival, growth and yolk utilization in hatchling squid. Bulletin of Marine Science, 2002, 71(2): 915–931
Vidal EAG, Roberts MJ, Martins RS. Yolk utilization, metabolism and growth in reared,reynaudii paralarvae. Aquatic Living Resources, 2005, 18(4): 385–393
Wang WJ, Dong G, Li HJ,. Feeding behavior of larvaland the effect of different diets on its growth and survival. Progress in Fishery Sciences, 2017, 38(6): 100–106 [王卫军, 董根, 李焕军, 等. 短蛸()幼体摄食行为和不同饵料对其生长、存活的影响. 渔业科学进展, 2017, 38(6): 100–106]
Young R, Harman RF. Larva, paralarva and subadult in cephalopod terminology. Malacologia, 1988, 29(1): 201– 207
Zheng XD, Liu ZS, Zhao N,. Embryonic development and paralarval growth of. Oceanologia et Limnologia Sinica, 2011, 42(2): 317–323[郑小东, 刘兆胜, 赵娜, 等. 真蛸()胚胎发育及浮游期幼体生长研究. 海洋与湖沼, 2011, 42(2): 317–323]
Morphology, Growth and Development in the Early Life of
XU Dafeng1,2, LIU Yongsheng3, CHANG Qing1,4, CHEN Siqing1,4①, ZHAO Jiejie1,2, BIAN Li1,4, GE Jianlong1,4, LIU Changlin1,4
(1. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071; 2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306; 3. Fisheries Research Institute of Yantai, Yantai 264000; 4. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071)
To explore the growth and development patterns during the early life period of, the morphological characteristics of larva, juvenile, and youngunder industrialized breeding conditions were observed and recorded. From hatching to 49 days of age, eight larvae were sampled randomly every two days, and total length, arm length, mantle length, mantle width, body weight, and sucker number in the longest arm were measured. In conditions of water salinity of 30~32 and 18.6℃~26.0℃, the average full length of the newly hatched larva was (3.05±0.11) mm; the yolk sac of newly hatched larvae was absorbed by the larvae themselves before hatching or within 9 hours after hatching; the 1-day-old larva just began to feed and the 17-day-old larva could feed on shrimp; at the age of 35 days, the larvae were ready for benthonic living; the body color of 60-day-old larva changed from transparent to milky white; at the age of 80 days, the body color of the larva is the same as that of the adult; the organs of 100-day-old larva were mature except for the gonads, and the morphological characteristics were consistent with those of the adult. The results showed thatlarva (1~49 days of age) body weight exhibited a cubic function growth relationship with total length, represented by the equation:=5×10–53–0.00092+0.0072–0.0132; total length exhibited a linear growth relationship with arm length, represented by the equation:=–0.00123+0.04922+0.0243+0.2179;total length, body weight,arm length, mantle length, and mantle width exhibited a cubic function growth relationship with days respectively, with the regression equations:=–0.00013+0.01052–0.0122+3.0562,=–2×10–73+4× 10–52–0.0004+0.0034,=–0.00043+0.02472–0.1037+0.8214,=–0.00043+0.01242+0.0749+1.4757, and=–3×10–53+0.00252+0.0354+1.4026. We divided the early period ofinto four developmental stages: Larvae octopus, juvenile paralarvae octopus, juvenile benthonic octopus, and young octopus. Each stage was determined by feeding style (endogenous or exogenous), morphological and biological characteristics, and ratio between arm lengths and mantle length.
; Early life development; Morphological characteristics; Growth
CHEN Siqing, E-mail: chensq@ysfri.ac.cn
* 现代农业产业技术体系建设专项资金(CARS-49)和烟台市科技计划项目(2014NC049)共同资助 [This work was supported by the Earmarked Fund of China Aquaculture Research System(CARS-49), and Science and Technology Development Plan of Yantai(2014NC049)]. 徐大凤,E-mail: xudafengqq@163.com
陈四清,研究员,E-mail: chensq@ysfri.ac.cn
2018-07-26,
2018-08-15
S917.4
A
2095-9869(2019)05-0145-10
10.19663/j.issn2095-9869.20180726001
http://www.yykxjz.cn/
徐大凤, 刘永胜, 常青, 陈四清, 赵捷杰, 边力, 葛建龙, 刘长琳. 真蛸早期发育形态特征及生长规律研究. 渔业科学进展, 2019, 40(5): 145–154
Xu DF, Liu YS, Chang Q, Chen SQ, Zhao JJ, Bian L, Ge JL, Liu CL. Morphology, growth and development in the early life of. Progress in Fishery Sciences, 2019, 40(5): 145–154
(编辑 马璀艳)
