草鱼jam-a分子在胚胎幼鱼期及受GCRV感染PSF细胞的表达分析*
2019-09-27田园园焦真真孙成飞董浚键江小燕
田园园 焦真真 孙成飞 董浚键 江小燕 胡 婕 叶 星
草鱼分子在胚胎幼鱼期及受GCRV感染PSF细胞的表达分析*
田园园 焦真真 孙成飞 董浚键 江小燕 胡 婕 叶 星①
(中国水产科学研究院珠江水产研究所 农业农村部热带亚热带水产资源利用与养殖重点实验室 广州 510380)
草鱼呼肠孤病毒(Grass carp reovirus, GCRV)可引发草鱼()出血病,导致高死亡率。草鱼吻端成纤维细胞(Grass carp snout fibroblast cells, PSF)是GCRV的敏感细胞系。JAM-A (Junctional adhesion molecule A)为免疫球蛋白超家族成员,是多种病毒的细胞受体。本研究在前期克隆到草鱼3种基因,命名为1,2和3。在获取ORF序列的基础上,利用qRT-PCR分析了3种在草鱼胚胎及幼鱼不同发育时期及PSF细胞中受GCRV(GD108株)感染前后的表达模式。结果显示,检测的13个胚胎及幼鱼发育时期中,1在未受精卵中高表达,在受精卵至出膜前的胚胎表达水平均较低;从出膜后1~3 d表达量开始上升;出膜6~15 d均呈高水平表达。2与3在草鱼胚胎及幼鱼发育各阶段表达水平较低。在无病毒感染的PSF细胞中,只有少量表达。受GCRV-GD108感染后,病毒基因在PSF细胞中的拷贝数随时间呈显著上调趋势,的表达量也有不同程度的上调,mRNA上调水平为1>2>3。本研究证实了3种基因在PSF细胞中的表达均与GCRV-GD108感染相关,其中,1的表达水平受GCRV-GD108感染影响最大,同时,它在孵化出膜后表达上升,推测它可能与病毒的感染更相关。1可作为下一步GCRV与宿主互作研究中的候选分子。
草鱼吻端成纤维细胞;GCRV;;qRT-PCR;胚胎及幼鱼发育;病毒受体
草鱼()是全国最大宗的淡水养殖品种,2016年产量达589.88万t,约占淡水养殖鱼产量18.55% (王莎, 2017),是我国水产科学研究的重要对象(赵睿等, 2016; 曾本和等, 2017)。草鱼养殖期间尤其是鱼种阶段易暴发出血病,导致高死亡率,给草鱼养殖业造成巨大损失。1983年,我国首次报道引起草鱼出血病的主要病原为草鱼呼肠孤病毒(Grass carp reovirus, GCRV)。GCRV属于呼肠孤病毒科(Reoviridae)、水生呼肠孤病毒属(),代表株为GCRV873。GCRV被认为是水生呼肠孤病毒中致病力最强的一个毒株(Rangel, 1999)。近年,本实验室在广东地区养殖草鱼病鱼体中分离到的出血病致病原GCRV-GD108株,与GCRV873分子水平上具有显著差异,与正呼肠孤病毒属()病毒具有较近的进化关系(Ye, 2012)。随着越来越多GCRV毒株被分离并报道,根据基因组序列差异将它们分成GCRVⅠ、Ⅱ、Ⅲ3个型,GCRV-GD108被认为是Ⅱ型的代表株(Zhang, 2017; Pei, 2014)。对广东、福建、湖南、江苏等地的草鱼病毒流行株检测结果显示,它们均具有与GCRV-GD108相似的分子特征,提示GCRV-GD108株在南方流行株中具有代表性(迟妍妍等, 2011)。病毒感染的第一步是侵入宿主细胞,目前对GCRV入侵宿主机制的研究甚少,因此,深入研究GCRV-GD108的入侵及感染机制,明确其细胞受体,可为草鱼出血病的治疗和预防药物的研发提供科学依据。
JAM-A(Junctional adhesion molecule-A)为免疫球蛋白超家族的成员,是由突出于细胞表面的N端免疫球蛋白样结构域连接形成的同源二聚体,属于紧密连接(Tight junction, TJ)分子的一种(Severson, 2009)。哺乳动物中,JAM-A参与一系列生理及病理活动,包括细胞极性(Rehder, 2006)、炎症反应(Vetrano, 2008)、血脑屏障(Yeung, 2008)、白血球迁移(Bradfield, 2007)、血管再生(Zhao, 2017)等,并与浸润及转移癌密切相关(Kurose, 2016)。在鱼类中JAM-A的报道较少,斑马鱼()中的研究发现,JAM-A在造血干细胞分化及肌肉发育中起重要作用(Kobayashi, 2014),红鼓鱼()中的研究表明,JAM-A可能是胞内菌免疫逃逸的靶位点(Zhang, 2014)。某些病毒可利用宿主细胞紧密连接的不同组件以完成其感染周期,目前已经证实,JAM-A是哺乳动物呼肠孤病毒(Mammalian reovirus, MRV) (Guglielmi, 2007)、猫杯状病毒(Feline calicivirus) (Makino, 2006)以及轮状病毒(Rotaviruses) (Torres-Flores, 2015)的受体。Du等(2013)首次在草鱼中克隆到基因全长,并推测JAM-A可能是GCRV的受体分子。Zhang等(2017)进一步利用蛋白质组学及生物信息学方法分析蛋白之间基序-结构域互作(Motif-domain interactions),预测JAM-A与GCRV fiber蛋白的基序互相作用,并发现其互作类似于MRV与JAM-A的作用模式。
本课题组前期研究在草鱼组织中克隆到3种JAM-A cDNA,分别命名为1,2,3,编码294~295个氨基酸多肽,其推演氨基酸序列相似性为93%~97%,均具有2个JAM-A典型的免疫球蛋白Ig结构域(田园园等, 2017)。在此基础上,本研究利用qRT-PCR分析了3种在草鱼胚胎不同发育时期的表达模式,以及GCRV-GD108感染前后在病毒敏感株PSF细胞中的表达模式,为进一步明确GCRVⅡ型受体提供依据。
1 材料与方法
1.1 病毒及细胞
细胞培养:草鱼吻端成纤维细胞(PSF)在75 cm2培养瓶中培养,培养温度为28℃左右,经2~3 d即可长成致密单层贴壁细胞。
GCRV-GD108组织病毒液的制备和保存:实验室保存的毒价104.87LD50/ml的GCRV-GD108病毒液按照1︰10用生理盐水稀释,腹腔注射攻毒2月龄草鱼(体长约为10 cm, 体重为10~15 g),观察2周。发病草鱼肌肉、肠道、口腔、下颌、鳃盖充血,体表发黑,7 d后开始死亡。收集发病草鱼,取鳃、肝、肠、肾等充血组织约0.1 g,加入1 ml冷生理盐水充分匀浆,于4℃ 12000 r/min离心30 min,取上清液,经0.22 μm滤膜过滤后,保存于-70℃冰箱。
1.2 草鱼胚胎及幼鱼
实验用草鱼胚胎取自广东省佛山百容水产良种有限公司。取源自同一对草鱼亲本的受精卵,显微镜下观察其胚胎发育时期,分别取未受精卵、受精卵、囊胚期、神经胚期、尾芽期、肌肉效应期、心脏出现期、出膜期、出膜后第2、3、6、10、15天共13个时期的胚胎和幼鱼,出膜前各期样品10枚卵/组,出膜后幼鱼4尾/组,每个时期各3组。
1.3 qRT-PCR分析胚胎发育时期gcjam-a表达模式
草鱼胚胎发育各时期的样品置于离心管中,经Trizol快速润洗后,再加入1 ml Trizol (Invitrogen, 美国),匀浆后保存于‒70℃。收集各发育时期的胚胎后,按照Trizol说明书提取RNA。总RNA用DNaseⅠ(TaKaRa, 大连)去除基因组DNA。利用分光光度计Biophotometer (Eppendorf, 德国)及琼脂糖凝胶电泳检测RNA浓度及纯度。使用反转录试剂盒First- Strand cDNA Synthesis SuperMix for qPCR (全式金, 北京)合成cDNA,反应体系如下:总RNA 100 ng,5×Transcript All-in-One Super Mix 4 µl,gDNA Remover 1 µl,RNase-free H2O补至20 µl。反应程序:42℃ 15 min;85℃酶灭活 5 s;-20℃保存。所有反转录反应均为2个重复。
设计引物扩增3种特异片段(qRT- primerA1, A2, A3, 表1),18S作为内参基因(定量引物18S, 表1)。利用草鱼组织cDNA为模板,PCR扩增目的片段,经胶回收、纯化后连入pEASY-Blunt Zero克隆载体(全式金, 北京)进行测序,确认插入正确。纯化质粒经Biophotometer浓度检测后,进行梯度稀释制作标准品,用于标准曲线的构建(田园园等, 2017)。
表1 用于草鱼、GCRV-GD108基因扩增及qRT-PCR的引物

Tab.1 Primers of gcjam-a and GCRV-GD108 S7 used in PCR and qRT-PCR
qRT-PCR按以下步骤进行:根据TransStart Tip Green qPCR SuperMix(全式金,北京)说明书设置反应体系:cDNA模板1 µl,上、下游引物(10 µmol/L)各0.4 µl,2´Super Mix 10 µl,Passive Reference DyeⅠ(50´) 0.4 µl,ddH2O 8.8 µl。扩增时设置3个重复,循环体系如下:94℃ 30 s;40个循环:94℃5 s,60℃30 s。溶解曲线:95℃ 15 s;60℃ 1 min;95℃ 15 s;60℃ 15 s。每个实验样本重复3次,所有样本都与管家基因18S一同运行,所有标准曲线的相关系数值均大于0.998,相应的实时PCR效率为0.90~ 1.10。mRNA表达量用双标准曲线相对定量法计算,用归一化值表示,归一化值=目的基因浓度均值/内参基因浓度均值,用归一化值±标准误(SE)的形式表示,采用SPSS 20.0软件进行单因素方差分析(One-way ANOVA)。利用Origin 6.0对统计结果进行作图。
1.4 qRT-PCR分析GCRV-GD108在PSF细胞中的增殖
GCRV-GD108感染PSF细胞,具体步骤如下:25 cm2细胞培养瓶(Corning, 美国)中培养的PSF细胞密度约为15.3×104个/ml时,倒去培养液,用3 ml PBS洗涤2次,加入1 ml胰酶(Difco, 美国)消化,前后摇匀。细胞脱落后,将细胞吹打均匀,以1∶500体积比将组织病毒液加入15 ml无血清的M199细胞培养液(Gibco, 美国)中,均分装于3个25 cm2细胞培养瓶中,28℃吸附45 min后倒掉病毒液,每瓶加入5 ml含8%犊牛血清(Gibco, 美国)的细胞培养液,28℃培养。
PSF细胞总RNA提取步骤如下:每24 h取3瓶PSF细胞弃培养液,连续取8 d。分别用3 ml预冷PBS洗2次,然后分别加入1 ml Trizol裂解,保存于-70℃。按照Trizol说明书提取RNA。总RNA用DNaseⅠ去除基因组DNA并检测其浓度及纯度。使用反转录试剂盒First-Strand cDNA Synthesis Super Mix for qPCR (全式金, 北京)合成cDNA,反应体系如下:细胞总RNA 100 ng,5×Transcript All-in-One Super Mix 4 µl,gDNA Remover 1 µl,RNase-free H2O补至20 µl。反应程序:42℃ 15 min;85℃酶灭活5 s;-20℃保存。所有反转录反应均为2个重复。
利用qRT-PCR引物(表1),保存的全长克隆载体为模板对进行PCR扩增目的片段,经胶回收、纯化后连入pEASY-Blunt Zero克隆载体进行测序确认插入正确。纯化质粒经Biophotometer浓度检测后,进行梯度稀释制作标准品用于标准曲线的构建。采用绝对定量法检测细胞中病毒表达量。
根据TransStart Tip Green qPCR SuperMix说明书设置反应体系:上述cDNA模板1 µl,上、下游引物(10 mmol/L)各0.4 µl,2´Super Mix 10 µl,Passive Reference Dye Ⅰ(50´) 0.4 µl,ddH2O 7.8 µl。扩增时设置3个重复,循环体系如下:94℃ 30 s;40个循环:94℃ 5 s,60℃ 30 s。溶解曲线:95℃ 15 s,60℃ 1 min,95℃ 15 s,60℃ 15 s。每个实验样本重复3次,所有标准曲线的相关系数值均大于0.998,相应的实时PCR效率为0.90~1.10。表达量以均值±标准误(SE)的形式表示,采用SPSS 20.0软件进行单因素方差分析(One-way ANOVA),利用Origin 6.0对统计结果进行作图。
1.5 qRT-PCR分析GCRV-GD108感染前后gcjam-a表达模式
提取病毒感染前后PSF细胞总RNA做模板进行反转录,参照1.3所述,利用特异引物(qRT- primerA1, A2, A3, 表1),根据TransStart Tip Green qPCR SuperMix (全式金)说明书设置反应体系进行qRT-PCR反应,18S作为内参基因(定量引物18S, 表1)。qRT-PCR反应体系及数据处理参照1.3。
2 结果
2.1 gcjam-a胚胎幼鱼期表达模式分析
利用qRT-PCR对3种在草鱼胚胎不同发育时期及幼鱼期的表达量进行检测,其中,包括未受精卵、受精卵、囊胚期、心脏出现期等至出膜第15天共13个发育阶段。结果显示,1在未受精卵中的表达水平最高;受精卵至孵化出膜前的幼鱼表达水平均较低;从出膜后1~3 d表达量开始上升,出膜6~15 d均呈现高表达水平。2与3的结果相似,与1相比在草鱼胚胎发育时期为极低水平表达(图1)。
2.2 GCRV-GD108在PSF细胞中的增殖
病毒感染后,草鱼PSF细胞中的表达量出现显著变化,具体表现为感染后的第3天开始出现上升趋势,第5天出现显著上升,到第8天达到最大值(为第1天的432倍) (图2)。
2.3 GCRV-GD108感染PSF细胞前后gcjam-a的表达变化
在无感染的PSF细胞中,3种mRNA只有少量表达,维持在较低水平,其中,2表达水平高于其他2个分子(图3)。GCRV-GD108感染PSF细胞后,3种在细胞中的表达量呈现不同程度的上调趋势(图3)。各基因mRNA上调水平(表达量变化)为1>2>3。1表达量在病毒感染后第3天开始上升,第7天达到最大值(为感染第1天的3329倍),第8天有下降趋势,但仍维持在较高水平;2的表达量自感染后第3天开始出现上升趋势,第6天开始上升幅度变大,第7天时呈下降趋势,在第8天时达到最大值(为感染第1天的784倍);3自病毒感染后3 d开始出现表达上调,从第4天开始上升幅度变大,在6 d时达到最大值(为感染第1天的47倍)。
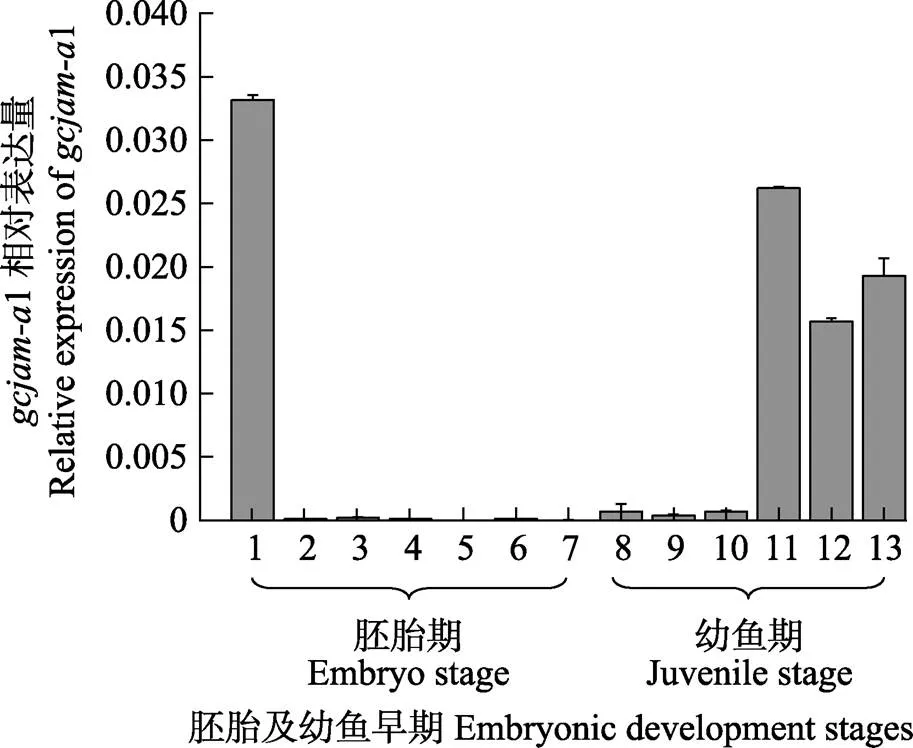
图1 qRT-PCR分析gcjam-a1在草鱼胚胎发育各时期及早期幼鱼期中的相对表达量
1~13分别代表未受精卵、受精卵、囊胚期、神经胚期、尾芽期、肌肉效应期、心脏出现期、出膜期、出膜第2、3、6、10、15天13个时期。mRNA表达量用双标准曲线相对定量法计算,用归一化值表示,归一化值=目的基因浓度均值/内参基因浓度均值,用归一化值±标准误(SE)的形式表示
1~13 represent unfertilized egg, fertilized egg, gastrula stage, nerve embryonic stage, tail bud stage, muscle effecting phase, heart beating phase, hatching phase, 2 days post hatching (dph), 3 dph, 6 dph, 10 dph, and 15 dph, respectively. mRNA relative expression values were calculated by the relative quantification method using double standard curve, and results were showed as normalized values, normalized value=mean value of target gene concentration/mean value of internal reference gene, showed as normalized value±standard error (SE)
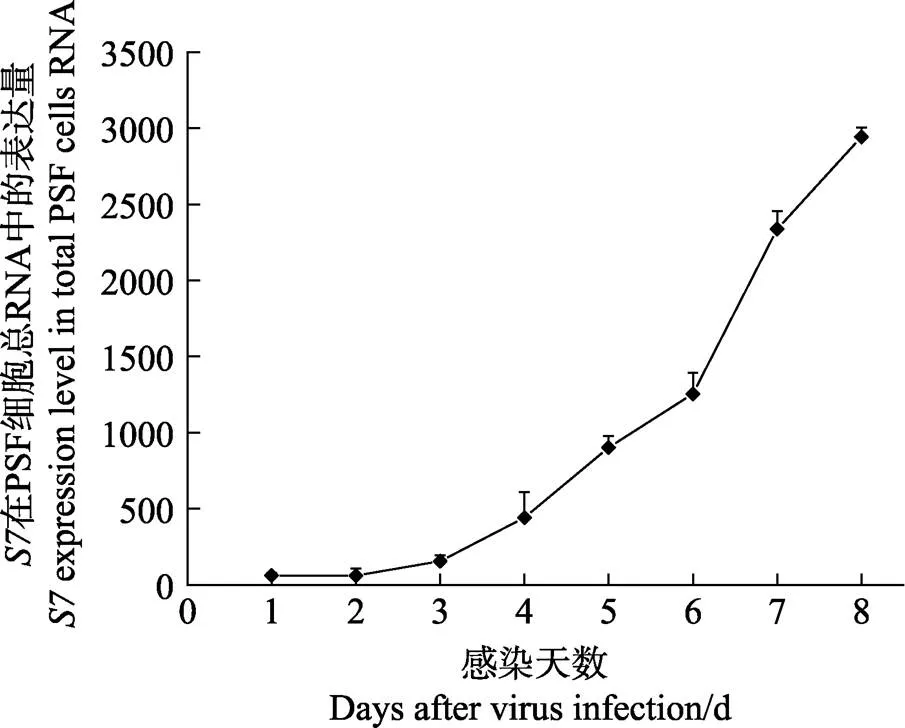
图2 qRT-PCR分析GCRV-GD108 S7在病毒感染PSF细胞中的表达量(平均值±标准误差)
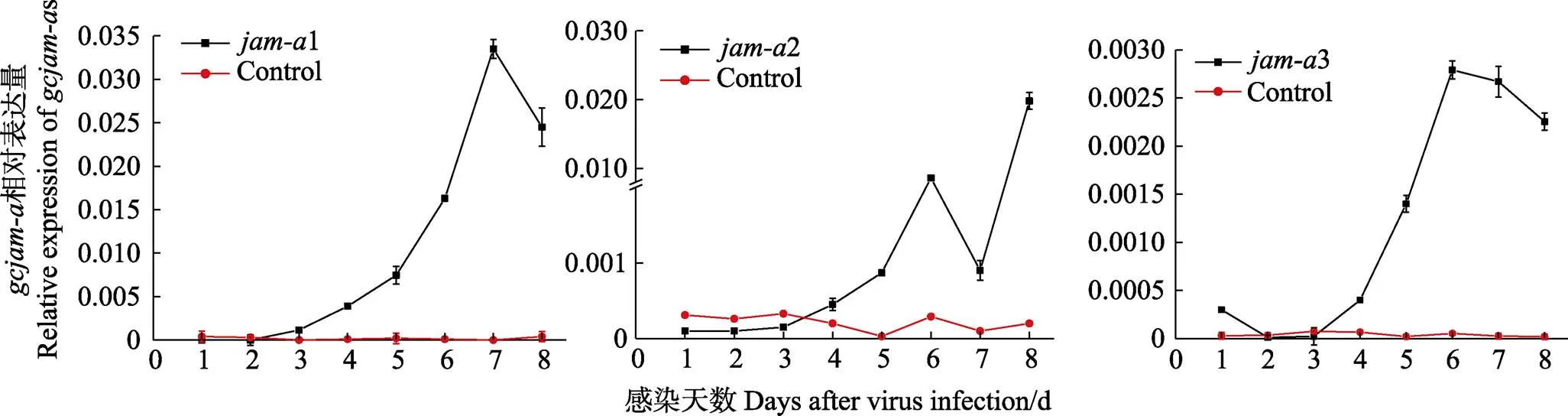
图3 qPCR分析gcjam-a在细胞中的表达情况(归一化值±标准误差)
3 讨论
病毒感染宿主需要经过一个完整的复制周期,包括病毒的吸附、穿入细胞内、脱壳、生物合成、病毒颗粒装配、释放等过程(Schulz, 2012)。细胞表面受体在病毒吸附和侵入细胞时能特异性的与病毒表面衣壳蛋白结合,是病毒入侵的首要步骤,也被认为是病毒宿主范围的一个决定因素。有囊膜的病毒如人体免疫缺损病毒(艾滋病毒HIV)(Bartesaghi, 2013)、流感病毒(Influenza virus)(Skehel, 2000)等,其通过膜融合入侵宿主的机制已得到深入研究。在侵染过程中,病毒的磷脂双分子层跟细胞膜融合,从而经过内吞作用入膜(Harrison, 2015)。无囊膜病毒中哺乳动物呼肠孤病毒MRV入侵宿主机制已有较为详尽的研究(Banerjee, 2008)。MRV的outer-fiber蛋白σ1蛋白呈高度伸展的构型,以带有头尾的长纤维状突出于病毒粒子表面,在病毒感染时结合宿主细胞(Danthi, 2010)。细胞表面受体JAM-A由突出于细胞表面的N端免疫球蛋白样结构域连接形成同源二聚体结构,病毒感染入膜时σ1破坏JAM-A二聚物,并与其中一个JAM-A分子连接,随后细胞β1整合素介导病毒发生内吞作用,接着病毒的核心颗粒进入细胞质中(Kirchner, 2008)。JAM-A二聚体的解体、σ1与JAM-A单体的连接是哺乳动物正呼肠孤病毒感染开始的观点已被普遍接受(Danthi, 2013)。进一步的研究发现,JAM-A对病毒的血行性传播起决定作用(Antar, 2009)。
水生呼肠孤病毒与正呼肠孤病毒亲缘关系较近,蛋白序列间有较高的同源性,有9个同源蛋白,在结构上也具有相似性(Kim, 2004; Nibert, 2013)。根据基因组序列分析,GCRV-GD108与其他已知水生呼肠孤病毒相比,与MRV进化关系上更近(Ye, 2012),在前期研究中,通过中和实验与细胞结合实验证实GCRV-GD108编码的σ1同源蛋白fiber可与PSF细胞稳定结合,是病毒的细胞吸附蛋白(Tian, 2017)。并从草鱼中克隆到1,2,3 cDNA序列,3个的跨膜结构域D2序列完全一致,而病毒结合结构域D1序列则稍有差别,其中,3与Du等(2013)报道的草鱼JAM-A序列相同。qRT-PCR分析显示,草鱼幼鱼受病毒感染后,3种mRNA在草鱼鳃组织中的表达均出现显著上调,而在肝脏、脾脏、肠、肾与脑中只有1的表达有不同程度的上调,说明1与病毒感染关系更密切(田园园等, 2017)。
本研究发现,1在未受精卵中有较高表达,但在受精卵至心脏效应期表达水平较低;出膜第1~3天的幼鱼表达开始上调,第6~15天呈现高水平表达。其他2个在受精卵及检测的胚胎发育阶段及幼鱼期的表达量均较低。本研究1在胚胎发育时期及幼鱼的表达趋势与Du等(2013)的研究相似。Du等(2013)研究发现,在未受精卵中表达,受精后48 h内表达逐渐下调,受精后56 h表达水平又开始升高,表现出母源性表达。斑马鱼在未受精卵中无表达,受精14 h后在侧中胚层后部两侧表达,这个部位将发育成内皮织及造血系统(Kobayashi, 2014)。对小鼠JAM-A在胚胎发育时期的表达分析显示,小鼠JAM-A也是在受精后才开始表达(Aurrand- Lions, 2001)。
草鱼吻端成纤维细胞是GCRV的敏感株,李焕林等(1988)建立了草鱼吻端成纤维细胞系,许淑英等(1994)利用该敏感细胞系使用离体细胞培养法制备GCHV-841株弱毒疫苗,其免疫保护性高达100%。在对草鱼出血病病原学、流行病学以及免疫学的研究过程中,研究人员建立了多株草鱼细胞系,如草鱼肾细胞系和草鱼性腺细胞系等(王津津等, 2016)。李贤等(2016)利用GCRV HZ08株接种PSF细胞发现,与其他几种细胞系相比,GCRVⅡ在PSF中增殖量较其他草鱼细胞系大。GCRV-GD108感染PSF细胞发现,不产生细胞病变效应(Ye, 2012),可能是因为GCRVⅡ型缺少其他水生呼肠孤病毒如GCRVⅠ型中的“FAST”蛋白(Fusion-associated small transmembrane protein),不能使被感染细胞形成合胞体从而产生细胞病变效应(Nibert, 2013),因此,增加了对病毒增殖观察的难度。本研究通过检测GCRV-GD108基因的表达量以了解病毒在PSF的增殖情况。
GCRV-GD108感染草鱼PSF细胞后,病毒基因的拷贝数即病毒的增殖量随时间呈显著上调趋势,到感染后第8天达到最大值。PSF细胞感染病毒后,3种的表达量随病毒增殖均有不同程度的上调趋势,但其上升水平存在差异,1的表达量升幅最高,表明PSF细胞中3种表达均与病毒的感染相关,但1受病毒感染影响更大。这与病毒攻毒后在草鱼幼鱼鳃等组织中的表达量变化结果一致,说明1与病毒感染关系更紧密。在本研究基础上,已经构建了3种的真核表达载体以及RNAi载体,拟进一步在细胞水平上了解与GCRV-GD108感染的相关性。
本研究采用qRT-PCR检测3种在草鱼胚胎发育期及幼鱼期以及在PSF细胞中的表达水平,结果表明,3种随病毒的感染呈现不同程度的上调表达,证实它们与病毒感染密切相关。其中,1在草鱼中呈母源性表达,在草鱼幼鱼组织和PSF细胞中的表达量均高于2和3,并且其在PSF细胞中的表达受病毒感染影响最大,因此,推测1与GCRV-GD108感染关系更密切。本研究为进一步研究GCRV入侵机制提供科学依据,并为草鱼出血病防治提供新靶标和新途径。
Antar AAR, Konopka JL, Campbell JA,. Junctional adhesion molecule-A is required for hematogenous dissemination of reovirus. Cell Host and Microbe, 2009, 5(1): 59–71
Aurrand-Lions M, Johnson-Leger C, Wong C,. Heterogeneity of endothelial junctions is reflected by differential expression and specific subcellular localization of the three JAM family members. Blood, 2001, 98(13): 3699–3707
Banerjee M, Johnson JE. Activation, exposure and penetration of virally encoded, membrane-active polypeptides during non- enveloped virus entry. Current Protein and Peptide Science, 2008, 9(1): 16–27
Bartesaghi A, Merk A, Borgnia MJ,. Prefusion structure of trimeric HIV-1 envelope glycoprotein determined by cryo- electron microscopy. Nature Structural and Molecular Biology, 2013, 20(12): 1352–1357
Bradfield PF, Nourshargh S, Aurrand-Lions M,. JAM family and related proteins in leukocyte migration (Vestweber series). Arteriosclerosis, Thrombosis, and Vascular Biology, 2005, 27(10): 2104–2112
Chi YY, Tian YY, Ye X,. Molecular properties of grass carp reovirus in southern China and establishment of a duplex PCR detection method. Chinese Journal of Virology, 2011, 27(4): 358–364 [迟妍妍, 田园园, 叶星, 等. 南方养殖草鱼呼肠孤病毒的分子特性比较及双重PCR检测方法的建立. 病毒学报, 2011, 27(4): 358–364]
Danthi P, Guglielmi KM, Kirchner E,. From touchdown to transcription: The reovirus cell entry pathway. Cell Entry by Non-Enveloped Viruses, 2010, 343: 91–119
Danthi P, Holm GH, Stehle T,. Reovirus receptors, cell entry, and proapoptotic signaling. Advances in Experimental Medicine and Biology, 2013, 790: 42–71
Du F, Su J, Huang R,. Cloning and preliminary functional studies of the JAM-A gene in grass carp (). Fish and Shellfish Immunology, 2013, 34(6): 1476–1484
Guglielmi KM, Kirchner E, Holm GH,. Reovirus binding determinants in junctional adhesion molecule-A. Journal of Biological Chemistry, 2007, 282(24): 17930–17940
Harrison SC. Viral membrane fusion. Virology, 2015, 479–480: 498–507
Kim J, Tao Y, Reinisch KM,. Orthoreovirus and Aquareoviruscore proteins: Conserved enzymatic surfaces, but not protein-protein interfaces. Virus Research, 2004, 101(1): 15–28
Kirchner E, Guglielmi KM, Strauss HM,. Structure of reovirus sigma1 in complex with its receptor junctional adhesion molecule-A. PLoS Pathogens, 2008, 4(12): e1000235
Kobayashi I, Kobayashi-Sun J, Kim AD,. Jam1a-Jam2a interactions regulate haematopoietic stem cell fate through Notch signalling. Nature, 2014, 512(7514): 319–323
Kurose M, Kakuki T, Takano K,. Junctional adhesion molecule-A in head and neck squamous cell Carcinoma. Advances in Oto-Rhino-Laryngology, 2016, 77: 92–97
Li HL, Xu SY, Deng GC,. Establishment of cell line PSF from the fibroblast cell of grass carp snout tissue and studies of its biological characteristics. Journal of Chinese Academy of Fishery Sciences, 1988, 1(1): 1–8 [李焕林, 许淑英, 邓国成, 等. 草鱼吻端成纤维细胞系PSF的建立及其生物学特性. 中国水产科学研究院学报, 1988, 1(1): 1–8]
Li X, Zeng WW, Wang Q,. The study on the proliferation of GCRVⅡ in different fish cell lines. Journal of Fisheries of China, 2016, 40(8): 1249–1257 [李贤, 曾伟伟, 王庆, 等. 草鱼呼肠孤病毒Ⅱ型在不同鱼类细胞中的增殖情况. 水产学报, 2016, 40(8): 1249–1257]
Makino A, Shimojima M, Miyazawa T,. Junctional adhesion molecule 1 is a functional receptor for feline calicivirus. Journal of Virology, 2006, 80(9): 4482–4490
Nibert ML, Duncan R. Bioinformatics of recent aqua- and orthoreovirus isolates from fish: Evolutionary gain or loss of FAST and fiber proteins and taxonomic implications. PLoS One, 2013, 8(7): e68607
Pei C, Ke F, Chen ZY,. Complete genome sequence and comparative analysis of grass carp reovirus strain 109 (GCReV-109) with other grass carp reovirus strains reveals no significant correlation with regional distribution. Archives of Virology, 2014, 159(9): 2435–2440
Rangel AA, Rockemann DD, Hetrick FM,. Identification of grass carp haemorrhage virus as a new genogroup of aquareovirus. Journal of General Virology, 1999, 80 (Pt 9): 2399–2402
Rehder D, Iden S, Nasdala I,. Junctional adhesion molecule-A participates in the formation of apico-basal polarity through different domains. Experimental Cell Research, 2006, 312(17): 3389–3403
Schulz WL, Haj AK, Schiff LA. Reovirus uses multiple endocytic pathways for cell entry. Journal of Virology, 2012, 86(23): 12665–12675
Severson EA, Parkos CA. Structural determinants of junctional adhesion molecule A (JAM-A) function and mechanisms of intracellular signaling. Current Opinion in Cell Biology, 2009, 21(5): 701–707
Skehel JJ, Wiley DC. Receptor binding and membrane fusion in virus entry: The influenza hemagglutinin. Annual Review of Biochemistry, 2000, 69: 531–569
Tian YY, Jiao ZZ, Dong JJ,. Cloning and expression analysis ofgenes in grass carp (). South China Fisheries Science, 2017, 13(6): 30–40 [田园园, 焦真真, 董浚键, 等. 草鱼基因的克隆及表达分析. 南方水产科学, 2017, 13(6): 30–40]
Tian YY, Jiao ZZ, Dong JJ,. Grass carp reovirus-GD108 fiber protein is involved in cell attachment. Virus Genes, 2017, 53(4): 613–622
Torres-Flores JM, Silva-Ayala D, Espinoza MA,. The tight junction protein JAM-A functions as coreceptor for rotavirus entry into MA104 cells. Virology, 2015, 475: 172–178
Vetrano S, Rescigno M, Cera MR,. Unique role of junctional adhesion molecule-a in maintaining mucosal homeostasis in inflammatory bowel disease. Gastroenterology, 2008, 135(1): 173–184
Wang JJ, Liu Y, Yu L,. Characterization of grass carp () ovary cell line and its susceptibility to spring viremia of carp virus. Progress in Fishery Sciences, 2016, 37(6): 56–61 [王津津, 刘莹, 于力, 等. 草鱼()性腺细胞系(GCO)特性和对鲤春病毒的敏感性. 渔业科学进展, 2016, 37(6): 56–61]
Wang S. National fisheries economic statistics bulletin of 2016. China Fisheries, 2017(7): 23–24 [王莎. 2016年全国渔业经济统计公报. 中国水产, 2017(7): 23–24]
Xu SY, Li HL, Deng GC,. The preparation and immune effect of attenuated live vaccine obtained through cell culture for hemorrhage of grass carp. Journal of Fisheries of China, 1994, 18(2): 110–117 [许淑英, 李焕林, 邓国成, 等. 草鱼出血病细胞培养弱毒疫苗的制备及其免疫效果. 水产学报, 1994, 18(2): 110–117]
Ye X, Tian Y, Deng G,. Complete genomic sequence of a reovirus isolated from grass carp in China. Virus Research, 2012, 163(1): 275–283
Yeung D, Manias JL, Stewart DJ,. Decreased junctional adhesion molecule-A expression during blood-brain barrier breakdown. Acta Neuropathologica, 2008, 115(6): 635–642
Zeng BH, Liao ZY, Xiang X,. Effects of bile acids on growth performance, muscle composition and digestive enzyme activities of. Progress in Fishery Sciences, 2017, 38(2): 99–106 [曾本和, 廖增艳, 向枭, 等. 胆汁酸对草鱼()的生长性能、肌肉营养成分及消化酶活性的影响. 渔业科学进展, 2017, 38(2): 99–106]
Zhang A, He L, Wang Y. Prediction of GCRV virus-host protein interactome based on structural motif-domain interactions. BMC Bioinformatics, 2017, 18(1): 145
Zhang J, Zhang M, Sun L. Junctional adhesion molecule A of red drum (): A possible immunomodulator and a target for bacterial immune evasion. Veterinary Immunology and Immunopathology, 2014, 161(1–2): 99– 107
Zhao R, Lou FR, Ding FH,. The nutritional value and processing quality of, Liza haematocheila, and. Progress in Fishery Sciences, 2016, 37(6): 62–67 [赵睿, 娄方瑞, 丁福红, 等. 草鱼()、梭鱼()、黑石斑鱼()的营养成分及加工品质比较. 渔业科学进展, 2016, 37(6): 62–67]
Zhao Z, Vajen T, Karshovska E,. Deletion of junctional adhesion molecule A from platelets increases early-stage neointima formation after wire injury in hyperlipidemic mice. Journal of Cellular and Molecular Medicine, 2017, 21(8): 1523–1531
Expression Analysis ofs in GCRV-infected Grass Carp () PSF Cells and During the Embryo and Juvenile Stages
TIAN Yuanyuan, JIAO Zhenzhen, SUN Chengfei, DONG Junjian, JIANG Xiaoyan, HU Jie, YE Xing①
(Pearl River Fisheries Research Institute, Chinese Academy of Fishery Sciences; Key Laboratory of Tropical & Subtropical Fishery Resource Application & Cultivation, Ministry of Agriculture and Rural Affairs, Guangzhou 510380)
Grass carps are seriously threatened by GCRV (grass carp reovirus) that can cause high mortality to fingerling and yearling grass carps. Grass carp snout fibroblast cells (PSF) are highly sensitive to GCRV. Junctional adhesion molecule A (JAM-A), an immunoglobulin superfamily member, acts as a viral cell receptor. In our previous study, the cDNA sequences of grass carp1,2, and3 (named1,2, and3) were cloned. Based on this, qRT-PCR was used to analyze the expression pattern ofs at different embryonic and juvenile development stages and in GCRV-GD108-infected PSF cells. The results showed that the expression pattern of1, 2, and 3 differed during the embryonic development stages. mRNA expression of1 could be detected in unfertilized eggs and at a lower level from the fertilized egg stage to 1 dph (day post hatch). However, the mRNA was highly expressed at 1~3 dph and high levels were maintained from 3 dph to the end of the experiment (15 dph). The expression of2 and3 was very low at different embryonic development stages compared to that of1.s were only slightly expressed in non-infected PSF cells. After GCRV-GD108 infection, the expression ofin PSF cells increased significantly, and the expression ofs in PSF cells also increased to different levels after GCRV-GD108 infection. Upregulation of thes was in the order:1>2>3. The results showed that the expression ofs was related to GCRV infection in PSF cells and that the expression of1 was mostinfluenced by GCRV-GD108 infection. It is also expressed in early embryonic development, suggesting that1 is the most relevant to GCRV infection. This study will lay the foundation for further research on GCRV receptors.
PSF; GCRV;; qRT-PCR; Embryonic and juvenile development; Viral receptor
YE Xing, E-mail: gzyexing@163.com
* 中国水产科学研究院中央级公益性科研院所基本科研业务费专项资金(2016HY-ZC0602)和广东省省级科技计划项目(2017B090901001)共同资助[This work was supported by Central Public-Interest Scientific Institution Basal Research Fund, CAFS (2016HY-ZC0602), and Science and Technology Planning Project of Guangdong Province, China (2017B090901001)].田园园,E-mail: tianyuan320@163.com
叶 星,研究员,E-mail: gzyexing@163.com
2018-05-21,
2018-08-22
S917.4
A
2095-9869(2019)05-0126-08
10.19663/j.issn2095-9869.20180521001
http://www.yykxjz.cn/
田园园, 焦真真, 孙成飞, 董浚键, 江小燕, 胡婕, 叶星. 草鱼分子在胚胎幼鱼期及受GCRV感染PSF细胞的表达分析. 渔业科学进展, 2019, 40(5): 126–133
Tian YY, Jiao ZZ, Sun CF, Dong JJ, Jiang XY, Hu J, Ye X. Expression analysis ofs in GCRV-infected grass carp () PSF cells and during the embryo and juvenile stages. Progress in Fishery Sciences, 2019, 40(5): 126–133
(编辑 马璀艳)
