海参多糖对肾癌ACHN细胞自噬的影响
2019-09-27周东梅刘一帆江先汉谢清灵黄奕桥殷羽飞
李 天,周东梅,刘一帆,江先汉,谢清灵,黄奕桥,殷羽飞
1)广州医科大学附属第五医院泌尿外科广州510700 2)广州医科大学附属第五医院中医科广州510700
肾癌是泌尿系统中恶性程度较高的肿瘤,也是最常见的肿瘤之一[1]。自噬是真核生物中普遍存在的现象,AKT/mTOR作为自噬的主要信号通路在肿瘤的发生发展过程中起重要作用。研究[2-3]表明,AKT通路的失活导致mTOR失活,并通过诱导自噬促进癌细胞凋亡。海参多糖是从海参中提取的水溶性物质,可以抑制多种肿瘤细胞的增殖、转移,同时也有一定的肿瘤细胞杀伤作用[4-5]。本研究探讨了海参多糖对肾癌细胞增殖标志物(Ki-67、PCNA)、凋亡标志物(Cleaved Caspase-3、Cleaved Caspase-9)、自噬相关蛋白(Beclin1、P62、LC3-Ⅰ/LC3-Ⅱ)、AKT/mTOR通路相关蛋白(PI3K/p-PI3K、AKT/p-AKT、mTOR)表达的影响,现将结果报道如下。
1 材料与方法
1.1 主要试剂与仪器 海参多糖(自制,纯度 >95%),鼠抗人 PI3K、p-PI3K、AKT、p-AKT、GAPDH抗体(美国Santa Cruz公司,使用时PI3K抗体按1∶500稀释,GAPDH 抗体按1∶5 000稀释,其余均按1∶1 000稀释),Annexin V-FITC/PI细胞凋亡检测试剂盒(美国英杰生命技术有限公司);光学显微镜、流式细胞仪(上海碧迪生物科学公司),小型垂直电泳仪及电泳槽、全能型蛋白快速转膜仪(美国伯乐生命医学产品有限公司)。
1.2 细胞及分组 肾癌ACHN细胞系购自中国科学院细胞库,用含体积分数10%胎牛血清和50 mg/L链霉素的RPMI 1640培养基于37℃、体积分数5%CO2的环境下无菌培养。量取溶解于培养液中的海参多糖,用0.22μm微孔滤器过滤,分别将终质量浓度调整为50、100、200 mg/L,置于-20℃冰箱保存待用。将ACHN细胞以每孔4×103个接种在96孔板中并于体积分数5%CO2、37℃下温育12 h,然后分别加入 0(对照)、50、100、200 mg/L 海参多糖100μL培养。
1.3 细胞活力测定 采用 MTT法。24、48、72、96 h后4组细胞吸弃旧培养基并在其中加入含5 g/L MTT的新鲜培养基,37℃温育4 h。然后用二甲基亚砜溶解甲臜,并用分光光度计测量570 nm处的吸光度值,以吸光度值代表细胞活力。实验重复3次。
1.4 细胞球形成实验 将ACHN细胞以每孔1×103个接种在6孔板,按1.2方法分组及处理。48 h后进行结晶紫染色,在200倍光学显微镜下选择2个视野观察细胞形态并计数每个球体中存在的细胞数量,结果取平均值。实验重复3次。
1.5 Ki-67、PCNA、Cleaved Caspase-3、Cleaved Caspase-9、Beclin1、P62、LC3-Ⅰ/LC3-Ⅱ、PI3K/p-PI3K、AKT/p-AKT、m TOR 表达的测定 采用Western blot法。海参多糖处理48 h后,使用RIPA裂解缓冲液从ACHN细胞中提取蛋白质。离心后定量,将40μg总蛋白加样到120 g/L SDS-PAGE凝胶上并转移到PVDF膜上。将膜与封闭缓冲液在含体积分数0.1%Tween-20的TBS中室温孵育2 h。充分洗涤后,将膜与次级过氧化物酶标记的IgG在室温下温育1 h。以目的蛋白与内参GAPDH条带灰度值的比值代表目的蛋白的相对表达量。实验重复3次。
1.6 细胞凋亡率的测定 将ACHN细胞在6 cm培养皿中以约5×105个的密度进行接种。过夜温育后,将胰蛋白酶消化的细胞收集在相同的离心管中。离心和洗涤后,将细胞团粒固定在体积分数70%乙醇中。然后将样品与5μL Annexin V-FITC和5μL PI在25℃黑暗中温育15 min,上流式细胞仪检测细胞凋亡率。实验重复3次。
1.7 AKT蛋白表达的定位 将ACHN细胞在玻璃盖玻片上的12孔板中培养,接种密度为5×105个/mL,并用 0、50、100、200 mg/L 海参多糖处理 24 h。固定细胞样品,滴加AKT一抗,4℃过夜。将细胞与缀合有Cy3的二抗温育30 min,然后在室温下置于含有DAPI的培养基中5 min。用共聚焦激光扫描显微镜进行观察,AKT阳性细胞的细胞质染成红色,用DAPI标记的细胞核显现为蓝色。
1.8 统计学处理 采用SPSS 21.0进行数据分析。各组细胞所有观察指标的比较均采用单因素方差分析,两两比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.1 4组细胞活力的比较 结果见图1。50、100、200 mg/L 海参多糖处理 24、48、72、96 h 后,细胞活力均低于对照组;此外,给药48 h对ACHN细胞的抑制作用最强,故后续实验选择作用时间为48 h。
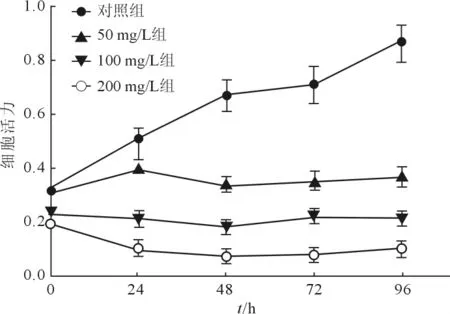
图1 各组ACHN细胞活力比较
2.2 各组细胞生长、凋亡情况及增殖、凋亡标志物表达的比较 Western blot检测 Ki-67、PCNA、Cleaved Caspase-3、Cleaved Caspase-9的表达,结果见图2、图3。各组细胞生长、凋亡情况及增殖、凋亡标志物表达的比较,见表1。

图2 各组ACHN细胞中K i-67、PCNA蛋白的表达

图3 各组ACHN细胞中Cleaved Caspase-3、Cleaved Caspase-9蛋白的表达
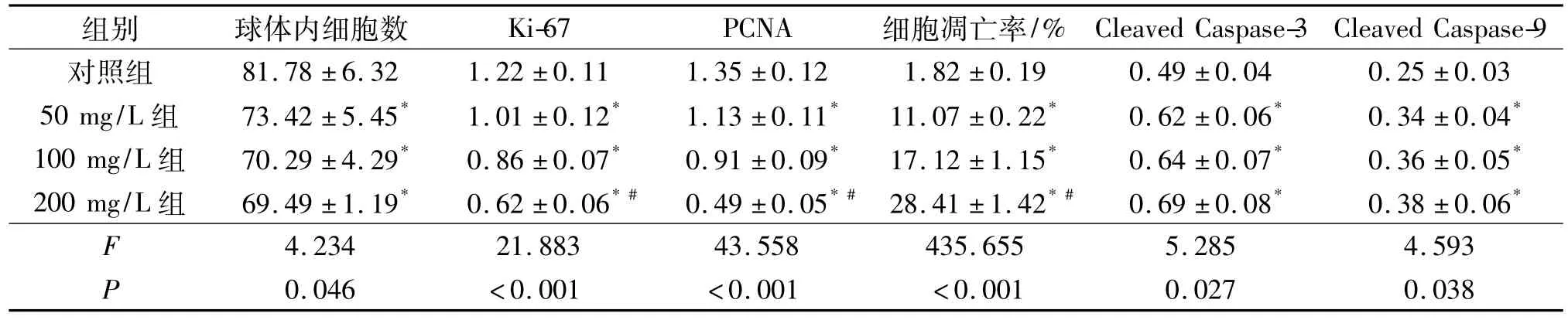
表1 各组细胞生长、凋亡情况及增殖、凋亡标志物表达的比较(n=3)
2.3 各组细胞自噬相关蛋白表达的比较 结果见图4、表2。可知,海参多糖可降低P62蛋白表达,增加Beclin1蛋白表达。
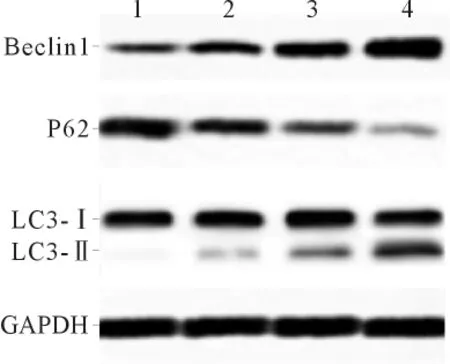
图4 各组ACHN细胞中Beclin1、P62和LC3蛋白的表达
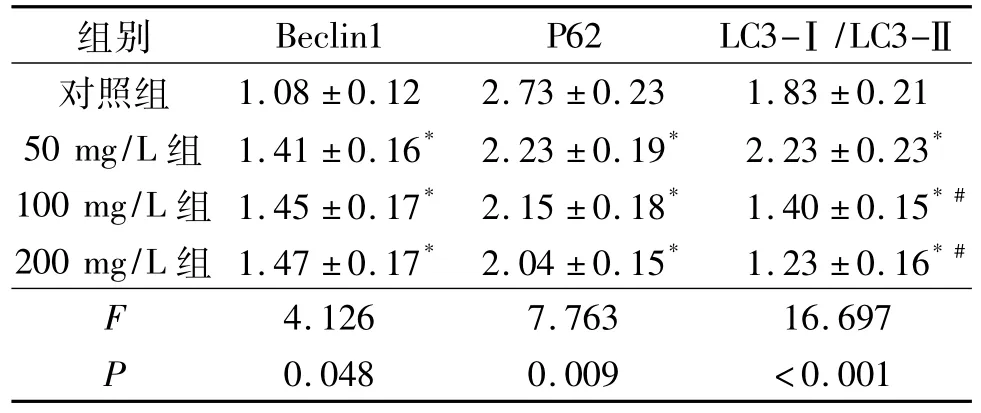
表2 各组ACHN细胞自噬相关蛋白表达水平的比较(n=3)
2.4 各组细胞 PI3K/p-PI3K、AKT/p-AKT和m TOR蛋白表达水平的比较 结果见图5、表3。AKT蛋白的细胞定位见图6。
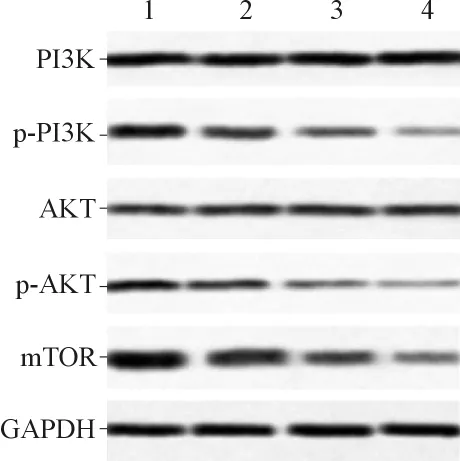
图5 各组ACHN细胞PI3K/p-PI3K、AKT/p-AKT和m TOR蛋白的表达
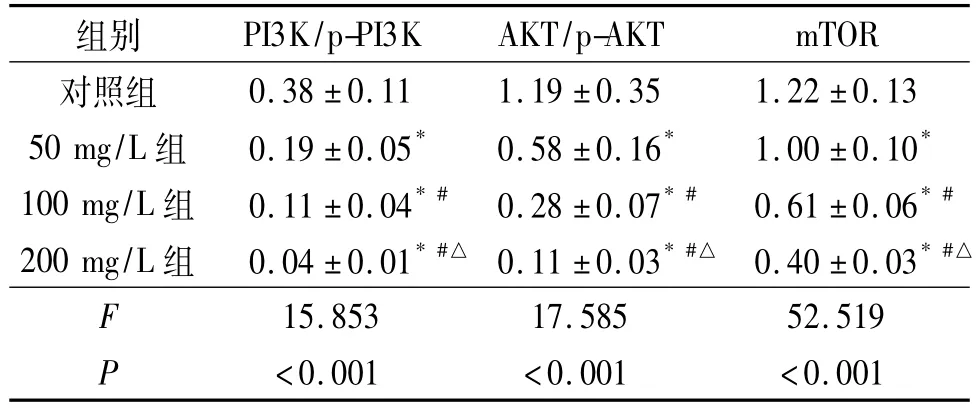
表3 各组ACHN细胞PI3K/p-PI3K、AKT/p-AKT和m TOR蛋白表达水平的比较(n=3)
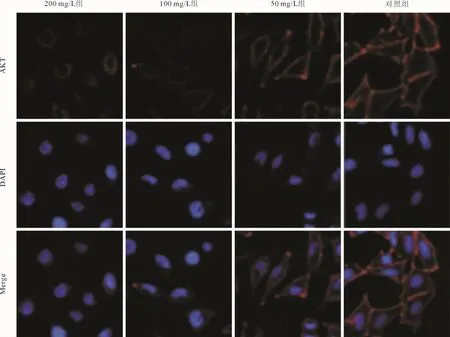
图6 各组ACHN细胞AKT蛋白表达的定位(×100)
3 讨论
肾癌是泌尿系肿瘤死亡的第三大原因[6]。主要病理类型为透明细胞癌、乳头状癌和嫌色细胞癌等,其中以透明细胞癌最为常见,约占90%[7]。在泌尿系统恶性肿瘤中发病率仅次于膀胱癌[8]。
海参多糖是从海参中提取的天然生物来源的抗肿瘤活性药物,具有广谱、高效等优点。在该研究中作者发现,与对照组相比,海参多糖可降低ACHN细胞活力。此外,海参多糖可限制ACHN细胞的球形成能力,降低增殖标志物(Ki-67和PCNA)的表达。以上结果表明海参多糖通过抑制增殖来抑制ACHN细胞活力。细胞凋亡是线粒体膜电位丧失、细胞色素C释放到胞质溶胶中以及随后在有核细胞中激活 Caspase-9的特征[9-12],然后 Cleaved Caspase-9激活效应子Cleaved Caspase-3。该研究结果表明随着海参多糖质量浓度的增加,凋亡率也随之增加。此外,在海参多糖的影响下,凋亡相关蛋白(Cleaved Caspase-3和Cleaved Caspase-9)的表达水平也增加。这些结果证实了海参多糖在ACHN细胞中的促凋亡作用。自噬是各种病理生理过程中的重要机制[13-15]。该研究结果显示,海参多糖可增加自噬相关蛋白如Beclin的表达水平,而P62的表达水平下降。这些结果表明海参多糖可以有效增强ACHN细胞的自噬。AKT/mTOR途径在多种肿瘤中是基因靶向的,因此通常被作为癌症驱动因子激活[16-18]。它参与调节各种细胞功能,包括分化、细胞增殖、存活、黏附、运动和侵袭[19]。肿瘤发生所必需的AKT信号传导的一个主要下游效应物是mTOR,它参与调节哺乳动物细胞中的自噬。该研究结果显示,海参多糖可增加PI3K、AKT磷酸化水平,表明PI3K/AKT/mTOR途径被活化。
综上,该研究结果表明海参多糖可通过PI3K/AKT/mTOR途径增强肾癌细胞中自噬相关的细胞凋亡,相关机制仍需要进一步的研究来验证。
