COX-2抑制剂对慢性前列腺炎大鼠射精时间的影响
2019-09-27张天标吕坤龙贾东辉张卫星
郑 涛,王 瑞,张天标,吕坤龙,贾东辉,杨 帆,张卫星
郑州大学第一附属医院泌尿外科郑州450052
慢性前列腺炎(chronic prostatitis,CP)和早泄(premature ejaculation,PE)均为泌尿外科和男科常见病。CP通常表现为尿频、尿急、尿痛和夜尿增多等排尿症状的改变以及骨盆区域疼痛,在成年男性中发病率约为8.4%[1]。PE定义为总是或几乎总是发生在插入阴道以前或插入阴道的1 min以内射精,完全或几乎完全缺乏控制射精的能力,并造成苦恼、忧虑、挫折和(或)回避性亲热等不良后果。PE影响20%~30%成年男性,可分为原发性PE和继发性PE[2]。CP是最易导致继发性 PE 的疾病[3]。虽然CP导致PE的机制尚不清楚,但多认为与前列腺部尿道炎症以及疼痛有关。COX-2抑制剂具有较强的抗炎镇痛作用,能有效缓解CP患者的症状,降低 NIH-CPSI评分[4-5]。5-羟色胺(5-hydroxytryptamin,5-HT)是一种重要的中枢神经递质,对炎症、疼痛和性行为都有调控作用。本研究应用自身免疫方法建立CP大鼠模型,观察了COX-2抑制剂对CP大鼠射精时间的影响,并通过检测5-HT及其受体水平的变化,对CP合并PE的机制作了初步探讨。
1 材料与方法
1.1 实验动物和主要试剂 SPF级Wistar大鼠90只(体重250~300 g,3~4个月龄),其中雄性54只,雌性36只,购自河南省实验动物中心。苯甲酸雌二醇注射液和黄体酮注射液购自天津金耀氨基酸有限公司;完全弗氏佐剂、不完全弗氏佐剂和Triton X-100购自美国Sigma公司;BCA蛋白定量试剂盒购自北京康为世纪生物科技有限公司;COX-2抑制剂塞来昔布胶囊由辉瑞制药有限公司提供;5-HT抗体(ab10385)购自美国Abcam公司;5-HT1A抗体(sc-10801)、5-HT2C 抗体(sc-10802)、5-HT 转运体(5-HTT)抗体(sc-13997)购自美国Santa Cruz公司;山羊抗兔鼠通用二抗(HRP)、免疫组化试剂盒和DAB显色剂购自丹麦 Dako公司;IL-1β和 TNF-α ELISA试剂盒购自美国R&D Systems公司。
1.2 雄性大鼠分组 雌鼠切除双侧卵巢2周后,分别在交配实验前48 h和4 h皮下注射苯甲酸雌二醇20μg和黄体酮500μg(分别用0.1 mL的橄榄油溶解)来诱导雌鼠发情。造模前1周,每天19:00~21:00进行交配实验,用昏暗的红灯照明,调至可以看清和录像为止,把雄鼠和发情状态良好的雌鼠1∶1合笼,将连续5次筛选实验均表现出性行为的雄鼠视为性功能正常。将筛选出的具有正常性功能的雄鼠随机分为3组:模型组12只,COX-2抑制剂组10只,正常对照组10只。
1.3 CP大鼠模型的制备和给药 ①制备大鼠前列腺蛋白提取液:取性功能异常的雄性Wistar大鼠18只,脱脊处死,在无菌条件下剥取前列腺组织,称重后用冷生理盐水洗净,加入等体积Triton X-100生理盐水溶液,在冰水浴上用玻璃匀浆器制成匀浆,4℃ 12 000 r/min离心30 min,取上清液,采用BCA方法测定蛋白质浓度,再用0.01 mol/L pH 7.4 PBS将该蛋白提纯液浓度调至60 g/L备用。②制备CP模型:第0天,模型组和COX-2抑制剂组腹侧皮下多点注射大鼠前列腺蛋白提纯液和弗氏完全佐剂(用注射器互推法制成比例1∶1)混悬液1 mL。第21天,多点皮下注射大鼠前列腺蛋白提纯液和不完全弗氏佐剂(体积比1∶1)混悬液1 mL,以加强免疫。正常对照组于相同时间行皮下多点注射生理盐水1 mL。③第2次注射蛋白提纯液4周后,将大鼠戊巴比妥钠(35 mg/kg)腹腔注射麻醉,麻醉起效后,取下腹部正中切口,显露前列腺,仔细观察后关闭切口。12只模型组大鼠和10只COX-2抑制剂组大鼠前列腺充血水肿,提示造模成功。造模成功后开始灌胃给药,COX-2抑制剂组给予塞来昔布(用生理盐水制成1.8 g/L混悬液)18 mg/(kg·d);模型组和正常对照组给予生理盐水0.1 mL/(kg·d),随体重增加调整灌胃量。共给药4周。
1.4 交配实验 给药4周后行交配实验,观察并记录大鼠在30 min内的交配行为。骑跨潜伏期(mount latency,ML):即从测试开始到雄鼠第1次骑跨雌鼠的时间,有无插入均计数;插入潜伏期(intromission latency,IL):从测试开始到雄鼠有第1次插入的时间;射精潜伏期(ejaculation latency,EL):从雄鼠第1次插入到射精的时间。
1.5 取材 交配实验后,将大鼠戊巴比妥钠(35 mg/kg)腹腔注射麻醉,沿胸骨旁线迅速剪开大鼠胸腹腔,穿刺腹腔静脉,采血3~5 mL,在4℃冰箱放置2 h后2 000 r/min离心15 min,取上清液置于-70℃冰箱保存备用。显露心脏,将带有输液皮条的粗针头自心尖向上进针至主动脉起始端,用血管钳固定针头,剪开右心耳排液,快速灌注0.1 mol/L PBS。至肝脏变白,自右心耳流出的液体清亮停止灌注。模型组取6只大鼠,正常对照组和COX-2抑制剂组各取5只大鼠,用小止血钳从背部头端的椎骨开始仔细咬开棘突和椎板,完整取出脊髓,在冰上切取T13~L2和L5~S2段脊髓分别放入EP管,置于液氮保存。剩余的大鼠接着灌注40 g/L多聚甲醛约300 mL,先快后慢,至大鼠四肢强直僵硬后停止灌注。用上述方法取出T13~L2和L5~S2段脊髓后固定。
1.6 HE染色 上述取材后的大鼠,摘取前列腺组织,生理盐水洗净,放入多聚甲醛固定,4℃过夜,石蜡包埋切片,片厚4μm,HE染色后光镜下观察。
1.7 ELISA法检测大鼠血清细胞因子TNF-α、IL-1β的表达 严格按试剂盒说明书操作进行检测。
1.8 脊髓5-HT、5-HT1A、5-HT2C及5-HTT的检测 ①液氮保存的脊髓标本采用Western blot检测,利用凝胶分析软件Image-Plus行蛋白条带的灰度测定,用目的蛋白条带的灰度值除以内参β-actin的灰度值计算出目的蛋白相对表达量。②多聚甲醛溶液固定的脊髓标本采用免疫组织化学染色方法检测,每张切片随机挑选3个200倍视野进行拍照。以棕黄色为染色阳性。应用Image-Pro Plus 6.0软件分析每张照片阳性的累积光密度(IOD)值。
1.9 统计学处理 采用SPSS 19.0进行分析。各组大鼠交配实验结果,血清TNF-α和IL-8以及脊髓组织中 5-HT、5-HT1A、5-HT2C、5-HTT表达的比较采用单因素方差分析和SNK-q,检验水准α=0.05。
2 结果
2.1 前列腺组织形态学观察结果 模型组前列腺腺腔形态不规则,腺腔分泌物不均匀,腺上皮出现节段性坏死,间质见大量炎性细胞浸润。正常对照组未发现前列腺炎症。COX-2抑制剂组发现间质少量炎症细胞浸润(图1)。
2.2 各组大鼠交配实验结果 COX-2抑制剂组较模型组ML、IL缩短,EL延长,见表1。
2.3 各组大鼠血清 TNF-α、IL-1β结果 见表2。模型组IL-1β和TNF-α水平显著高于正常对照组(P <0.05)。
2.4 T13~L2和 L5~S2脊髓组织 5-HT、5-HT1A、5-HT2C及5-HTT蛋白的表达 结果见图2、3和表3~6。
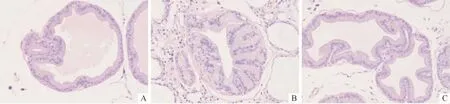
图1 各组大鼠前列腺组织形态学表现(HE,×200)
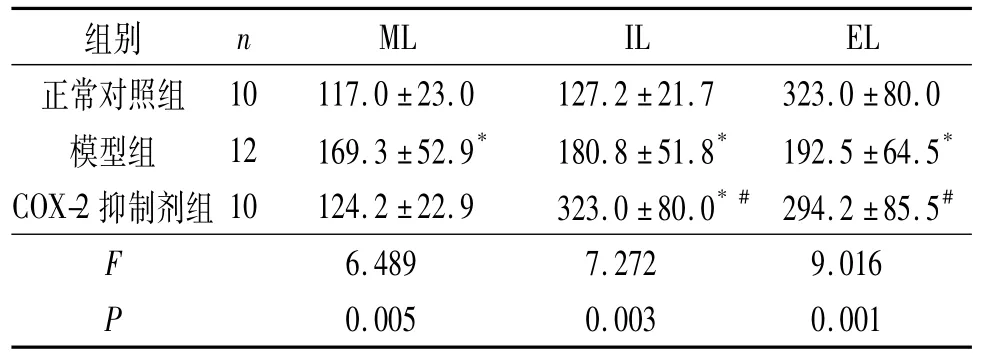
表1 各组大鼠M L、IL和EL的比较 s
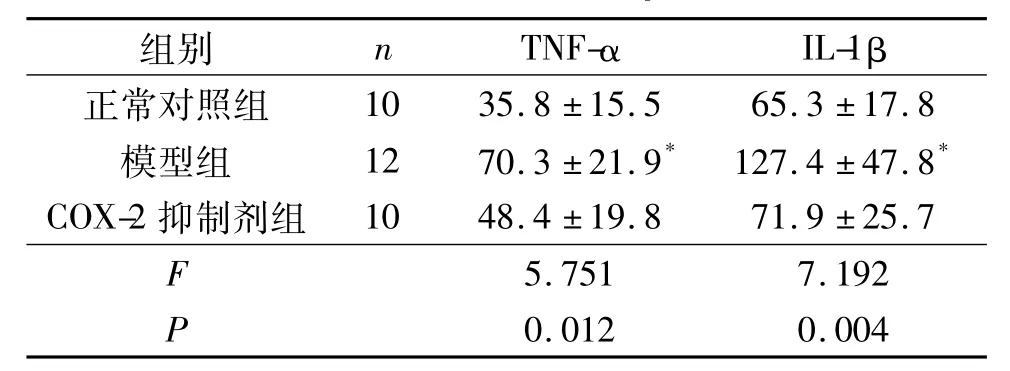
表2 各组大鼠血清TNF-α和IL-1β水平的比较 ng/L
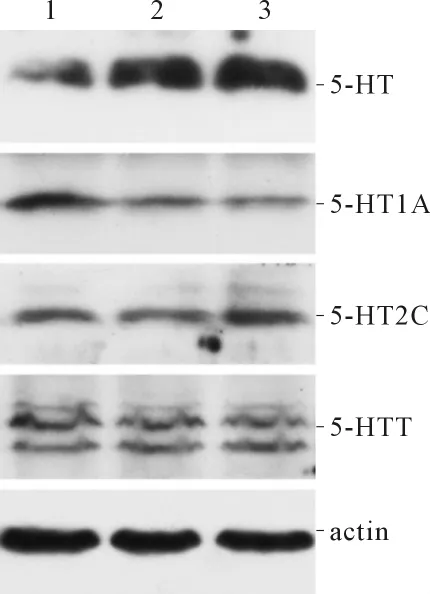
图2 大鼠T13~L2脊髓组织中5-HT、5-HT1A、5-HT2C及5-HTT的表达
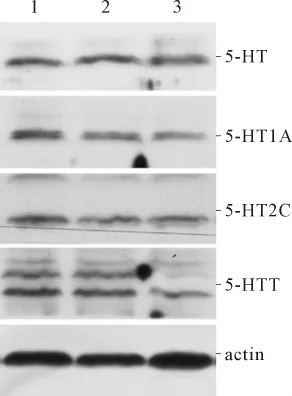
图3 各组大鼠L5~S2脊髓组织中5-HT、5-HT1A、5-HT2C及5-HTT的表达
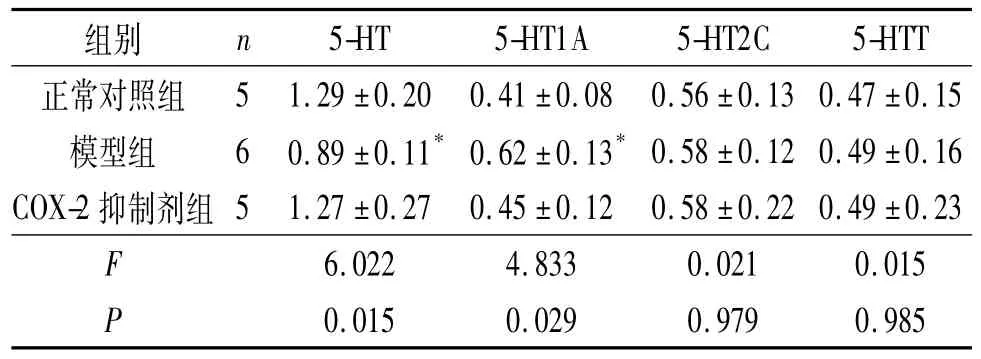
表3 各组大鼠T13~L2脊髓组织中5-HT、5-HT1A、5-HT2C及5-HTT表达的比较
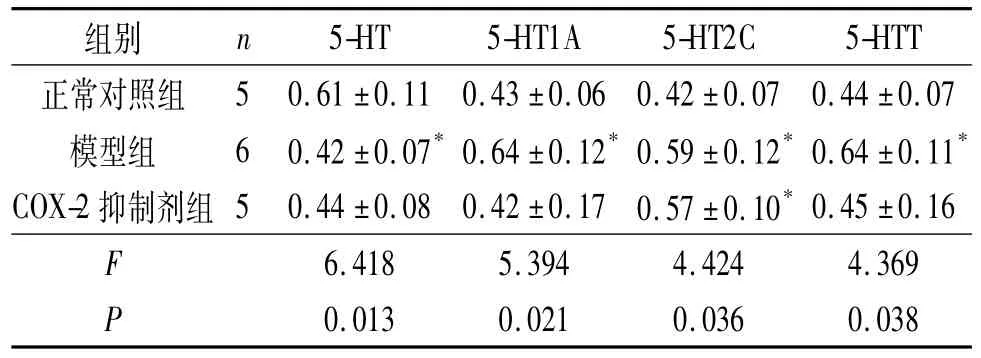
表4 各组大鼠L5~S2脊髓组织中5-HT、5-HT1A、5-HT2C及5-HTT的表达
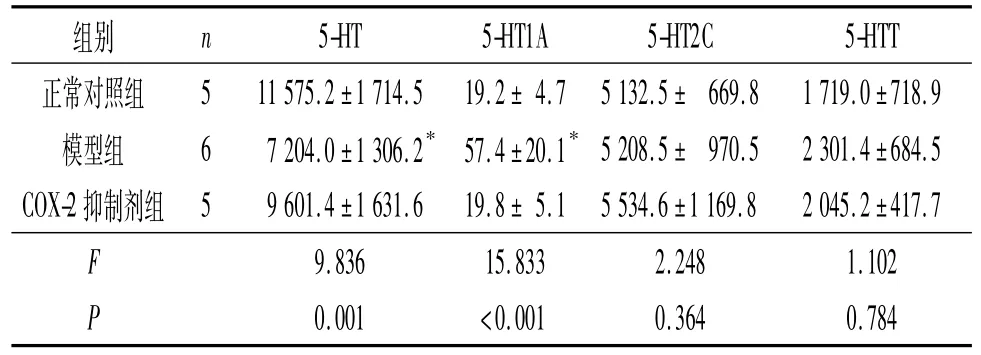
表5 各组大鼠T13~L2脊髓5-HT、5-HT1A、5-HT2C及5-HTT阳性区域累计IOD比较
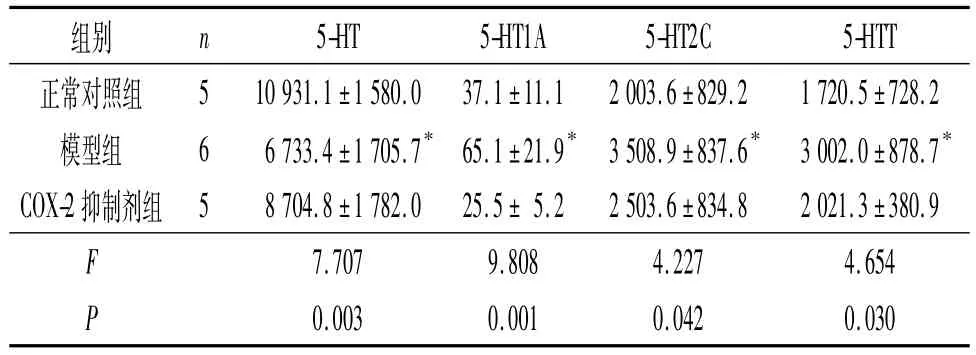
表6 各组大鼠L5~S2脊髓5-HT、5-HT1A、5-HT2C及5-HTT阳性区域累计IOD
3 讨论
CP和PE关系密切,是最易导致继发性PE的疾病[3,6]。多数学者认为PE与前列腺部尿道炎症以及疼痛有关。COX-2是催化花生四烯酸转变为前列腺素和其他前列腺素物质的限速酶,参与疼痛、肿胀、发热等炎症反应,特异性COX-2抑制剂可选择性抑制COX-2的致炎及致痛作用。临床研究[4-5]证实,COX-2抑制剂能缓解 CP症状,降低 NIH-CPSI评分。本研究结果显示,模型组大鼠前列腺上皮出现节段性坏死,间质见大量炎性细胞浸润,呈现典型的前列腺炎表现,而COX-2抑制剂组大鼠前列腺仅间质见少量内淋巴细胞浸润,炎症轻微。交配实验结果显示COX-2抑制剂组EL较模型组明显延长,与正常组无明显差异,提示COX-2抑制剂可有效控制前列腺炎症,且显著延长CP大鼠射精时间。
5-HT是一种重要的中枢神经递质,参与调节伤害感受、情感、认知、应激反应、性行为等多种认知和行为功能,其必须与相应的受体结合才能发挥生物学效应[7]。5-HT对炎症、疼痛和性行为都有调控作用。5-HT在射精过程中起着调控作用,目前发现有三种受体亚型参与了射精调控:5-HT1A、5-HT1B和5-HT2C受体。激活5-HT1A受体降低射精阈值,使射精潜伏期缩短,加速射精;与之相反,激活5-HT1B和5-HT2C受体可提高射精阈值,使射精潜伏期延长,延缓射精[7]。另外,5-HT释放入突触间隙后,可通过突触前膜上的5-HTT重新被摄取,从而降低射精阈值,加速射精。选择性5-HT再摄取抑制剂就是通过降低突触前膜5-HTT活性达到治疗PE的效果[8]。
细胞因子能够通过p38 Mapk途径上调5-HTT的表达和活性,促进5-HT的再摄取,从而降低5-HT水平[9]。Zhang等[10]发现,5-HT1AmRNA广泛分布于腰部脊髓灰质背角,应用角叉菜胶引发外周炎症性疼痛后,同侧脊髓灰质背角5-HT1A受体mRNA表达升高,8 h后达峰值。Wang等[11]应用蜂毒引发外周炎性疼痛后的1 h和4 h,同侧腰部脊髓灰质背角5-HT1A mRNA表达均升高,应用反义寡核苷酸技术敲除大鼠5-HT1A基因,其自发痛和热痛敏程度均明显减轻。研究[1]证实CP可导致机体细胞因子等炎症指标升高,而且CP的主要症状是骨盆区疼痛,CP也可以引起脊髓5-HT及其受体水平的变化。张述蓉等[12]用免疫组化及RT-PCR法检测CP大鼠脊髓5-HT及各受体的表达,发现5-HT在CP大鼠脊髓T13~L2、L3~L4和L5~S1 3个节段表达均下降。本研究结果显示,与正常对照组相比,模型组血清IL-1β和TNF-α水平升高,T13~L2及L5~S2脊髓5-HT水平下降、5-HT1A水平升高,L5~S2脊髓5-HTT升高,与预期结果相符。
已经证实前列腺的脊髓控制中枢位于T13~L2和L5~S2[13],和位于T12~L1的泌精中枢和位于S2~S4的射精中枢[7]有部分重合。作者推测CP导致的脊髓5-HT及其受体水平的变化是CP并发PE的根本原因。本研究交配实验结果显示,模型组EL较正常对照组显著缩短;而COX-2抑制剂组前列腺炎症轻微,细胞因子水平、脊髓5-HT及其受体水平、EL同正常对照组差异无统计学意义,提示COX-2抑制剂可以减轻前列腺炎对脊髓5-HT递质系统的影响,从而延长大鼠射精时间。
综上所述,CP大鼠EL缩短,与前列腺炎症所致的脊髓5-HT水平下降、5-HT1A及5-HTT水平升高有关。COX-2抑制剂可以减轻前列腺炎对脊髓5-HT递质系统的影响,从而延长大鼠射精潜伏期,提示COX-2抑制剂可以用于治疗CP所致的继发性PE。
