上调抗增殖蛋白表达对TNF-α诱导的H9c2心肌细胞损伤的影响
2019-09-27郭桂喜银鹏飞陈文强
张 杰,刘 亮,周 辉,郭桂喜,于 强,银鹏飞,陈文强,苏 兴)
1)北大医疗鲁中医院心血管内科山东淄博255400 2)北京大学国际医院心内科北京102200 3)山东大学齐鲁医院心内科济南250012
急性心肌梗死严重影响人类的生命健康。炎症反应是心肌损伤发生的重要原因,心肌梗死后的炎症反应可以促进心力衰竭等的发生[1-2]。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是机体内关键的炎症因子,在心力衰竭、动脉粥样硬化等心血管系统疾病中发挥促进作用,能够诱导心肌细胞损伤[3-4]。抗增殖蛋白(prohibitin,PHB)是一种核基因编码的蛋白质,具有维持心肌细胞正常功能、减少心肌细胞凋亡的作用[5]。研究[6]表明,过表达PHB具有保护高糖诱导心肌细胞的作用。本实验以心肌细胞H9c2为研究对象,通过构建TNF-α心肌细胞炎症损伤模型,探讨PHB在心肌细胞炎症损伤中的作用,为明确心肌损伤发生机制奠定基础。
1 材料与方法
1.1 材料 心肌细胞H9c2购自武汉普诺赛生命科技有限公司;PHB上游引物序列 :5’-GGAG GCGTGGTGAACTCTG-3’,下游引物序列:5’-CTG GCACATTACGTGGTGGAG-3’;GAPDH上游引物序列:5’-CTGTTGCTGTAGCCAAATTCGT-3’,下游引物序列:5’-CTGTTGCTGTAGCCAAATTCGT-3’;引物均由生工生物工程(上海)股份有限公司设计并合成。过表达PHB的慢病毒(Lv-PHB)和阴性对照慢病毒(Lv-NC)由南京科佰生物科技有限公司构建;重组TNF-α购自美国Thermo公司;SYBR Green Realtime PCR试剂盒购自上海索莱宝生物科技有限公司;活化型 Caspase-3(Cleaved Caspase-3)抗体、CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein C/EBP,CHOP)抗体、活化型Caspase-12(Cleaved Caspase-12)抗体购自美国CTS公司;PHB抗体购自武汉福来生物工程有限公司;乳酸脱氢酶(LDH)含量检测试剂盒购自碧云天生物技术研究所。
1.2 细胞培养及分组处理 心肌细胞H9c2在37℃体积分数5%CO2培养箱中用含有体积分数10%胎牛血清的DMEM培养,当H9c2细胞密度为40%时,在细胞中添加Lv-PHB和Lv-NC病毒液(MOI=10),继续培养12 h以后,吸弃病毒液,加入新鲜的细胞培养液,3 d后,用1 mg/L的嘌呤霉素筛选(5 d)。用qRT-PCR和 Western blot检测细胞中 PHB的表达,评估感染效率。取感染Lv-PHB和Lv-NC的H9c2细胞,用含有20μg/L的TNF-α细胞培养液培养24 h作为 Lv-PHB+TNF-α组和 Lv-NC+TNF-α组,以未感染且不用TNF-α处理的H9c2细胞作为对照组,以未感染、仅用20μg/L的 TNF-α细胞培养液培养24 h的H9c2细胞作为TNF-α组。
1.3 qRT-PCR检测细胞中PHB m RNA的表达
取上述4组细胞,吸除上清液,添加Trizol裂解液,按照细胞RNA提取试剂盒操作说明提取RNA。用DEPC水溶解RNA并分装,-80℃冰箱保存用于后续实验。取适量RNA,用cDNA第一链合成试剂盒进行反转录,cDNA在-80℃中保存。取cDNA,以GAPDH为内参,采用SYBR Green Realtime PCR试剂盒进行扩增。PCR反应体系:2.5×Real Master Mix/SYBR 液9.0 μL,上、下游引物各0.4 μL,cDNA 1μL,超纯水9.2μL。反应条件:95℃预变性10 min;95℃变性15 s,62℃退火30 s,68℃延伸30 s,共38个循环。按照2-ΔΔCt方法计算PHB mRNA表达水平。实验重复3次。
1.4 W estern blot检测细胞中PHB蛋白的表达取上述4组细胞,在细胞中添加含有PMSF的细胞裂解液,离心后吸取上清,-80℃保存。按照BCA法对蛋白进行定量。按照常规方法配制分离胶和浓缩胶,上样量40 μg,设置电泳为恒压90 V,2.5 ~3 h后取出凝胶,在冰水混合物上进行转膜(约60 min,转膜电流200 mA)。把转膜后的NC膜放在50 g/L牛血清白蛋白中孵育2 h,加PHB一抗(按1∶800稀释),4℃摇床过夜,再与二抗(按1∶2 000稀释)室温结合2 h,ECL发光。最后用Quantity One软件对蛋白条带进行定量,以GAPDH作为内参,分析蛋白表达水平。实验重复3次。
1.5 M TT检测细胞的增殖活性 将H9c2细胞种植到96孔板内,按照1.2分组处理,培养24 h后取出培养板,每孔添加20μL MTT,孵育4 h。吸除上清液,添加150μL DMSO,待结晶物溶解以后,检测490 nm波长的吸光度(A)。细胞存活率=实验组A/对照组A×100%。实验重复3次。
1.6 比色法检测细胞LDH漏出率 收集4组细胞培养液上清和细胞,分别检测LDH含量,步骤同LDH含量检测试剂盒。LDH漏出率=上清中LDH含量/(上清中LDH含量+细胞中LDH含量)×100%。实验重复3次。
1.7 双染法检测细胞的凋亡情况 收集4组细胞,吸弃上清溶液,胰蛋白酶消化成单细胞悬液,添加PBS将细胞悬浮以后,继续加入400μL结合缓冲液,添加PI和Annexin V-FITC各5μL,在60 min内用流式细胞仪检测。实验重复3次。
1.8 W estern blot检测细胞中 Cleaved Caspase-3、CHOP、Cleaved Caspase-12蛋白的表达 收集4组细胞,用 Western blot方法检测细胞中 Cleaved Caspase-3、CHOP、Cleaved Caspase-12 蛋白的表达水平,步骤同1.4。实验重复3次。
1.9 统计学处理 采用SPSS 21.0进行数据分析,应用单因素方差分析和SNK-q检验比较4组心肌细胞中PHB表达、细胞存活率、LDH漏出率、凋亡率、细胞中Cleaved Caspase-3、CHOP和Cleaved Caspase-12蛋白表达的差异,检验水准α=0.05。
2 结果
2.1 4组心肌细胞中PHB的表达 见表1。由表1可知,与对照组比较,TNF-α组细胞中PHB表达下调,Lv-PHB+TNF-α组细胞中PHB蛋白和mRNA表达水平均较TNF-α组升高。
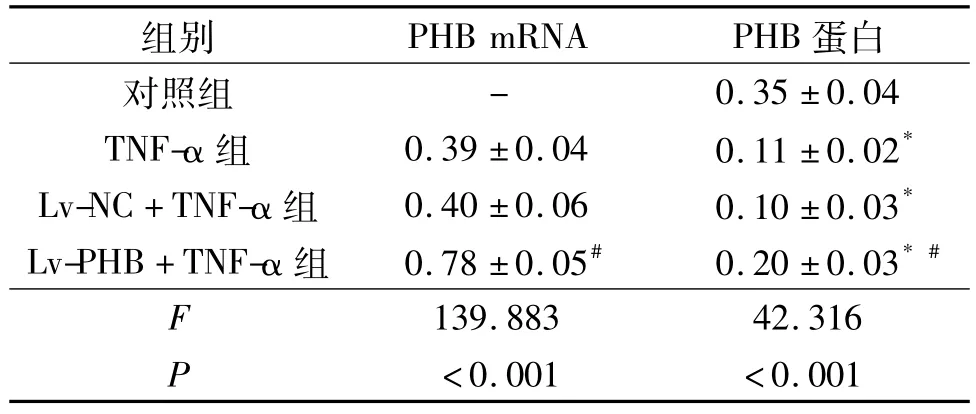
表1 4组心肌细胞中PHB表达的比较(n=3)
2.2 4组心肌细胞存活率、LDH漏出率的比较
见表2。由表2可知,与对照组比较,TNF-α组细胞存活率降低,LDH漏出率升高;与TNF-α组比较,Lv-PHB+TNF-α组细胞存活率升高,LDH漏出率降低。
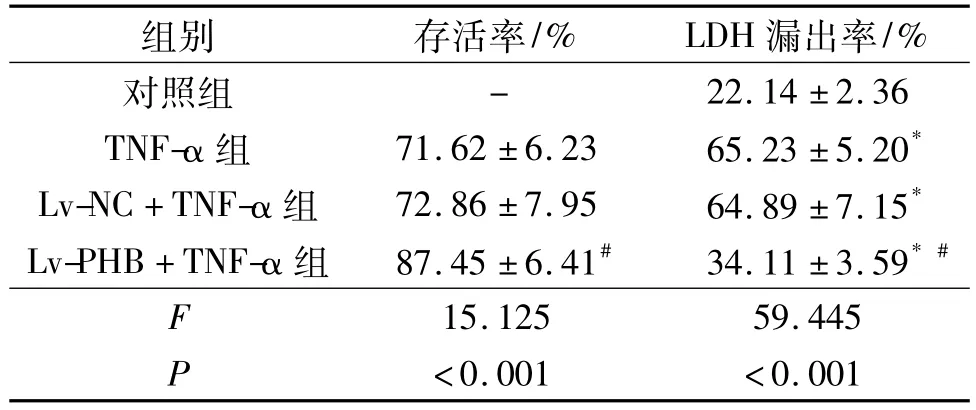
表2 4组心肌细胞存活率、LDH漏出率比较(n=3)
2.3 4组心肌细胞凋亡率及Cleaved Caspase-3蛋白表达水平比较 见表3。由表3可知,与对照组比较,TNF-α组细胞凋亡率和Cleaved Caspase-3蛋白表达水平升高;与TNF-α组比较,Lv-PHB+TNF-α组细胞凋亡率和Cleaved Caspase-3蛋白表达水平降低。
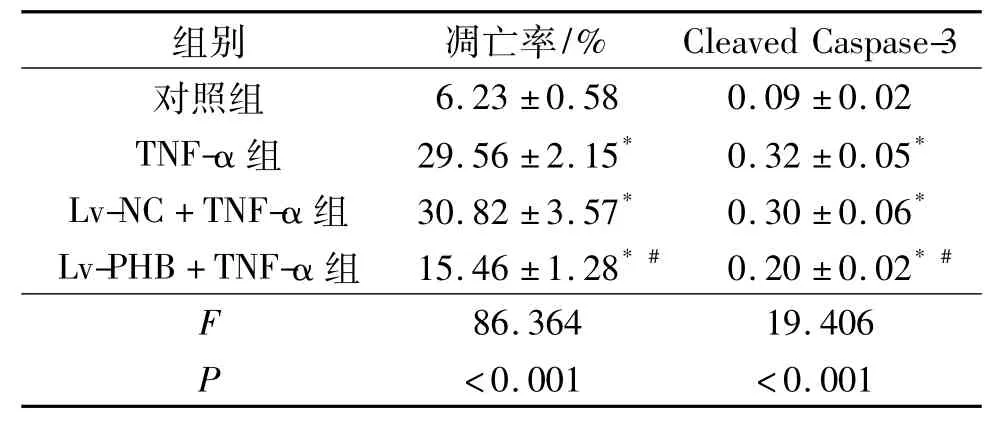
表3 4组心肌细胞凋亡率及Cleaved Caspase-3蛋白表达水平比较(n=3)
2.4 4组心肌细胞中CHOP和Cleaved Caspase-12蛋白表达水平比较 见表4。由表4可知,与对照组比较,TNF-α组细胞中 CHOP和 Cleaved Caspase-12蛋白表达水平升高;与TNF-α组比较,Lv-PHB+TNF-α组细胞中 CHOP和 Cleaved Caspase-12蛋白表达水平降低。
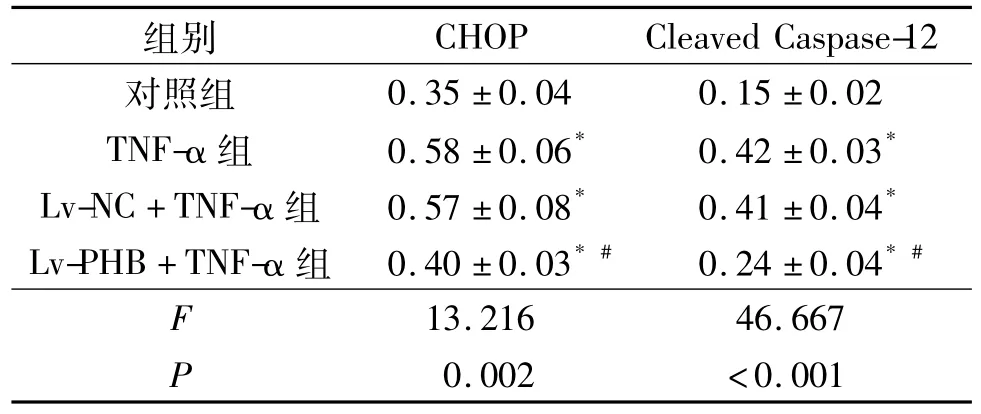
表4 4组心肌细胞中CHOP和Cleaved Caspase-12蛋白表达水平比较(n=3)
3 讨论
TNF-α是机体内重要的促炎症因子,其在心肌缺血再灌注、心力衰竭等过程中过度表达[7-8],巨噬细胞、心肌细胞、成纤维细胞等多种类型的细胞均可以分泌TNF-α,该细胞因子参与细胞生长、凋亡等过程。研究[9]表明,TNF-α诱导的心肌细胞损伤是心血管系统疾病发生的重要原因。本实验结果表明,经TNF-α处理后,心肌细胞存活率降低,LDH漏出率升高,提示TNF-α诱导了心肌细胞损伤,这与之前的研究结果相符合。
PHB定位于12q13染色体上,其主要在线粒体、细胞核内表达,参与调控细胞的生长、凋亡、衰老等过程[10]。在缺血再灌注损伤的兔心肌细胞线粒体中PHB表达下调;过量的PHB可以减少H2O2诱导的心肌细胞凋亡,提高心肌细胞活性[5]。PHB还拮抗糖尿病心肌细胞损伤过程,过表达PHB可以减少高糖诱导的心肌细胞凋亡;PHB高表达参与了AG490 减轻缺氧复氧诱导的心肌细胞损伤[6,11-12]。本实验结果显示,PHB表达上调后经TNF-α处理的心肌细胞增殖活性升高,LDH漏出率降低,细胞凋亡率也降低,表明PHB具有减轻TNF-α对心肌细胞损伤的作用,其机制可能与减少心肌细胞凋亡有关。
内质网介导的细胞凋亡与非折叠蛋白反应、钙离子起始信号等有关,CHOP是内质网应激元件基因,在内质网应激发生时高表达,CHOP表达上调是内质网应激引起的直接结果[13]。Caspase-12是内质网应激诱导细胞凋亡发生的主要因素,其定位于内质网的胞浆面,可以被钙离子平衡破坏、内质网中过量蛋白沉积等引起的内质网应激激活,其在非内质网应激诱导的细胞凋亡中不活化[14]。Caspase-12酶原活化后形成 Cleaved Caspase-12,诱导活化Caspase凋亡途径,最终导致Caspase-3的活化,而Caspase-3活化是细胞凋亡进入不可逆阶段的标志之一[15]。本实验结果显示,上调PHB表达可以降低TNF-α处理的心肌细胞中 CHOP和 Cleaved Caspase-12、Cleaved Caspase-3表达水平,提示 PHB可能通过降低心肌细胞内质网应激水平发挥保护作用,其具体的靶向作用位点尚不明确,在以后的实验中会进行探讨。
总之,上调PHB表达可以减轻TNF-α对心肌细胞的损伤。本实验没有在原代心肌细胞中进行验证,对于其具体的调控机制尚未研究,在以后的实验中会对上述不足部分进行探讨。
